溶血卵磷脂在内皮细胞泡沫化模型中的作用探讨
冠状动脉粥样硬化性心脏病已经成为当今社会影响人类健康的重要疾病,目前病因尚未完全明确,一般认为动脉粥样硬化是多病因疾病,是多因素共同作用的结果。近年来多数学者支持“内皮损伤反应学说”,认为本病的各种主要危险因素最终都损伤动脉内膜,其中高血脂损伤内皮细胞导致脂肪沉积出现不同程度的内皮细胞泡沫化,被认为是动脉粥样硬化的最重要的危险因素[1-2],血管内皮的损害是动脉粥样硬化的始动因素[3-4]。氧化型低密度脂蛋白 (ox-LDL) 是主要的致动脉粥样硬化因素[5-6],ox-LDL 的主要活性成分是溶血卵磷脂(lysophosphatidylcholine,lpc),lpc 能模拟 ox-LDL 致动脉粥样硬化作用[7-9]。目前很多文献报道用lpc干预人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)制作内皮脂质化损伤的泡沫化细胞模型。如何制作理想的内皮脂质化损伤的泡沫化细胞模型,是进一步实验研究的基础。目前在很多文献里一般都仅仅关注了lpc的终浓度,也就是lpc的绝对浓度对细胞模型成败的影响,但是笔者在多次制作内皮脂质化损伤的泡沫化细胞模型实践中发现, lpc的相对浓度对内皮脂质化损伤的泡沫化细胞模型的成败也很重要,lpc的相对浓度主要通过细胞不同的接种密度和lpc不同的干预终体积来体现。希望本文总结的实验经验能够给制作内皮脂质化损伤的泡沫化细胞模型的初学者一些借鉴。
1 材料和方法
1.1 主要试剂与仪器 CKX41显微镜:Olympus公司; CO2细胞培养箱:Thermo公司;生物安全柜:BAKER公司;ECM培养基: Sciencell公司;溶血卵磷脂(lpc):Sigma公司; DMEM basic:Gibco公司;红油O试剂盒:ScienCell公司。
1.2 实验细胞 HUVECs购于美国ATCC。
1.3 实验方法
1.3.1 lpc配制:称取lpc 2.5 mg放于灭菌EP管中,用无血清DMEM 25 ml,配制成浓度为100 mg/L的lpc母液,以0.22 μm混合纤维素微孔滤膜正压过滤除菌,分装后-20 ℃保存备用。
1.3.2 细胞活力检测:采用细胞增殖和毒性检测试剂盒(CCK-8)进行检测,上述细胞活力检测实验按照试剂盒使用说明进行操作,加入CCK-8后1 h,酶标仪读取各组OD值反映所在组的细胞活力。细胞存活率(%)=(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)×100 %。
1.3.3 HUVECs的不同接种密度对lpc干预后细胞存活率的影响:实验分6组,每组分别设对照组和实验组,每组3个复孔, HUVECs接种于96孔板,HUVECs的不同接种密度分别为A组 0.5×104/孔、B组 0.75×104/孔、C组 1.0×104/孔、D组 1.25×104/孔、E组 1.5×104/孔、F组 2×104/孔,每孔加入终体积100 μl ECM完全培养基培养12 h后换液,对照组加入无lpc无血清DMEM,终体积100 μl,实验组参照文献[8-9]常用的方法,用终浓度含10 μg/ml lpc的无血清DMEM,终体积100 μl;培养24 h检测细胞活力。
1.3.4 不同浓度的lpc对HUVECs细胞存活率的影响:实验分5组,每组3个复孔。A组:对照组,无lpc;B组:lpc 5 μg/ml;C组:lpc 10 μg/ml;D组:lpc 20 μg/ml;E组: lpc 40 μg/ml。HUVECs接种于96孔板,细胞密度1.0×104/孔,每孔加入终体积100 μl ECM完全培养基培养12 h后换液,A组加入终体积为100 μl无lpc无血清DMEM;B、C、D、E组加入lpc的终浓度分别为5 μg/ml、10 μg/ml、20 μg/ml、40 μg/ml的无血清DMEM 100 μl继续培养24 h测细胞活力。
1.3.5 lpc的不同干预体积对HUVECs细胞存活率的影响:实验分6组,每组分别设对照组和实验组,每组3个复孔, HUVECs接种于96孔板,对照组与实验组的HUVECs的密度均为1.0×104/孔,每孔加入终体积100 μl ECM完全培养基培养12 h后换液,根据实验设计换液后各组加入培养液的终体积分别为A组 50 μl,B组75 μl, C组100 μl,D组125 μl,E组150 μl,F组200 μl,每个对照组为无lpc无血清DMEM,每个实验组为含终浓度10 μg/ml lpc同体积的无血清DMEM,培养24 h检测细胞活力。
1.3.6 初次与再次脂质化损伤的HUVECs存活率变化实验:实验分2组,每组分别设对照组与实验组,各组3个复孔。A组 初次脂质化组: 对照组,HUVECs接种于96孔板,加终体积100 μl ECM完全培养基培养12 h,换无血清DMEM终体积100 μl继续培养24 h,用于检测;实验组,HUVECs接种于96孔板,加终体积100 μl ECM完全培养基培养12 h,换终浓度10 μg/ml lpc的无血清DMEM终体积100 μl继续培养24 h,用于检测。B组 再次脂质化组: 对照组,取初次脂质化经过lpc干预24 h后的HUVECs,再次胰酶消化传代接种于96孔板,后续培养及干预条件与A组对照组相同;实验组,取初次脂质化经过lpc干预24 h后的HUVECs,再次胰酶消化后接种于96孔板,后续培养及干预条件与A组实验组相同。
1.3.7 lpc干预后内皮细胞泡沫化检测:HUVECs接种于96孔板,HUVECs接种密度为1.0×104/孔,培养液终体积100 μl/孔,实验分2组,每组3个复孔:A组,无lpc对照组,加入终体积100 μl ECM完全培养基培养12 h后换液,加入终体积为100 μl无lpc无血清DMEM继续培养24 h,用油红O试剂盒检测内皮细胞泡沫化。 B组,lpc干预组,HUVECs接种于96孔板,加入终体积100 μl ECM完全培养基培养12 h后换液,加入lpc终浓度为10 μg/ml终体积100 μl的无血清DMEM继续培养24 h,用油红O试剂盒检测内皮细胞泡沫化。内皮细胞泡沫化检测按照油红O试剂盒检测说明书进行操作。
2 结果
2.1 HUVECs的不同接种密度对lpc干预后细胞存活率的影响 结果显示随着内皮细胞接种密度的增加,lpc干预后细胞存活率随之增加,细胞接种密度在(0.5~1.5)×104/孔各组间细胞存活率差异均有统计学意义,2×104/孔组的细胞存活率比1.5×104/孔组稍有增高,2组间差异无统计学意义。各组细胞存活率结果见图1。
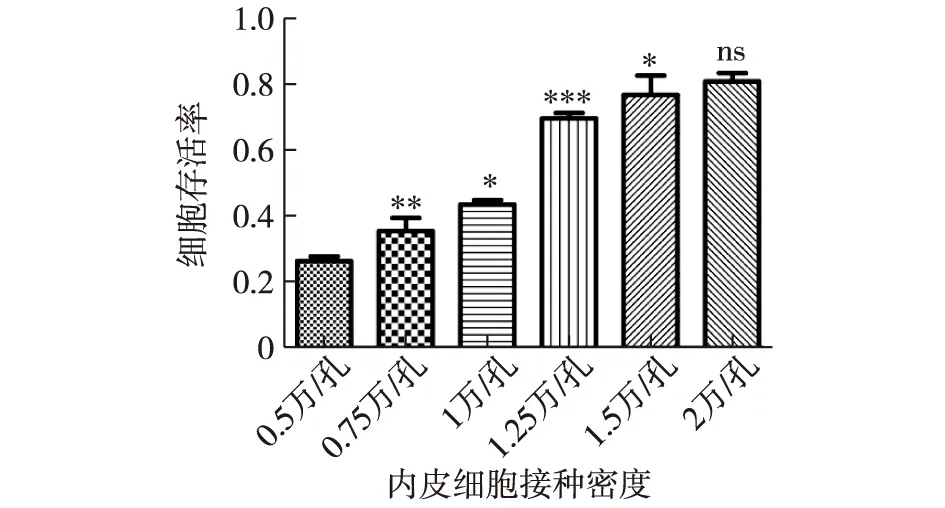
注:统计学结果均是每一组细胞存活率与相邻的前一组相比较;ns:P>0.05;*P<0.05;** P<0.01;***P<0.001图1 HUVECs的不同接种密度对lpc干预后细胞存活率的影响
2.2 不同浓度的lpc对HUVECs细胞存活率的影响 结果显示,lpc干预组各组间随着lpc浓度的增加,细胞存活率出现下降趋势,5 μg/ml组细胞存活率高达(89.96±3.06)%,40 μg/ml组细胞存活稀少,存活率仅有(5.18±0.88)% ,各组细胞存活率结果见图2。
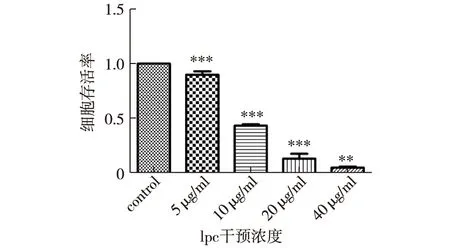
注:统计学结果均是每一组细胞存活率与相邻的前一组相比较;*P<0.05;** P<0.01;***P<0.001图2 不同浓度的lpc对HUVECs存活率的影响
2.3 lpc的不同干预体积对HUVECs细胞存活率影响的结果 在同样的细胞接种密度,同样的lpc浓度干预条件下,lpc不同的干预体积也是对细胞存活率显示出了明显的影响,从50 μl/孔到150 μl/孔各组细胞存活率随着lpc干预体积的增加细胞存活率逐渐降低,并且每组间都有统计学差异,200 μl/孔组的细胞存活率比150 μl/孔组的细胞存活率进一步降低,但是差异无统计学意义,各组细胞存活率结果见图3。
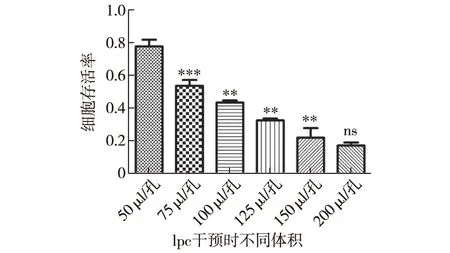
注:统计学结果均是每一组细胞存活率与相邻的前一组相比较;ns:P>0.05;*P<0.05;** P<0.01;***P<0.001图3 lpc的不同干预体积对HUVECs细胞存活率的影响
2.4 初次与再次脂质化损伤的HUVECs存活率实验结果 再次脂质化损伤的内皮细胞存活率比较特殊,不是因为再次受到lpc损伤而进一步下降,反而较初次脂质化损伤的细胞存活率出现了明显的升高,而且差异有统计学意义,各组细胞存活率结果见图4。
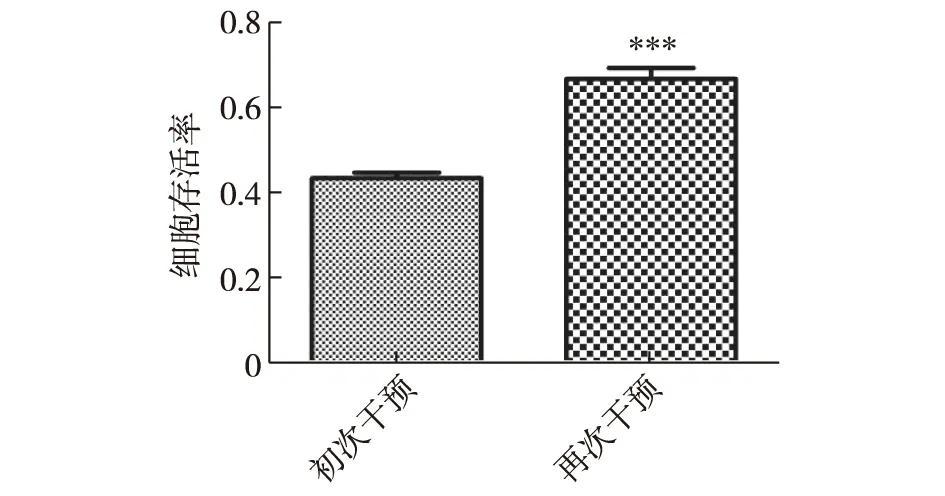
注:2组间比较,***P<0.001图4 初次与再次脂质化损伤的HUVECs存活率
2.5 lpc干预后内皮细胞泡沫化检测结果 结果显示无lpc干预的对照组HUVECs内未见油红O染色(见图5,6),lpc干预的实验组HUVECs内出现较多的油红O染色(见图7,8),提示HUVECs出现了泡沫化。
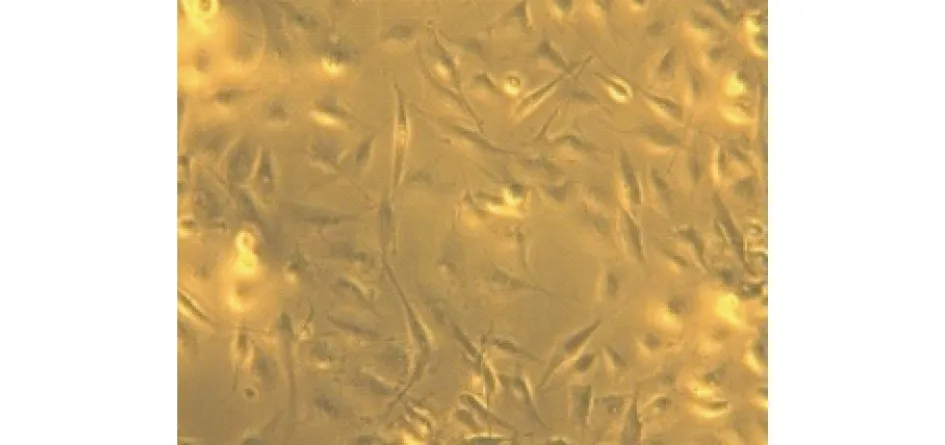
图5 对照组内皮细胞内未见油红O染色(显微镜启用颜色视野,×200)
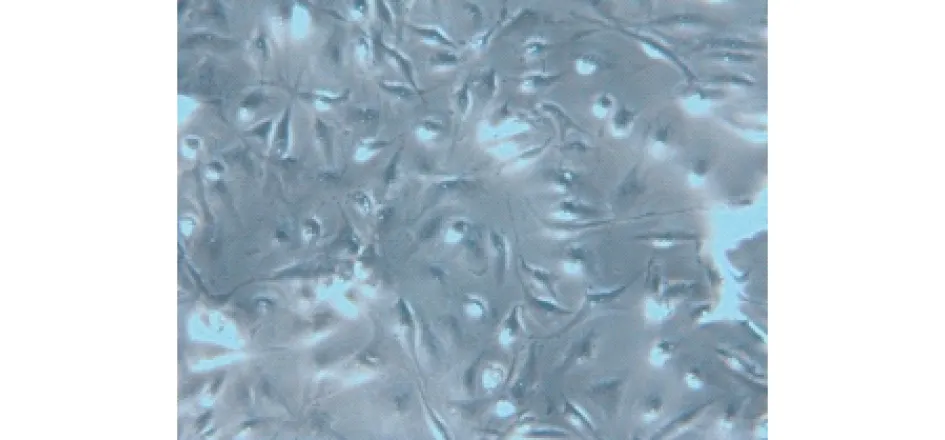
图6 对照组内皮细胞内未见油红O染色 (显微镜启用白平衡视野,×200)
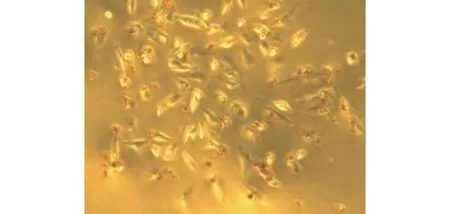
图7 lpc组内皮细胞内见油红O染色(显微镜启用颜色视野,×200)
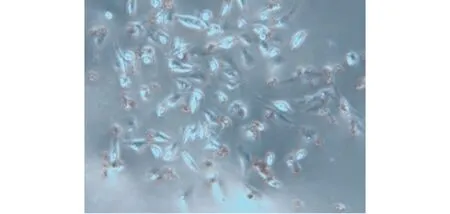
图8 lpc组内皮细胞内见油红O染色 (显微镜启用白平衡视野,×200)
3 讨论
本实验显示无lpc干预的对照组HUVECs内未见油红O染色,给予lpc干预的实验组HUVECs内出现较多的油红O染色,显示HUVECs出现了泡沫化,表明本实验成功制作了lpc脂质化损伤内皮的泡沫化细胞模型。有文献报道用油红O染色观察组织或细胞的脂质化程度[10-11],油红O染色量的多少可以反映HUVECs内的脂肪滴多少,是直观体现HUVECs泡沫化程度的一个指标。
本实验显示lpc 5 μg/ml时细胞存活率与对照组相比降低较少,lpc的浓度从10~40 μg/ml,各组细胞存活率明显下降,各组间有统计学差异。本实验显示lpc的浓度达20 μg/ml及40 μg/ml时细胞存活率仅为(13.31±4.46)%和(5.18±0.88)%,镜下观察存活细胞不仅数量稀少而且生长状态不好,难以用于有效实验研究,本实验结果与文献报道一致[12]。用lpc作用于HUVECs制作脂质化损伤内皮的泡沫化细胞模型时,一般都认为lpc的终浓度为10 μg/ml时是制作内皮脂质化损伤泡沫化细胞模型的适宜浓度,但是实践中发现在终浓度10 μg/ml的lpc干预条件下,不同的细胞接种密度和不同的lpc干预体积导致的细胞存活率差别很大,可能出现lpc干预组细胞存活率过低或者无lpc干预的对照组细胞增长过度密集,出现生长抑制的现象。
目前文献报道在进行lpc干预HUVECs的脂质化损伤实验时,96孔板上HUVECs接种密度为(0.1~2)×104/孔不等[13-14],各文献报道细胞接种密度差异巨大,但是细胞接种密度对细胞存活率的影响未见报道。本实验显示HUVECs不同接种密度对细胞存活率的影响也很大,在0.5×104/孔时细胞增殖速度缓慢,lpc干预后细胞存活数量稀少。接种数量为(0.75~1.5)×104/孔时细胞增长速度有明显增加,而且lpc干预后细胞存活率从(35.41±4.00)%逐渐增加到(76.80±5.83)%,而且各组间有统计学差异。但是2×104/孔组lpc干预后细胞存活率增高速度放缓,与1.5×104/孔组细胞存活率差异无统计学意义,而且此时对照组细胞出现增长过度密集,可能引发细胞生长抑制。这说明内皮细胞脂质化损伤的细胞模型成败不仅与合适的lpc干预浓度有关,也与适宜的HUVECs接种密度有关。细胞接种密度过于低时,细胞增长缓慢而且lpc干预后细胞稀少可能无法获得有效的细胞数量进行有效的实验研究。增加细胞接种密度可以增加细胞增长速度并且提高lpc干预后的细胞存活率。但是细胞接种密度增加到一定程度可能给对照组细胞带来过度增长,出现生长抑制现象从而影响实验结果的准确性,这一点需要避免出现。
本实验还发现lpc干预后细胞存活率与培养孔内的lpc干预体积有关,也就是与lpc干预时的培养液的终体积有关,实验结果显示在同样的细胞接种密度和同样的lpc终浓度条件下,lpc干预的实验组细胞存活率与lpc干预体积呈负相关。实验结果表明,在lpc干预HUVECs的脂质化损伤的细胞模型中,在不增加细胞接种密度的条件下,通过调节lpc干预体积,细胞存活率的变化范围很大,可以从(17.19±1.82)%调节到(77.78±4.10)%,从而满足不同的实验目的和不同的实验需求,同时也避免了单纯依靠增加细胞接种密度提高细胞存活率时导致的对照组细胞出现过度生长抑制的现象,因此lpc干预体积也可以作为调节细胞存活率的又一个有效参数。因此通过综合调节lpc浓度、细胞接种密度以及lpc干预体积可以更加有助于制作一个满足不同实验需求的脂质化损伤的泡沫化细胞模型。
本实验还发现再次脂质化损伤的内皮细胞存活率较初次脂质化损伤的细胞存活率明显升高,而且差异有统计学意义,出现这种现象是否是因为在脂质化损伤的过程中内皮细胞对脂质损伤出现了预适应还是其他的分子机制,在今后的实验研究中将会进一步探索。
[]
[1] 葛均波,徐永健.内科学[M].8版.北京:人民卫生出版社,2013:220-227.
[2] 王晓楠,周叶,于晓红,等. 瑞舒伐他汀对ox-LDL诱导的内皮细胞损伤中Sphk1/S1P/NF-κB信号通路的影响[J].中国老年学杂,2017,37(8):1897-1899.
[3] Zhai H,Chen QJ, Gao XM,et al. Inhibition of the NF-κB pathway by R65 ribozyme gene via adeno-associated virus serotype 9 ameliorated oxidized LDL induced human umbilical vein endothelial cell injury[J].Int J Clin Exp Pathol,2015,8(9):9912-9921.
[4] Li JL, Chen SY, Cai XN, et al. TLR2 expression doesn’t change in ox-LDL mediated inflammation in Human umbilical vein endothelial cells under high glucose culture[J].Int J Clin Exp Med, 2015,8(11):22004-22010.
[5] 任开新,樊子旭,游如春,等. DAPT 在 ox-LDL 损伤 HUVECs过程中的细胞保护作用[J].中国病理生理杂志,2017,33(6):1125-1129.
[6] Zhang YL, Cao XQ, Zhu WW,et al. Resveratrol enhances autophagic flux and promotes Ox-LDL degradation in HUVECs via upregulation of SIRT1[J].Oxid Med Cell Longev, 2016,21(2):1-13.
[7] Jung HJ,Im SS,Song DK, et al.Effects of chlorogenic acid on intracellular calcium regulation in lysophosphatidylcholine-treated endothelial cells[J]. BMB Rep,2017,50(6):323-328.
[8] 刘勇,余艳荣,彭维杰,等.吴茱萸次碱改善溶血性磷脂酰胆碱诱导的内皮细胞缝隙连接细胞间通讯功能障碍[J].中国药理学通报,2013,29(11):1514-1519.
[9] 张赛丹,彭振宇,刘韶,等.甲基莲心碱对LPC诱导内皮细胞损伤的保护作用及与ADMA的关系[J]. 中国中药杂志,2008,33(21):2526-2529.
[10] 陈光强,朱琳,胡量,等. CRP对血管内皮细胞泡沫化及IL-6、MCO-1表达的影响[J]. 医学研究杂志,2009,38(7):46-49.
[11] Cherepanova OA,Gomez D,Shankman LS,et al. Activation of the pluripotency factor OCT4 in smooth muscle cells is atheroprotective[J]. Nature Med,2016, 22(6):657-668.
[12] 赵晶,徐守竹,宋凡,等.二苯乙烯苷调节ROS相关JNK通路对LPC诱导HUVECs损伤的作用[J]. 中成药,2015,37(3):487-492.
[13] 廖昆,尹卫东.阿托伐他汀对溶血磷脂酰胆碱所致血管内皮功能损伤的保护作用[J].吉林医学,2011,32(19):3944-3945.
[14] 韩海玲,孙玉芹,宋文刚,等.红花黄色素对内皮细胞增殖及凋亡的保护作用[J].中国实验诊断学,2011,15(1):51-54.

