胰岛素样生长因子结合蛋白相关蛋白1表达对鼻咽癌细胞系CNE1发生发展的研究
郑富春,祁晓倩
(陕西省安康市人民医院:1.耳鼻咽喉科;2.检验科 725000)
鼻咽癌是耳鼻咽喉科较为常见的癌症之一,发病因素可能与当地湿热的环境气候及饮食偏辛辣有关[1]。鼻咽癌病死率较高,目前临床多采用放射治疗,原发性鼻咽癌在提高患者生存率等方面取得了显著成效,但手术时间较长,预后不佳且易造成患者面容改变[2]。通过抑制胰岛素样生长因子结合蛋白相关蛋白1(IGFBP-rP1)的表达对鼻咽癌细胞系CNE1细胞的增殖、侵袭、迁移能力的影响,检测CNE1细胞半衰期变化情况和相关蛋白变异后性质的表达[3]。现探讨在此蛋白基础上构建2条特异性针对IGFBP-rP1基因的小干扰RNA(siRNA32、siRNA34),并采用各种临床检测技术对IGFBP-rP1基因和CNE1细胞的相关指标进行检测,分析抑制IGFBP-rP1基因的表达能有效治疗鼻咽癌且术后患者不易发生并发症。报道如下。
1 材料与方法
1.1一般材料 本研究所用CNE1细胞购买自中南大学高等研究中心细胞实验室,转染质粒购买自上海吉玛公司。
1.2仪器与试剂 (1)材料:鼻咽癌细胞系CNE1细胞,空白载体,2条特异性针对IGFBP-rP1基因的小干扰RNA(siRNA32、siRNA34),转录酶和逆转录酶。(2)试剂:Trizol试剂,秋水仙素,龙胆紫溶液,无酶RNA冲洗液,SYBR Green 1染料,上游引物,下游引物,dNTP。(3)RT-PCR、Western blot检测试剂:30 g丙烯酰胺和0.8 g N,N′-亚甲丙烯酰胺、4×Tris·Cl/SDS,pH 8.8、4×SDS电泳缓冲液,TEMED (N,N,N′,N′-四甲基乙二胺),10%过硫酸铵。(4)四甲基偶氮唑蓝(MTT)检测试剂:MTT 0.5 g,100 mL磷酸盐缓冲液(PBS)或无酚红培养基。(5)肿瘤细胞重组基底膜侵袭实验试剂:无血清DMEM,1%胎牛血清DMEM,1640完全培养基(也可加到20%血清),无菌PBS,胰酶,4%多聚甲醛固定液或甲醇,结晶紫染液[0.1%(g/mL)PBS结晶紫]。(6)细胞运动实验:等渗盐水,细胞运动导板。(7)流式细胞仪技术实验试剂:秋水仙素。
1.3siRNA设计与构建 将IGFBP-rP1基因的DNA双螺旋结构通过解螺旋酶进行催化裂解打开成单链后,对其中之一的单链进行逆转录获得RNA,将此RNA进行PCR扩增后得到多条单链RNA,向这些多条RNA中加入rRNA进行蛋白质翻译后,再利用mRNA进行核糖体加成,然后形成siRNA[4]。
1.4细胞培养及转染 将CNE1细胞置入琼脂培养基中放入细胞保温箱进行传代培养,将培养后的细胞随机分为4组即阴性对照组、空白组、siRNA32组(siRNA32转染)、siRNA32组(siRNA34转染)。其中空白组不做任何处理;阴性对照siRNA转染;siRNA32组与siRNA32组分别转染siRNA32转染和siRNA34转染。分别采用RT-PCR、Western blot检测各组IGFBP-rP1 mRNA及蛋白的表达水平,使用细胞运动实验检测CNE1细胞的迁移能力,应用肿瘤细胞重组基底膜侵袭实验检测CNE1细胞的侵袭能力、MTT法检测CNE1细胞的增殖能力、流式细胞仪技术检测细胞周期。8~10周期后分别对4组实验结果进行统计,分析数据结果。
1.5检测方法
1.5.1RT-PCR检测方法 4组细胞分别进行RT-PCR法检测,取冻存CNE1细胞,5 000 r/min离心40 min后放入无酶RNA,应用无酶RNA对各组细胞进行加速繁殖后,只去除较多的传代培养的各组细胞进行观察。
1.5.2蛋白免疫印迹法(Western blot)检测方法 4组细胞分别进行Western blot法检测,将培养的CNE1细胞放在2块干净的玻璃平板之间离心后备用,配制好的甲基丙烯酸酯分离胶液体并脱气,然后放入13%的过硫酸铵和TEMED,轻轻搅拌,混匀。按所需分离的蛋白质分子大小选择合适的甲基丙烯百分比浓度,以上2种材料进行充分混合后将分离的CNE1细胞与混合液一起37 ℃温水中孵育40 min,充分清洗,再将硝酸纤维素膜与CNE1细胞混合显色。
1.5.3细胞运动实验 4组细胞分别进行细胞运动实验,取冻存CNE1细胞,12 000 r/min离心30 min后应用等渗盐水制作等渗液细胞运动导板,CNE1细胞悬液滴在导板的同一高度,观察各组细胞的运动情况[5]。
1.5.4肿瘤细胞重组基底膜侵袭实验 4组细胞分别进行肿瘤细胞重组基底膜侵袭实验,取冻存CNE1细胞10 000 r/min离心40 min,应用基质胶铺板制备CNE1细胞悬液,检测各组细胞侵袭情况[6]。
1.5.5MTT法 4组细胞分别进行MTT法检测,取冻存CNE1细胞15 000 r/min离心40 min,每0.2 mL Trizol试剂裂解样本中加入0.15 mL氯仿进行裂解操作,26 ℃水浴加热采用无酶RNA冲洗液进行洗涤,再次15 000 r/min离心10 min,获得RNA,将此RNA进行逆转录后培养,检测各组细胞增殖情况[7]。
1.5.6流式细胞仪技术 4组细胞分别进行流式细胞仪技术实验,取冻存CNE1细胞5 000 r/min离心45 min,向各组细胞中加入秋水仙素溶液,使细胞增殖的速度减缓从而使细胞固定在特定的细胞周期上,检测各组细胞的细胞周期。
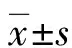
2 结 果
2.1各组细胞IGFBP-rP1 mRNA及蛋白表达水平结果比较 阴性对照组和空白组IGFBP-rP1 mRNA及蛋白表达水平比较,差异无统计学意义(P>0.05);siRNA32组和siRNA34组IGFBP-rP1 mRNA及蛋白表达水平显著低于阴性对照组和空白组,差异有统计学意义(P<0.05)。见表1和图1。

表1 各组IGFBP-rP1 mRNA及蛋白表达水平结果比较
注:与空白组比较,aP<0.05;与阴性对照组比较,bP<0.05

注:1表示空白组;2表示阴性对照组;3表示siRNA34组;4表示siRNA32组
图1 Western blot法检测各组IGFBP-rP1蛋白表达水平
2.2各组细胞CNE1细胞迁移能力结果比较 阴性对照组和空白组CNE1细胞迁移数目比较,差异无统计学意义(P>0.05);siRNA32组和siRNA34组CNE1细胞迁移数目显著低于阴性对照组和空白组,差异有统计学意义(P<0.05)。见表2。

表2 各组细胞CNE1细胞迁移能力结果比较
注:与空白组比较,aP<0.05;与阴性对照组比较,bP<0.05
2.3各组细胞CNE1细胞侵袭能力结果比较 阴性对照组和空白组穿过PVP-F膜的CNE1细胞数目比较,差异无统计学意义(P>0.05);siRNA32组和siRNA34组穿过PVP-F膜的CNE1细胞数目显著低于阴性对照组和空白组,差异有统计学意义(P<0.05)。见表3。

表3 各组细胞CNE1细胞侵袭能力结果比较
注:与空白组比较,aP<0.05;与阴性对照组比较,bP<0.05
2.4各组细胞CNE1细胞增殖能力结果比较 培养24、48 h后,阴性对照组和空白组CNE1细胞增殖OD值比较,差异无统计学意义(P>0.05);siRNA32组和siRNA34组CNE1细胞增殖OD值显著低于阴性对照组和空白组(P<0.05)。见表4。

表4 各组细胞CNE1细胞增殖能力OD值结果比较
注:与空白组比较,aP<0.05;与阴性对照组比较,bP<0.05
2.5各组细胞CNE1细胞增殖周期结果比较 培养48 h后,siRNA32组和siRNA34组G0/G1期、G2/M期细胞所占比例显著高于阴性对照组和空白组(P<0.05);siRNA32组和siRNA34组S期细胞所占比例显著低于阴性对照组和空白组(P<0.05)。见表5。

表5 各组细胞CNE1细胞增殖周期结果比较
注:与空白组比较,aP<0.05;与阴性对照组比较,bP<0.05
3 讨 论
鼻咽癌病理病因目前认为与3种因素有关,即遗传因素、病毒因素(主要为EB病毒感染)、环境因素,临床对鼻咽癌的治疗方法很多,但治疗效果都不确切,现抑制鼻咽癌相关基因的表达对鼻咽癌进行靶向治疗[8]。
IGFBP-rP1是一种近年来被发现的胰岛素样生长因子泛素偶联蛋白,该蛋白翻译携带的鼻咽癌基因的独特高表达性与鼻咽癌的发生、发展密切关相[9]。IGFBP-rP1通过CNE1细胞上皮间充质胚胎转化后在鼻咽癌疾病进程中起癌基因作用,IGFBP-rP1能通过促鼻咽癌原癌基因表达而促进鼻咽癌细胞的增殖、转移、侵袭[10-11]。本研究结果证实,IGFBP-rP1对鼻咽癌细胞的干细胞特性具有调控作用,且证明IGFBP-rP1能经特异性siRNA载体而调控鼻咽癌相关基因的表达,实现其增强鼻咽癌干细胞特性的作用。本研究结果显示,可以通过抑制IGFBP-rP1表达而抑制鼻咽癌CNE1细胞的增殖、侵袭、转移。IGFBP-rP1培养数天后细胞迁移能力较强,说明IGFBP-rP1表达后有较多CNE1细胞进行迁移,提示鼻咽癌在该基因的调控下可发生较快迁移至其他组织器官,甚至会累及到较多的淋巴细胞。
CNE1细胞RNA中的琥珀酸还原酶,能使外源性MTT氧化还原为不溶性的甲瓒并沉积细胞,但死细胞无此功能[12]。当细胞增殖时并不影响甲瓒在CNE1细胞中的数量,会随着细胞增殖而分裂增多,伴随细胞质中不断裂解为更小的粒子,当CNE1细胞增殖趋向最大化完成时,二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在700 nm波长处测定其光吸收值,可间接反映活CNE1细胞增殖的数量[13-15]。本研究结果显示,IGFBP-rP1相对表达量均值较低,说明表达基因产物与鼻咽癌的特异性较高。而IGFBP-rP1增殖较多CNE1细胞,说明该蛋白表达后鼻咽癌相关细胞会出现高增殖效率。不同细胞周期进行抑制IGFBP-rP1时所产增殖的细胞数量、迁移、侵袭性不同,表明在特定时期对该蛋白进行抑制能有效治疗鼻咽癌。
本研究创新性在于通过抑制IGFBP-rP1基因表达对鼻咽癌系细胞进行靶向定位治疗,可避免临床其他手术治疗的不确定性。该手术利用基因抑制法可增强患者预后,鼻咽癌系细胞增殖率、转移率、侵袭周围其他组织的概率极大地降低,值得临床其他难治性手术的借鉴。
综上所述,探讨抑制IGFBP-rP1可有效抑制鼻咽癌细胞系CNE1细胞的增殖、侵袭、迁移能力,安全可靠,值得临床推广使用。
参考文献
[1]黄国森,胡学锋.鼻咽癌颅底骨质破坏放疗后的修复[J].中国现代医学杂志,2015,25(4):102-106.
[2]陈宇翰,李先明.以乏氧诱导因子-1α及其信号通路为鼻咽癌治疗靶点的相关研究进展[J].广东医学,2015,36(15):2436-2438.
[3]刘炎霖,陈钰辉,刘富中,等.水茄泛素结合酶E2基因StUBCc的克隆及黄萎病菌诱导表达分析[J].园艺学报,2015,42(6):1185-1194.
[4]陈学昭,张雷,于珊珊,等.松江鲈(Trachidermus fasciatus)泛素结合酶E2-D2基因的分子克隆及组织表达分析[J].海洋学报(中文版),2015,37(10):133-140.
[5]杨丽桦,何融泉,张昌文,等.表皮生长因子受体靶向治疗鼻咽癌的研究进展[J].广东医学,2015,36(18):2929-2931.
[6]CHAUGULE V K,WALDEN H.Specificity and disease in the ubiquitin system[J].Biochem Soc Trans,2016,44(1):212-227.
[7]MILES J A,FROST M G,CARROLL E,et al.The fanconi anemia DNA repair pathway is regulated by an interaction between ubiquitin and the E2-like fold domain of FANCL[J].J Biol Chem,2015,290(34):20995-21006.
[8]HIRA A,YOSHIDA K,SATO K,et al.Mutations in the gene encoding the E2 conjugating enzyme UBE2T cause Fanconi anemia[J].Am J Hum Genet,2015,96(6):1001-1007.
[9]贾招闪,申红妙,李正楠,等.基于MTT染色法对葡萄生单轴霉孢子囊存活力的检测[J].菌物学报,2016,35(8):939-945.
[10]周权明,杨小朋,钱章林,等.机械吹打法、胰酶消化法分离新生大鼠脑组织神经干细胞效果观察[J].山东医药,2016,56(20):18-20.
[11]李红梅,李静,靳伟,等.新木脂素的酶法糖基化及抗肿瘤活性[J].南方医科大学学报,2015,35(11):1570-1574.
[12]林少雄,张永,鲁娟,等.干扰内皮素-1可抑制鼻咽癌细胞增殖、迁移和侵袭[J].南方医科大学学报,2016,36(7):915-920.
[13]孙仕晨,董腾哲,黄昕,等.Transwell共培养条件下诱导脂肪干细胞成骨能力的改变[J].中国组织工程研究,2016,20(28):4155-4161.
[14]纪晓方,李丽英,常娜.高内涵分析及Western blotting法在蛋白质核质分布研究中的应用及比较研究[J].首都医科大学学报,2016,37(5):616-620.
[15]唐广义,韩涛,殷东风,等.益气健脾抗癌法对结肠癌组织PKC及亚型PKCδ、PKCε蛋白表达的影响[J].中国肿瘤生物治疗杂志,2016,23(3):366-370.

