糖类相关抗原125和间皮素联合检测在上皮型卵巢癌临床诊断与病理分型*
方友琴,方友华,林开健
(1.重庆市万州区人民医院妇产科 404100;2.重庆市第五人民医院呼吸科 400062)
卵巢癌是女性生殖系统常见的肿瘤之一,其发病率仅次于宫颈癌和子宫体癌,位居第3位。大多数卵巢癌患者早期症状不明显,确诊时已属晚期,治疗效果和预后均较差[1]。糖类相关抗原125(CA125)是一种来源于体腔和苗勒管、位于染色体19p13.2区域且含有5 797个碱基对的跨膜糖蛋白,在卵巢癌、胰腺癌、宫颈癌等多种肿瘤血清中均显著增加,对肿瘤的早期判断具有良好的指示作用[2-3]。间皮素(MSLN)是分离MabK单克隆抗体时发现的一种细胞表面糖蛋白,主要表达于间皮组织,在卵巢癌、间皮瘤等肿瘤高表达,然而目前其生物学功能并不清楚[4]。现探讨血清CA125与MSLN联合检测对上皮型卵巢癌的临床诊断价值。报道如下。
1 资料与方法
1.1一般资料 选取2016年7月至2017年7月万州区人民医院妇产科诊治的56例上皮型卵巢癌患者(卵巢癌组),年龄27~63岁,平均年龄(49.54±8.21)岁。依据国际妇产科联盟(FIGO)分期标准[5]:Ⅲ期42例,Ⅳ期14例;病理分型:黏液型26例,浆液型23例,透明细胞肿瘤3例,子宫内膜样肿瘤2例,移行细胞肿瘤2例。纳入标准:(1)均经组织病理学检测确诊的卵巢癌。(2)医学影像学CT或MRI检查未发现淋巴结转移等。(3)肝、肾、心、肺及骨髓功能检查未发现显著异常。(4)Karnofsky功能状态评分均大于或等于80分。选取同期住院治疗的56例良性卵巢肿瘤患者作为对照组,年龄26~62岁,平均年龄(48.16±7.47)岁。2组患者的年龄、民族、经济状况、基础疾病等一般资料比较,差异无统计学意义(P>0.05),具有可比性。研究方案经该院伦理委员会批准,所有患者及家属均签署知情同意书。
1.2CA125和MSLN检测 2组患者采集清晨空腹静脉血5 mL,4 ℃ 3 000 r/min离心20 min,留取上清液,―80 ℃冰箱保存。采用酶联免疫吸附试验(ELISA)分别检测CA125和MSLN,ELISA试剂盒购于上海通蔚科技有限公司,仪器为美国Bio-Rad Model 580酶标仪,整体操作流程均严格参照试剂盒说明书由专业检验技术员进行,质量控制在控。
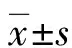
2 结 果
2.1ROC曲线分析CA125与MSLN单独检测对卵巢癌的诊断价值 CA125曲线下面积(AUC)为0.784,最佳诊断临界值为35.8 U/mL。血清CA125≥35.8 U/mL预测卵巢癌阳性的特异度为89.74%,灵敏度为78.30%。MSLN 的AUC为0.772,最佳诊断临界值为5.36 ng/mL。血清MSLN≥5.36 ng/mL预测卵巢癌阳性的特异度为82.16%,灵敏度为79.93%。
2.22组患者CA125与MSLN水平结果比较 对照组患者CA125与MSLN水平明显低于卵巢癌组,差异有统计学意义(P<0.05);卵巢癌组患者2项指标均高于最佳诊断临界值。见表1。

表1 2组患者血清CA125与MSLN水平结果比较
2.3ROC曲线分析CA125和MSLN联合检测对卵巢癌的诊断价值 CA125和MSLN联合检测卵巢癌的特异度为91.76%,与2项指标单独检测结果比较,差异无统计学意义(P>0.05);但联合检测的灵敏度为90.34%,均明显高于2项指标单独检测,差异有统计学意义(P<0.05)。见表2。

表2 CA125和MSLN联合检测对卵巢癌的诊断价值(%)
2.4不同病理分型的卵巢癌患者CA125与MSLN水平结果比较 黏液型、透明细胞肿瘤、子宫内膜样肿瘤、移行细胞肿瘤卵巢癌患者CA125和MSLN水平均显著低于浆液型,差异有统计学意义(P<0.05)。见表3。

表3 不同病理分型的卵巢癌患者CA125与MSLN水平结果比较
注:与浆液型比较,*P<0.05
3 讨 论
卵巢癌是最常见的恶性肿瘤之一,其病死率高居各类妇科恶性肿瘤的首位,严重危害女性健康[6]。约70%的卵巢癌患者确诊时已是晚期,同时合并子宫、附件、大网膜及盆腔其他脏器的广泛转移,5年生存率仅为20%。因此,早期诊断并提高临床治疗效果,是临床难题,也是诸多研究的重点[7-8]。血清肿瘤标志物是一类操作简单、经济实用且检测创伤小的生物标志物,近年来普遍关注血清肿瘤标志物在卵巢癌早期识别、诊断、疗效、预后判定的应用前景,并取得一定的成就[9]。CA125是从上皮型卵巢癌抗原检测中发现的一类糖蛋白,主要来源于心包、胸膜、腹膜等,正常卵巢组织不存在,卵巢癌患者血清中可被检出,具有较高的灵敏度。既往研究报道,CA125可在多种恶性肿瘤(如胃癌、肺癌、肝癌、前列腺癌)组织中过度表达,是一种能辅助诊断肿瘤,并予以鉴别诊断及预测预后的血清肿瘤标志物[10]。但也有研究表明,虽然CA125在卵巢癌患者血清水平显著升高,但其特异度不高,单独检测无法早期诊断上皮型卵巢癌[11]。因此,血清生物标志物的联合检测可为此应用。MSLN是一类新型的血清肿瘤标志物,相对分子质量约为(42~45 )×103,远小于CA125蛋白,并可释放入血,比CA125的灵敏度更高。有研究证实,MSLN水平在卵巢癌显著升高,与其他肿瘤标志物联合检测,可提高肿瘤的早期检出率[12-13]。本研究结果显示,卵巢癌组患者CA125、MSLN水平均明显高于对照组(P<0.05),说明2项指标可能均与卵巢癌的发生、发展密切相关。CA125与MSLN联合检测虽不能提高卵巢癌检出的特异度,却显著提高了灵敏度,提示两者联合测定诊断卵巢癌具有相互补充,相辅相成的作用,能显著降低卵巢癌的假阴性检出率,提高诊断的准确性。
有研究报道,尽管CA125水平与卵巢癌的病理类型有一定的相关性,但MSLN是否与卵巢癌的病理分型有关,目前尚未明确[14]。本研究结果表明,黏液型、透明细胞肿瘤、子宫内膜样肿瘤、移行细胞肿瘤卵巢癌患者CA125和MSLN水平均显著低于浆液型,提示通过对卵巢恶性肿瘤患者血清CA125和MSLN的检测,可为卵巢癌肿瘤病理分型提供一定的参考,其原因可能是由于MSLN主要以糖基磷脂肌醇锚定的方式定位于细胞膜,被蛋白水解酶水解后,不但具有巨核细胞刺激活性,还可产生细胞黏附性,水解后MSLN蛋白片段又可在血清中被检测。因此,MSLN不仅在多种肿瘤细胞中升高,并在一定程度上反映了卵巢肿瘤的恶性程度,是一类经济、实用的血清肿瘤标志物[15]。本研究结果证实,单独检测CA125或MSLN作为上皮型卵巢癌早期诊断的血清标志物均具有局限性,但联合检测可显著提高其灵敏度,对病理分型也有一定的临床指导意义,是一种良好的卵巢癌诊断方法。
综上所述,联合检测血清CA125与MSLN可显著增加卵巢癌临床诊断的灵敏度,且对肿瘤病理分型具有一定的辅助作用。但由于本研究纳入的研究标本量偏少,研究时间较短,也未与健康者进行比较,因此仍有一定的局限性,需后续临床试验或基础研究加以论证。
参考文献
[1]TENG Z M,HAN R Q,HUANG X Y,et al.Increase of incidence and mortality of ovarian cancer during 2003―2012 in Jiangsu province,China[J].Front Pub Heal,2016,4(1):146-147.
[2]HU L L,DU S Z,GUO W H,et al.Comparison of serum human epididymis protein 4 and carbohydrate antigen 125 as markers in endometrial cancer a Meta-Analysis[J].Int J Gynecol Cancer,2016,26(2):331-340.
[3]WEI S U,LI H,ZHANG B.The diagnostic value of serum HE4 and CA-125 and ROMA index in ovarian cancer[J].Biomedical Reports,2016,5(1):41-44.
[4]LAMBERTS L E,VAN OORDT C W,TER WEELE E J,et al.ImmunoPET with anti-mesothelin antibody in patients with pancreatic and ovarian cancer before anti-mesothelin antibody-drug conjugate treatment[J].Clin Cancer Res,2016,22(7):1642-1652.
[5]KANDUKURI S R,RAO J Y.FIGO 2013 staging system for ovarian cancer:what is new in comparison to the 1988 staging system?[J].Curr Opin Obstet Gynecol,2015,27(1):48-52.
[6]GRIFFITHS C T,GROGAN R H,HALL T C.Advanced ovarian cancer:primary treatment with surgery,radiotherapy,and chemotherapy[J].Cancer,1972,29(1):1-7.
[7]MINGELS M J,HAM M,KIEVIT I,et al.Ovarian cancer:treatment[J].Modern Pathology,2014,27(7):1002-1013.
[8]SILVESTRINI R,DAIDONE M G,VENERONI S,et al.The clinical predictivity of biomarkers of stage Ⅲ-Ⅳ epithelial ovarian cancer in a prospective randomized treatment protocol[J].Cancer,1998,82(1):159-167.
[9]MAHDI H,XIU J,REDDY S K,et al.Biomarker comparison of epithelial ovarian cancer and endometrial cancer by multiplatform tumor profiling[J].Gynecol Oncol,2015,137(1):208-208.
[10]WANG J W,GAO J,YAO H W,et al.Diagnostic accuracy of serum HE4,CA125 and ROMA in patients with ovarian cancer:a meta-analysis[J].Tumour Biol,2014,35(6):6127-6138.
[11]COHEN J G,WHITE M,CRUZ A,et al.In 2014,can we do better than CA125 in the early detection of ovarian cancer?[J].World J Biol Chem,2014,5(3):286-300.
[12]SCALES S J,GUPTA N,PACHECO G,et al.An antimesothelin-monomethyl auristatin e conjugate with potent antitumor activity in ovarian,pancreatic,and mesothelioma models[J].Mol Cancer Ther,2014,13(11):2630-2640.
[13]WU X H,LI D X,LIU L P,et al.Serum soluble mesothelin-related peptide (SMRP):a potential diagnostic and monitoring marker for epithelial ovarian cancer[J].Arch Gynecol Obstet,2014,289(6):1309-1314.
[14]WANG D H,WU X H,QIAN S M,et al.Study on the mesothelin-specific cytotoxicity against epithelial ovarian cancer with full-length mesothelin cDNA-transduced dendritic cells[J].Med Oncol,2015,32(4):116.
[15]HANAOKA T,HASEGAWA K,KATO T,et al.Correlation between tumor mesothelin expression and serum mesothelin in patients with epithelial ovarian carcinoma:a potential noninvasive biomarker for mesothelin-targeted therapy[J].Mol Diagn Ther,2017,21(2):187-198.

