桑枝提取物中3种代表性黄酮的含量测定及抗氧化活性评价*
刘胜胜 喻 艳 成希飞 周 游 徐 立
(西南大学生物技术学院,重庆 400715)
国内外学者普遍认为,很多疾病及人体的衰老等都和体内的氧化和自由基的存在有密切关系,具有抗氧化和清除自由基的活性物质市场需求极大。目前人工合成的抗氧化剂如叔丁基对甲酚(BHT)、叔丁基羟基回香醚(BHA)、叔丁基氢醌(TBHQ)、没食子酸丙酯(PG)存在毒副和致癌等安全问题[1],因此,随着人们保健意识的加强,亟待从自然界中开发更多天然无毒的抗氧化剂。黄酮类化合物是天然化合物中具有很好抗氧化和清除自由基活性的典型化合物类型[2]。
桑枝为桑科植物桑MorusalbaL.的干燥嫩枝,是常用中药材之一,卫生部也将其提取物归为可以加入到食品和保健品中的植物材料,具有较好的食用安全性。同时,桑枝中黄酮类成分含量较高,有的品种高达3. 89~3.97 mg/g[3],其中具有代表性的黄酮类化合物为芦丁、桑色素和槲皮素[4]。此前,对于这3种代表性黄酮的含量和抗氧化、清除自由基的活性虽有研究,但比较分散,不够系统[5]。本实验采用高效液相色谱法,对杆壮叶肥的超高产人工三倍体桑树品种—嘉陵20号桑枝中3个主要黄酮类成分芦丁、槲皮素、桑色素的含量进行测定,与其抗氧化、清除自由基活性相结合,系统地评价桑枝提取物被开发为天然抗氧化剂的潜力,不仅为开发天然抗氧化剂奠定理论基础,也为桑产业废弃物的高值化利用提供参考。
1 材料与方法
1.1 材料与试剂
嘉陵20号桑树新鲜桑枝,采自西南大学“桑之源”桑园。
芦丁、槲皮素、桑色素、维生素E对照品(纯度≥98%,成都曼思特生物科技有限公司),乙醇、甲醇、双氧水(H2O2)(AR级,重庆川东化工有限公司),三氯乙酸、氯化铁、高硫酸钾、铁氰化钾、磷酸二氢钾、氢氧化钾(AR级,成都科龙化工试剂厂),1,1-二苯基-2-三硝基苯肼(DPPH)、2, -联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(AR级,南京都莱生物技术有限公司)。
1.2 仪器与设备
高效液相色谱(high performance liquid chromatography,HPLC)仪(美国Waters公司)、InertSustainC18柱(4.6×250 mm,5 μm,日本)、R-210型旋转蒸发仪(瑞士Buchi公司);纯水仪(法国Millipore公司)、B-491恒温水浴锅(国华电器有限公司)、粉碎机(温岭市林大机械有限公司)、QL-901涡旋仪(海门市其林贝尔仪器制造有限公司)、BIORAD酶标仪(美国Biorad公司)、紫外分光光度计(德国Thermo公司)、ZF-90型暗箱式紫外透射仪(上海顾村电光仪器厂)。
1.3 样品制备
采集100g新鲜枝条,粉碎,50℃恒温干燥,过200目筛,收集过筛后的细粉末。准确称取15g桑枝粉末,加入锥形瓶中。以液料比33∶1向锥形瓶中加入石油醚,并混合均匀,室温下浸泡1h,过滤,收集滤液,按照上述步骤重复提取,总共提取3次。待滤渣中石油醚挥发干后,在80 ℃下,用70%乙醇,以液料比33∶1浸提120min,过滤,再将滤渣放入锥形瓶中,重复3次。滤液在40℃、0.1MPa条件下减压浓缩至浸膏(样品)。将样品置于4℃条件下,黑暗保存,备用。
1.4 总黄酮含量测定
将浸膏状态的样品用70%乙醇溶解,浓度调至8mg/mL。准确吸取1mL样品,加入5%亚硝酸钠溶液0.4mL,震荡摇匀,静置5min,再加入0.4mL10%的硝酸铝溶液,震荡摇匀,静置5min,加入4mL5%的氢氧化钠溶液,震荡摇匀,定容至10mL,静置10min,在510nm处以70%乙醇为空白对照测定样品的吸光值。每个试验重复三次。由标准曲线计算黄酮总量。标准曲线:使用70%乙醇配制浓度分别为0、0.1、0.2、0.4、0.5mg/mL的芦丁溶液,按照上述方法反应及测定其吸光值,以浓度为横坐标,吸光值为纵坐标,做出芦丁标准品的标准曲线(0.01~0.05mg/mL)。所测样品的总黄酮浓度以其吸光值所对应的芦丁的浓度表示,记为每mL溶液含x mg芦丁,即x mg RE/mL SV。总黄酮得率(%)=[c×5×100/(m×1000)]×100%,c为黄酮浓度(mg/mL),m为桑枝质量(g)。
1.5 HPLC测定3种代表性黄酮含量
色谱条件:色谱柱为InertSustainC18(4.6×250 mm,5 μm);流动相为甲醇(A)和0.3%磷酸(B)溶液,梯度洗脱参考喻樊等的研究方法[6][0~6 min A-B(45∶55);6~13 min,A-B(40∶60);13~40 min,A-B(55∶45)];进样量10μL;检测波长为360nm;流速为1.0mL/min;柱温为30℃。
1.6 DPPH·清除力测定
参考Mohammad等[7]和Garry等[8]方法,分别取0.1mL不同浓度(0.02、0.04、0.06、0.08、0.10mg/mL)的维生素E、芦丁、槲皮素、桑色素和桑枝总黄酮提取物溶液,分别与0.1mL 800mmol/L的DPPH·乙醇溶液混合,震荡摇匀,室温下避光反应30min后,利用酶标仪在490nm处测定吸光值。各浓度设置三个重复,求平均值。空白组以等量的无水乙醇代替800mmol/L的DPPH·乙醇溶液,对照组以等量的70%乙醇代替样品,测定吸光值。清除率(%)=[1-(Ai-Aj)/Ao]×100%,其中Ai、Ao、Aj分别为样品组、对照组和空白组的吸光值。根据公式计算出各样品清除DPPH·的IC50。
1.7 ABTS+清除力测定
参考Roberta等[9]和Milleran等[10]方法,配制ABTS+工作液,分别取100μL不同浓度(0.02、0.04、0.06、0.08、0.10mg/mL)的维生素E、芦丁、槲皮素、桑色素和提取物溶液,分别与100 μL ABTS+工作液混合,震荡30s,静置反应10min,利用酶标仪在750nm的波长下测定吸光值。每个浓度设置三个重复,求平均值。空白组以等量无水乙醇代替ABTS+工作液,对照组以等量的70%乙醇代替样品溶液,测定吸光值, 清除率 (%)=[1-(Ao-B)/At]×100%,其中Ao,At,B分别为对照组、样品组、空白组的吸光值。根据公式计算出各样品清除ABTS+的IC50。
1.8 总还原力测定
参考Michal等方法[11],分别取不同浓度(0.02、0.04、0.06、0.08、0.10mg/mL)的各样品0.45mL,加入5mL的离心管,向各离心管中分别加入(0.2mol/L,pH 6.6)PBS缓冲液0.45mL,混合均匀,再加入0.45mL[K3Fe(CN)6](质量分数为1%),混合均匀,于50℃下水浴20 min后,冰浴,以快速冷却,再向混合液中加入质量分数为10%的三氯乙酸溶液0.45 mL,混合摇匀,以终止反应。最后再加1.8mL蒸馏水和0.1mL,0.1%三氯化铁反应10min后于700nm 测其吸光度,吸光值大小与还原力强弱呈正相关。空白组以等量的70%乙醇代替样品,每个样品设置三个重复。
1.9 DNA损伤保护潜力测定
在微型离心管中依次加入5 μL(60 ng/μL)pUC19质粒DNA ,2 μL H2O2和5 μL(2mg/mL)的样品溶液。对照组以等量无菌水代替样品溶液,空白组加入5μL(60ng/μL)pUC19质粒DNA和7μL ddH2O。参考文献方法[12],样品组和对照组于310nm紫外光线下进行5min表面辐射,空白组不进行紫外处理。随后载入质量分数为1%的琼脂糖凝胶电泳,根据电泳图分析。
2 结果与分析
2.1 种常见黄酮类化合物的含量
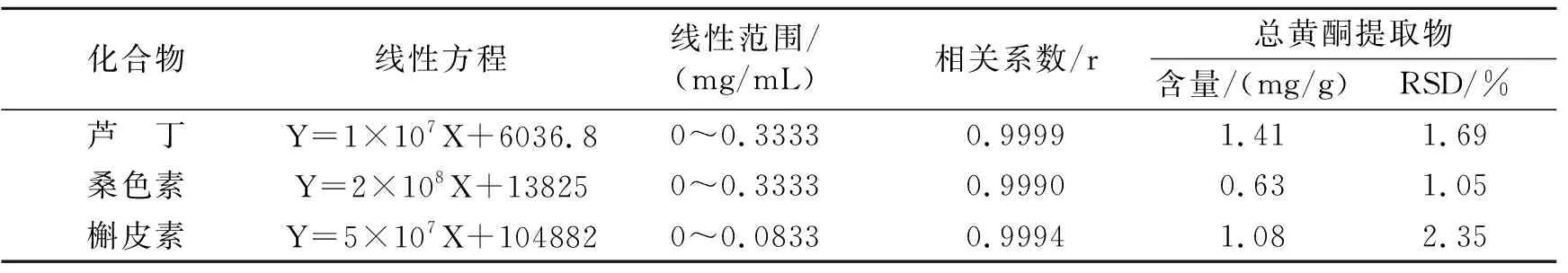
表1 3种代表性黄酮的线性方程及含量(n=3)
根据总黄酮得率公式和标准曲线回归方程Y = 12.041X-0.01(r=0.9997)计算出桑枝提取物中总黄酮得率为1.01±0.04%,比吴志平等[3]测定的22个桑品种的春季嫩桑枝黄酮质量分数0. 2%~0. 6%要高,由于品种、季节、成熟度对黄酮的含量均有影响,本实验材料同样采于春季(6月),因此推测可能是品种不同造成的差异,说明嘉陵20号桑树品种枝条中黄酮成分含量相对较高。
其中3种代表性黄酮类成分芦丁、桑色素、槲皮素的含量如表1所示,其保留时间分别为10.382、25.303、30.041 min(图1)。HPLC法的流动相中选择加入不挥发的磷酸来改善峰形,结果显示采用甲醇-0. 3%磷酸作为流动相进行梯度洗脱,3种代表性黄酮成分的分离效果较好。由结果可知,提取物中芦丁含量最高,为1.41 mg/g,槲皮素次之,为1.08mg/g,桑色素最低,为0.63mg/g。此外,RSD%分别为1.69、2.35、1.05,都在2%左右,说明仪器精密度良好,实验结果可信。
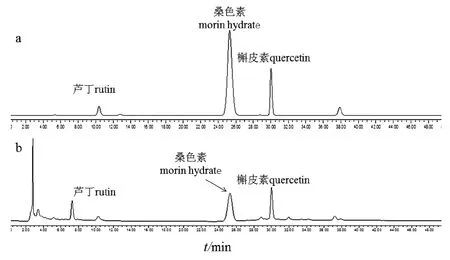
图1 对照品(a)及提取物(b)的HPLC色谱图
2.2 自由基清除能力
2.2.1 DPPH·清除效果
不同浓度样品的DPPH·清除力如图2所示,桑枝提取物、芦丁、槲皮素、桑色素对DPPH·均有较强的清除能力,具有明显剂量效应关系。在试验浓度范围(0.02~0.10 mg/mL)内,随着浓度的增加,自由基清除能力逐渐加强。浓度相同情况下,桑色素和槲皮素对DPPH·清除能力都比提取物要强,但远弱于阳性对照维生素E。在浓度为(0.02~0.05 mg/mL)时,槲皮素的清除率为最高,但随浓度增加略低于维生素E,当浓度大于0.06 mg/mL后二者清除率相当,均远高于桑色素、芦丁和提取物。
根据SPSS计算得出各样品的DPPH·清除力的半抑制浓度(图3),浓度越小,清除自由基的效果越好。比较各样品对DPPH·清除能力的IC50,阳性对照维生素E(IC50=0.042mg/mL)最低,槲皮素(IC50=0.042mg/mL)与其相当,明显低于其他3种,说明其清除效果最好;其次是桑色素(IC50=0.065mg/mL),提取物(IC50=0.072mg/mL),芦丁最高(IC50=0.082mg/mL)。因此,各样品对DPPH·清除能力从大到小为:维生素E=槲皮素>桑色素>桑枝提取物>芦丁。
2.2.2 ABTS+清除效果
各样品对ABTS+同样表现出较好的清除效果,根据图4,各样品溶液对ABTS+的清除能力也具有明显量效关系。在浓度为(0.02~0.08mg/mL)时,提取物的清除率远高于槲皮素、芦丁、桑色素,且高于阳性对照维生素E,当浓度高于0.08mg/mL后,清除率略低于维生素E,与槲皮素相当,但仍高于桑色素和芦丁,芦丁的清除率一直为最低。根据SPSS计算的各样品的ABTS+清除力的半抑制浓度,其中提取物的IC50最低,为0.019mg/mL,说明其对ABTS+清除效果最强。根据各样品的半抑制浓度值(图5),得出对ABTS+清除能力从大到小依次为:提取物(IC50=0.019mg/mL)>维生素E(IC50=0.031mg/mL)>槲皮素(IC50=0.037mg/mL)>桑色素(IC50=0.050mg/mL)>芦丁(IC50=0.074mg/mL)。结合桑枝提取物总黄酮含量及3种黄酮物质的含量(表3)分析表明,提取物中对ABTS+具有清除力的贡献者除了芦丁、桑色素和槲皮素外,还存在的其他黄酮类成分也具有相同的作用,并且活性很好,值得进一步深入研究。
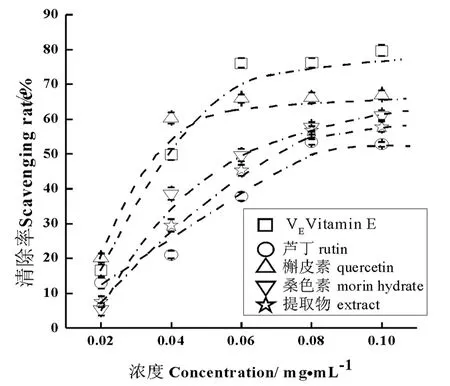
图2 不同浓度样品的DPPH·清除率
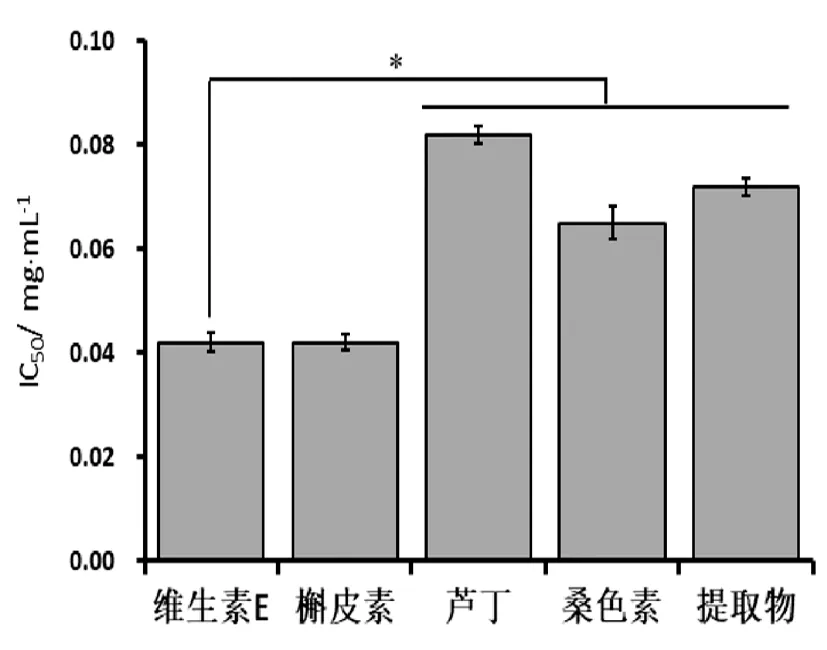
注:*表示差异显著(P﹤0.05)图3 各样品的DPPH·清除力的半抑制浓度/IC50

图4 不同浓度样品的ABTS+清除率

注:*表示差异显著(P﹤0.05)图5 各样品的ABTS+清除力的半抑制浓度/IC50
2.3 总还原能力
由图6可知,各个样品均表现出一定的还原能力,物质的还原能力也是衡量抗氧化能力的一个指标。在一定浓度范围(0.02~0.10mg/mL)内,随着样品浓度增加,吸光度增加,表明其还原能力增强,抗氧化能力提高。

注:吸光值大小间接反映样品总还原能力大小。图6 各样品的总还原能力
当浓度在0.02~0.08mg/mL内时,槲皮素的总还原力最为突出,明显高于其他三种样品和维生素E;结合其在桑枝提取物中的含量(表1)差异,说明提取物的总还原能力并非与黄酮类成分含量成正相关,且提取物浓度与3种黄酮物质浓度相同时,提取物中的3种黄酮类成分的含量极低,故相同浓度下提取物还原能力较槲皮素和桑色素低。
2.4 DNA保护潜力
正常情况下, DNA双螺旋结构盘旋缠绕形成超螺旋DNA。紫外线照射和H2O2会对DNA产生协同损伤,引起磷酸二酯键或共价键断裂,表现为超螺旋结构的DNA变为线状DNA和松弛状DNA。不同形态的DNA在进行电泳分析时的电泳淌度不同,超螺旋DNA的电泳淌度最大,其条带移动速度最快,松弛状DNA的电泳淌度最小。各样品对DNA的损伤保护作用的电泳条带如图7所示,通过Image lab 3.0软件进行条带分析,超螺旋DNA所占百分比越大,且与空白对照越接近,说明保护效果越好。

0~2:空白组(不经处理的DNA);3~5:对照组(紫外5 min+30% H2O2处理);6~8:阳性对照组(维生素E)(紫外5 min+维生素E(1 mg/mL)+30% H2O2处理);9~11:芦丁组(紫外5 min+芦丁(1 mg/mL)+30% H2O2处理);12~14:桑色素组(紫外5 min+桑色素(1 mg/mL)+30% H2O2处理);15~17:槲皮素组(紫外5 min+槲皮素(1 mg/mL)+30% H2O2处理);18~20:提取物组(紫外5 min+提取物(10 mg/mL)+30% H2O2处理);I:环状松弛结构(OcDNA);II:超螺旋结构(ScDNA)。
图7 各样品对DNA的损伤保护
结果显示,对DNA的保护潜力为:槲皮素>桑枝提取物>桑色素>维生素E>芦丁,其强弱关系与总还原能力相一致。浓度相同时,槲皮素最强,并且强于桑枝提取物。提取物浓度为10mg/mL,即芦丁、桑色素、槲皮素的含量分别为0.014 1、0.006 3、0.010 8mg/mL时,此时虽然浓度很小,但其保护作用明显比1 mg/mL的桑色素、维生素E和芦丁强,说明桑枝提取物中还存在大量其他具有保护DNA作用的黄酮类物质,有待进一步研究。
3 讨论
本实验采用总黄酮提取工艺对嘉陵20号桑树枝条进行提取,以甲醇-0. 3%磷酸系统作为流动相进行梯度洗脱,检测总黄酮粗提物中3种代表性黄酮类成分芦丁、桑色素和槲皮素的含量分别为1.41mg/g、0.63mg/g、1.08mg/g,桑枝总黄酮含量得率为1.01%。
从三个方面对嘉陵20号桑枝中3种代表性黄酮进行抗氧化活性评价,即自由基清除能力测试、总还原力测试和对DNA的保护作用。在相同浓度下各样品(维生素E、芦丁、桑色素、槲皮素和桑枝提取物)的自由基清除能力差别较大,槲皮素的DPPH·清除力(IC50为0.042mg/mL)明显比桑枝提取物、芦丁和桑色素高,且与维生素E相当;桑枝总黄酮提取物的ABTS+清除力(IC50为0.019mg/mL)比芦丁、桑色素、槲皮素强,且高于阳性对照;芦丁的还原能力相对于其他两种黄酮成分是最弱的。黄酮类化合物通常由A 环、B环和C环形成大的P-π共轭体系,具有强烈的排斥电子作用,且黄酮类化合物清除自由基的主要活性部位为B环,B环上含有酚羟基,处于这个大的共轭体系之中,因此易脱氢提供电子与自由基相结合,从而将自由基清除。芦丁、槲皮素、桑色素均为典型的多酚羟基化合物,槲皮素与桑色素的结构差别体现在B环酚羟基的位置上,前者为B环邻二羟基,而后者为B环间二羟基,环上羟基位置会影响清除自由基活性,邻位羟基清除自由基的活性强于间位羟基[13],这能很好解释为什么槲皮素较桑色素清除能力较强。芦丁总还原力最弱,可能是由于C环3位上的糖基化产生空间位阻,影响酚羟基上氢的活性[14]。桑枝总黄酮提取物对DNA的保护潜力与桑色素和槲皮素相当,且均高于阳性对照。各样品抗氧化性差异与化合物的结构有关,对不同黄酮类成分结构的研究为其抗氧化性提供了较好的参考,同时避免黄酮类物质之间存在的拮抗作用和协同作用[15]。本实验得出两种黄酮并不是主要活性贡献者,是否存在其他黄酮类物质参与协同作用有待进一步深究。
以上结论说明嘉陵20号桑树枝条提取物及其中的3种代表性黄酮类成分抗氧化活性明显,利用前景广阔,为天然抗氧化剂的开发提供了实验基础。但是对这些成分的作用原理以及相互之间的作用机制还有待深入研究。

