一种不依赖于活病毒的中东呼吸综合征冠状病毒受体结合区特异性中和抗体检测方法的建立
,, ,, ,,,育森,,
中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)是一种新型冠状病毒,能够导致严重的肺炎,休克及器官衰竭,致死率高达到30%以上,是继2002年非典型肺炎(Severe Acute Respiratory Syndromes,SARS)暴发以来,出现的又一种感染人类的高致病性冠状病毒[1-2]。MERS-CoV由4种结构蛋白构成,包括刺突蛋白(spike protein,S),膜蛋白(membrane protein,M),囊膜蛋白(envelope protein,E)和核蛋白(nucleoprotein,N)。其中,S蛋白又分为S1,S2两个亚基,位于S1区的受体结合域(receptor-binding domain,RBD)主要识别结合宿主细胞,S2亚基含有HR1/HR2,介导病毒与细胞膜融合的过程[3]。二肽基肽酶(dipeptidyl peptidase,DPP4)作为MERS-CoV的受体,也是融合过程的关键分子[4]。DPP4被S蛋白上RBD识别结合后,配合其他功能膜蛋白分子如CD9、TTSP,切割S蛋白,S蛋白构象发生变化后,与宿主细胞膜融合,病毒颗粒的早期感染由此开始[5]。2017年,Yuan 等解析了MERS-CoV和SARS-CoV S蛋白及RBD融合过程的动态结合晶体结构,论证了位于S蛋白的RBD具有灵活的结构以便识别结合受体,而这个区域正是广泛诱导中和抗体的区域[6-8]。针对MERS-CoV的中和抗体可以封闭病毒,同时不影响DPP4的正常生理功能,阻断RBD与DPP4的结合,是未来能够用于MERS-CoV临床治疗的优质候选者[8]。因此应用中和抗体能够阻断RBD结合受体细胞的原理,从而建立无病毒检测MERS-CoV中和抗体的想法也应运而生。
目前,应用于MERS-CoV中和抗体检测的方法有很多,包括蚀斑减少中和试验[9]、假病毒抑制中和试验[10]、动物攻毒保护试验[9]等。在这些试验中,病毒培养,病毒滴度测定,假病毒包装,动物模型建立等过程需要较长的时间,且操作复杂,同时操作过程依赖高等级生物安全实验室,使得中和抗体的高通量试验及实时监测难以实现。本研究拟建立一种不依赖活病毒,在普通实验环境就能实施的高通量、高效率的MERS-CoV中和抗体检测方法。
1 材料与方法
1.1主要材料与设备 Huh-7细胞,293T细胞,pFuse-RBD-Fc表达载体由本实验室保存(RBD为MERS-CoV S蛋白377-588氨基酸序列[11]);DH5α感受态购自北京全式金公司;质粒大提试剂盒购自北京康为世纪;转染试剂LipofectamineTM3000 Reagent购自美国invitrogen; 细胞培养基DMEM 11640,胰酶及青链霉素购自美国Gibco公司;胎牛血清购自德国PAN公司;rEDIII-Fc蛋白由本实验室保存;rRBD-Fc蛋白免疫小鼠的初免血清、RBD人源化单抗hMS-1[12]、 RBD特异性非中和单抗;无关抗体Trastuzumab由本实验室保存;12株具有中和活性的MERS-CoV纳米抗体由本实验室构建的MERS-CoV纳米抗体噬菌体库筛选[13];32份待测血清由本实验室采集保存。细胞培养器材购自美国康宁公司;蛋白电泳,转膜设备购自美国Bio-Red;凝胶成像系统Amersham Imager 600购自美国GE公司;FITC标记的抗Fc抗体购自北京博奥龙;流式细胞仪购自美国Millipore公司;AKTA蛋白纯化仪购自美国GE Healthcare公司。
1.2rRBD-Fc蛋白表达纯化 将293T细胞培养对数生长期,细胞密度达到175 cm2细胞培养瓶70%~90%的面积时转染,转染前2 h换液。将129 μL LipofectamineTM3000 Reagent稀释到4.6 mL的Opti-MEMTM培养液中,轻轻混匀;同时,将55 μg pFuse-RBD-Fc质粒与111 μL P3000TMReagen稀释到4.6 mL的Opti-MEMTM培养液中,轻轻混匀;将两份稀释液等体积混合,室温孵育10~15 min后,缓慢均匀地滴加到细胞培养瓶中,37 ℃,5%CO2培养箱中培养72 h,共转染20瓶。用A蛋白亲和层析柱纯化细胞上清,收集目的蛋白溶液。利用SDS-PAGE及抗Fc标签抗体进行Western blot分析目的蛋白。
1.3rRBD-Fc与Huh-7细胞的结合效果与蛋白剂量的关系测定及结合特异性验证 将梯度稀释的50 μL rRBD-Fc蛋白与即时消化的1×105个Huh-7细胞混合,室温振荡30 min,37 ℃静置10 min。将孵育rRBD-Fc蛋白的Huh-7细胞转移至含有1 mL 3%FBS的PBS流式管中,洗涤4次。然后将FITC标记的抗Fc抗体以1∶1000的稀释度稀释,每管加入100 μL,锡箔纸包住,室温震荡10 min,37 ℃静置20 min,用1 mL 3%FBS 的PBS洗涤细胞4次。每管加入250 μL3%FBS 的PBS,轻轻混匀,每管取200 μL转移至96孔板中,用流式细胞仪检测每管细胞的荧光值。分别取0.25 μg rRBD-Fc 蛋白和0.25 μg rEDIII-Fc蛋白以相同的实验方法结合Huh-7细胞,孵育荧光抗体,流式细胞仪检测荧光强度。
1.4RBD受体结合阻断实验检测中和抗体 将50 μL 4种待测抗体分别与0.25 μg rRBD-Fc蛋白混合,室温震荡30 min,37 ℃静置10 min, 之后加入到含有5×105个Huh-7细胞的流式管中,室温孵育30 min。用1 mL的3%FBS的PBS洗涤细胞。之后每管加入100 μL 1:1000稀释的FITC标记的抗Fc抗体,于37 ℃反应30 min。用1 mL的3%FBS的PBS洗涤细胞。用250 μL PBS重悬细胞沉淀,取200 μL转移到96孔细胞培养板中,流式细胞仪检测荧光强度。根据不同浓度抗体对应的平均荧光强度在Graphpad软件中利用One site - Fit logIC50计算抗体的半数抑制浓度IC50。
1.5中和试验 按照文献[12]方法进行中和试验,涉及实毒操作在高等级生物安全三级实验室完成。将2倍倍比稀释的抗体与100 TCID50的MERS-CoV(EMC/2012株)等体积混合,37 ℃孵育1 h,之后将病毒与抗体混合物接种于96孔板单层Vero E6细胞,每个稀释度4复孔,37 ℃ 5% CO2培养1 h。而后,更换细胞维持液(含1%FBS、1%双抗的RPMI-1640)继续培养72 h,观察记录细胞病变效应(Cytopathic Effect,CPE),并通过Reed-Muench法计算纳米抗体50%中和剂量(50% Neutralizing Dose,ND50)。
1.6中和抗体不同检测方法一致性分析 运用实毒中和试验和新建立的非实毒依赖的中和抗体检测方法对12份中和抗体进行检测,应用Graphpad软件对检测数据进行双变量相关性分析。
2 结 果
2.1rRBD-Fc蛋白表达纯化 pFuse-RBD-Fc质粒转染293T细胞后,收集蛋白并纯化, 经SDS-PAGE和IgG1 Fc标签抗体Western blot检测结果如图1所示,可见在51 kD处有单一条带,表明蛋白表达正确且纯度较高。
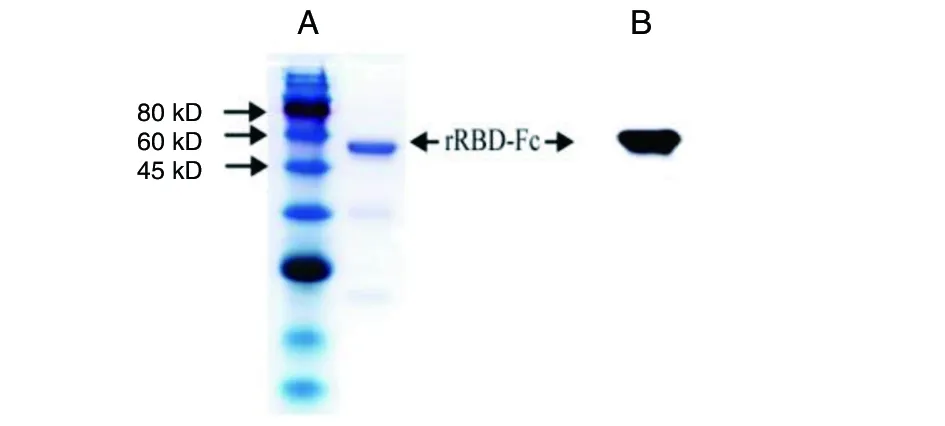
A: rRBD-Fc蛋白SDS-PAGE B: rRBD-Fc蛋白Western blot 检测图1 rRBD-Fc蛋白的SDS-PAGE及Western blot结果图Fig.1 SDS-PAGE and Western blot of rRBD-Fc protein
2.2rRBD-Fc蛋白功能验证 通过流式细胞仪测定不同剂量rRBD-Fc与Huh-7细胞的结合活性,结果如图2-A,表明制备的rRBD-Fc蛋白能够有效结合Huh-7细胞,且结合具有量效关系。当rRBD-Fc为0.25 μg时,结合作用达到平台期。因此,以0.25 μg 作为非病毒依赖中和抗体检测方法中rRBD-Fc蛋白使用量。Huh-7细胞能够表达MERS-CoV病毒受体hDPP4,是MERS-CoV病毒易感细胞系。为验证rRBD-Fc蛋白结合Huh-7细胞的特异性,以同样融合表达了人IgG1 Fc片段的乙脑病毒E蛋白片段rEDⅢ-Fc作为对照蛋白和Huh-7作用。结果如图2-B,表明对照蛋白rEDⅢ-Fc不能结合Huh-7细胞,而rRBD-Fc蛋白能够特异性的与Huh-7细胞结合。
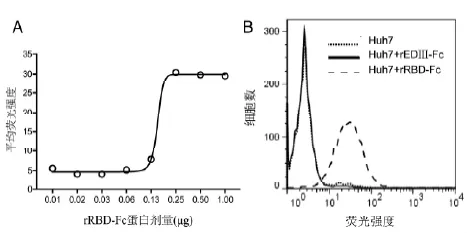
A: rRBD-Fc与Huh-7细胞的结合效果与蛋白剂量的关系测定B: rRBD-Fc蛋白与Huh-7细胞特异性结合的验证图2 rRBD-Fc蛋白功能验证结果图Fig.2 rRBD-Fc protein functional verification result
2.3RBD受体阻断实验中和抗体检测方法特异性鉴定 为验证受体阻断实验是否只针对中和抗体而对其他类型的抗体无识别作用,选取以rRBD-Fc蛋白作为抗原免疫小鼠得到的具有中和活性的初免血清、针对抗MERS-CoV中和单抗hMS-1、RBD特异性的非中和单抗以及非RBD特异性的无关抗体Trastuzumab来验证新建立的非实毒依赖中和抗体检测方法的特异性。结果表明,RBD特异性的中和单抗hMS-1和rRBD-Fc初免血清均能有效阻断rRBD-Fc与Huh-7细胞的结合作用,且已知中和活性弱于中和单抗的rRBD-Fc初免血清在阻断实验中同样表现出了比hMS-1弱的阻断活性。相比之下,RBD特异性不具有中和活性的抗体样品和非RBD特异性的无关抗体Trastuzumab均对rRBD-Fc与Huh-7细胞的结合没有任何阻断作用。由此可见,基于rRBD-Fc与Huh-7细胞结合活性建立的MERS-CoV RBD特异性中和抗体评价方法能够有效区分中和抗体和非中和抗体,以及中和抗体活性强弱。
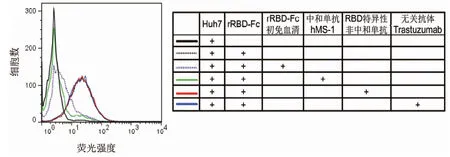
图3 不同种抗体阻断rRBD-Fc与Huh-7结合显示的荧光强度Fig.3 Fluorescence intensity of different kinds of antibodies block the rRBD-Fc binding with Huh-7 cell
2.4实毒中和试验与非实毒依赖的中和抗体检测方法结果一致性分析 为验证建立的非实毒中和抗体检测方法与传统实毒中和试验的一致性,运用这两种检测方法分别检测了12份中和抗体样品。如图4所示,非实毒中和抗体检测方法与传统的实毒中和试验方法具有很好的一致性。
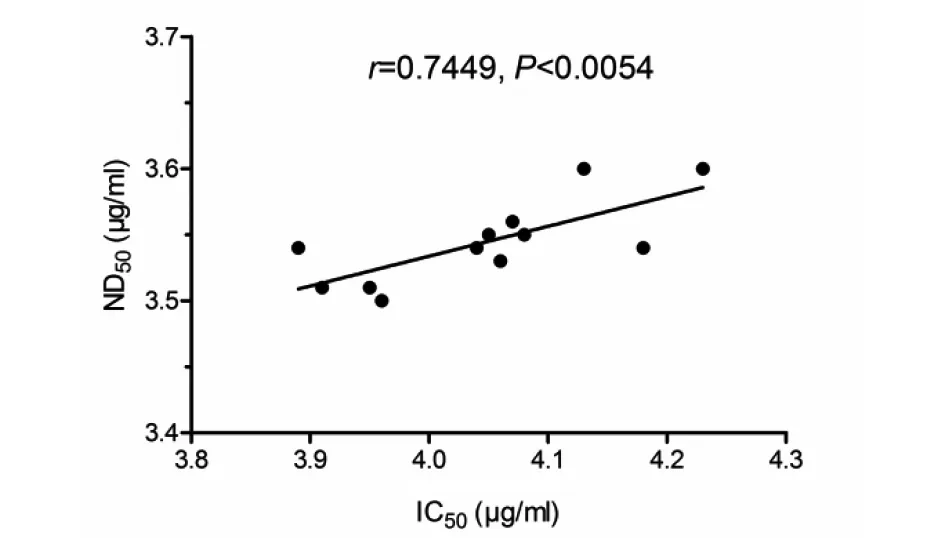
图4 ND50与IC50的变化趋势散布图Fig.4 Scatter diagram of variation trend on ND50 and IC50
2.5应用非实毒依赖的中和抗体检测方法进行血清学检测 应用建立的非实毒依赖的MERS-CoV RBD特异性中和抗体检测方法分别检测了6份rRBD-Fc免疫小鼠血清、6份正常小鼠血清、10份骆驼血清和10份健康人血清,同时以实毒中和试验测定这些标本的中和抗体效价。结果表明,非实毒依赖的MERS-CoV RBD特异性中和抗体检测方法能够有效应用于血清标本的中和抗体筛查。
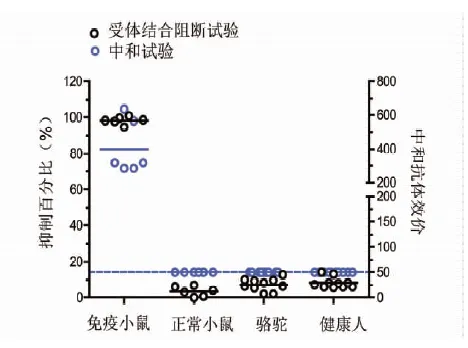
图5 非实毒依赖的中和抗体检测方法高通量检测中和抗体Fig.5 Application of non-live-virus neutralization antibody detection method in high flux detection
3 讨 论
本研究建立的非实毒依赖的MERS-CoV RBD特异性中和抗体检测方法是基于RBD特异性的中和抗体可以阻断RBD与病毒受体DPP4结合的原理而设计的。DPP4是MERS-CoV的功能性受体,而Huh-7细胞是MERS-CoV敏感细胞系,能够表达DPP4受体蛋白,且能与rRBD-Fc特异性结合。位于S1亚基的RBD是与DPP4结合的功能单位,融合表达带有人IgG Fc标签的RBD蛋白,可构成结构更稳定的重组蛋白[14]。在此基础上,rRBD-Fc能够特异性得结合Huh-7细胞,FITC标记的抗Fc抗体又能特异性的与rRBD-Fc结合,在细胞通过流式细胞仪时,可以收集到细胞携带的绿色荧光信号;中和抗体可以阻断RBD与DPP4的结合,孵育中和抗体的rRBD-Fc蛋白不再具有结合Huh-7细胞的功能,因此FITC标记的抗Fc抗体被洗脱,流式细胞仪不能检测到荧光信号。而不具有中和活性的抗体,包括非RBD特异性抗体和RBD特异性非中和抗体,都不能够阻断RBD与Huh-7细胞的结合,这样在孵育FITC标记的抗Fc抗体后依然可以检测到绿色荧光信号。因此,荧光强度越弱,中和抗体的阻断效果越好,中和活性越高。
本研究建立的非实毒依赖的中和抗体检测方法具有RBD特异性。本方法在筛选非RBD特异性中和单抗时尚存在一定的局限性,但RBD与病毒受体的结合是MERS-CoV感染的第一步,RBD功能区是介导病毒感染和诱导机体产生中和抗体的关键功能区,因此,在MERS-CoV感染血清中必然存在大量RBD特异性的中和抗体。而且,目前包括鼠源单抗[15]、人源化单抗[12]、及人源单抗[16]在内的一系列已经报道的治疗性候选单抗都是针对RBD功能区的。因此,本研究建立的RBD特异性中和抗体检测方法在筛选中和单抗时同样具有实用价值。除此之外,在临床上,感染MERS-CoV的患者,按照临床症状严重程度不同可以分为无症状、有症状无肺炎、有肺炎无呼吸困难、肺炎转化为呼吸衰竭4种类型,患者血清转归方向决定了愈后。通过中和试验检测患者血清中和抗体,若21 d后,机体还未产生中和抗体,即发生血清阳性转归,患者接连死亡;而21 d内机体能够产生中和抗体的患者,则全部存活[17]。因此,中和抗体是病人产生良性愈后的必要条件,而快速、高效得检测中和抗体效价,是实时监测患者病程转归,评价治疗方法的必要手段。
本研究建立的非实毒依赖的MERS-CoV RBD特异性中和抗体检测方法在整个实验过程仅需用到重组蛋白、细胞、相关标记抗体以及流式细胞仪,在普通的实验环境即可完成,非常安全便捷。而传统的中和试验需要在高等级生物安全实验室内进行MERS-CoV实毒操作,不仅整个实验过程耗时长,并且安全风险高;通过假病毒中和试验检测中和抗体虽然可以不依赖高等级生物安全实验室,但仍需要病毒包装,病毒滴度测定等一系列过程,同样耗时耗力[10]。本研究建立的这种非实毒依赖的中和抗体检测方法可在一天内完成,且十分安全,检测结果与经典中和试验方法的检测结果一致,稳定性好,不需镜下观察,容易质控,结合高通量流式检测手段,将是血清学筛查、中和抗体筛选、临床标本检测的理想选择,不论在临床还是科研中都有广泛的应用前景。
参考文献:
[1] Yu X, Zhang S, Jiang L, et al. Structural basis for the neutralization of MERS-CoV by a human monoclonal antibody MERS-27[J]. Sci Rep,2015,5:13133. DOI: 10.1038/srep13133
[2] Zhou J, Li C, Zhao G, et al. Human intestinal tract serves as an alternative infection route for Middle East respiratory syndrome coronavirus[J].Sci Adv,2017,3(11):eaao4966.DOI: 10.1126/sciadv.aao4966
[3] Li F. Structure, function, and evolution of coronavirus spike proteins[J].Annu Rev Virol,2016,3(1):237-261. DOI: 10.1146/annurev-virology-110615-042301
[4] Lu G, Hu Y, Wang Q, et al. Molecular basis of binding between novel human coronavirus MERS-CoV and its receptor CD26[J]. Nature,2013,500(7461):227-231. DOI: 10.1038/nature12328
[5] Earnest JT, Hantak MP, Li K. The tetraspanin CD9 facilitates MERS-coronavirus entry by scaffolding host cell receptors and proteases[J].PLoS Pathog,2017,13(7):e1006546. DOI: 10.1371/journal.ppat.1006546
[6] Yuan Y, Cao D, Zhang Y, et al. Cryo-EM structures of MERS-CoV and SARS-CoV spike glycoproteins reveal the dynamic receptor binding domains[J]. Nat Commun,2017,8:15092. DOI: 10.1038/ncomms15092
[7] Li Y, Wan Y, Liu P, et al. A humanized neutralizing antibody against MERS-CoV targeting the receptor-binding domain of the spike protein[J].Cell Res,2015,25(11):1237-1249. DOI: 10.1038/cr.2015.113
[8] Tai W, Wang Y, Fett CA, et al. Recombinant receptor-binding domains of multiple middle east respiratory syndrome coronaviruses (MERS-CoVs) induce cross-neutralizing antibodies against divergent human and camel MERS-CoVs and antibody escape mutants[J]. J Virol, 2017,91(1): e01651-16. DOI: 10.1128/JVI.01651-16
[9] Zhao J, Alshukairi AN, Baharoon SA, et al. Recovery from the Middle East respiratory syndrome is associated with antibody and T-cell responses[J].Sci Immuno,2017,2(14): eaan5393. DOI: 10.1126/sciimmunol.aan5393
[10] Zhao G, Du L, Ma C, et al. A safe and convenient pseudovirus-based inhibition assay to detect neutralizing antibodies and screen for viral entry inhibitors against the novel human coronavirus MERS-CoV[J]. J Virol,2013,10:266. DOI: 10.1186/1743-422X-10-266
[11] Tang J, Zhang N, Tao X, et al. Optimization of antigen dose for a receptor-binding domain-based subunit vaccine against MERS coronavirus[J].Hum Vacc Immunother,2015,11(5):1244-1250. DOI: 10.1080/21645515.2015.1021527
[12] Qiu H, Sun S, Xiao H, et al. Single-dose treatment with a humanized neutralizing antibody affords full protection of a human transgenic mouse model from lethal Middle East respiratory syndrome (MERS)-coronavirus infection[J]. Antivira Res, 2016;132:141-148. DOI:10.1016/j.antiviral. 2016.06.003
[13] 何雷,李江凡,任烁,等. 中东呼吸综合征冠状病毒特异性纳米抗体噬菌体展示库的构建和鉴定[J]. 细胞与分子免疫学杂志,2017,33(12),1662-1668.
[14] Wang C, Wu Y, Wang L, et al. Engineered soluble monomeric IgG1 Fc with significantly decreased non-specific binding[J]. Front Immuno,2017,8:1545. DOI: 10.3389/fimmu.2017.01545
[15] Du L, Zhao G, Yang Y, et al. A conformation-dependent neutralizing monoclonal antibody specifically targeting receptor-binding domain in Middle East respiratory syndrome coronavirus spike protein[J]. J Virol,2014,88(12):7045-7053. DOI: 10.1128/JVI.00433-14
[16] Jiang L, Wang N, Zuo T, et al. Potent neutralization of MERS-CoV by human neutralizing monoclonal antibodies to the viral spike glycoprotein[J]. Sci Transl Med, 2014,6(234):234ra59. DOI: 10.1126/scitranslmed.3008140
[17] Ko JH, Muller MA, Seok H, et al. Serologic responses of 42 MERS-coronavirus-infected patients according to the disease severity[J].Diagn Microbiol Infect Dis,2017,89(2):106-111.DOI: 10.1016/j.diagmicrobio.2017.07.006

