2016—2017年苏州市人感染 H7N9禽流感病毒HA基因进化分析
雅雪蓉 董泽丰 夏瑜 沈强
215004苏州市疾病预防控制中心
2013年3月在华东地区首次发现人感染H7N9病毒病例[1],病毒全基因序列分析表明H7N9病毒是新型多源重组禽流感病毒[2]。2013年以来该病毒每年冬春季都会在中国大陆造成不同程度的流行,目前中国已经经历了五个流行季[3]。世界卫生组织官网(http://www.who.int/csr/don/23-may-2017-ah7n9-china/en/)数据显示,截至2017年5月13日,已经报告了1 486例实验室确诊病例,总体病死率约为39.4%(586/1 486),并且出现了一些聚集性病例,不能排除病毒具有有限的人传人的可能。第五波的H7N9流行季实验室确诊的病例数超过了以往任何1次[4-5],引起了广泛的社会关注。
苏州位于长三角中部,是H7N9病毒的主要流行地区之一。自从2013年4月份苏州市确诊首例本地人感染H7N9病例后,每个流行季苏州都会受到不同程度的影响。为了解苏州地区H7N9病毒的流行特征,本研究采用Real-time PCR技术对2016年10月份至2017年5月份间苏州地区疑似病例咽拭子标本进行了H7N9病毒核酸检测,H7N9病毒核酸阳性标本送中国疾控预防控制中心进行病毒分离和基因序列测定。
1 材料与方法
1.1 样本来源2016年10月份至2017年5月份期间,采集不明原因肺炎病例咽拭子样本,同时收集患者人口学基本数据、可疑暴露史、发病日期以及主要临床症状等信息。
1.2 病毒检测参照QIAsymphony Viral/Bacteria Mini Kit试剂盒说明书提取样本核酸。按照A/B流感病毒通用Real-time PCR检测试剂盒说明书检测流感病毒RNA。A型阳性样本再检测pdmH1N1,H3,H5N1,H7N9以及H9N2亚型流感病毒。反应条件均为:50℃ 30 min,95℃ 5 min,95℃ 15 s,55℃ 40 s。所有样本24 h内完成检测,H7N9核酸检测阳性样本-80℃冻存。
1.3 HA基因测序H7N9病毒分离和HA基因测序在国家流感中心P3实验室进行,将200μl病毒核酸检测阳性样本接种到9~11日龄SPF级鸡胚尿囊腔,35℃培养72 h。收获尿囊液样本并提取病毒核酸用于基因测序。
1.4 HA基因序列分析同源矩阵分析采用DNASTAR软件,多序列比对使用ClustalX2软件,MEGA6.0软件建立HA基因序列系统进化树,方法为Neighbor-Joining,bootstrap=1000。HA全基因参考序列来自GISAID数据库。NetNGlyc 1.0 server用于预测HA蛋白的糖基化位点。
2 结果
2.1 病例特征2016年10月份至2017年5月份,苏州疾病控制中心共确诊了55例人感染H7N9禽流感病毒患者,死亡22例,总体病死率为40%(22/55)。83.6%(46/55)的病例在发病前10 d内直接接触过活禽或暴露于活禽市场.如图1所示,H7N9病毒主要在冬春季流行,苏州市H7N9病毒第五波流行季较以往开始的早,确诊的病例数也有明显增加。在第五波 H7N9确诊病例中,男性占比为72.7%(40/55),中位年龄为58岁(24~89岁)。职业分布中以退休老人和农民居多。所有病例发病时均伴有高烧(39.4℃,37.8~42℃)和咳嗽等临床症状。

图1 2013—2017年苏州市H7N9确诊病例时间分布Fig.1 Time distribution of patients infected with H7N9 virus in Suzhou city from 2013 to 2017
2.2 HA基因核酸序列分析苏州分离到的H7N9病毒血凝素HA基因全长1 683 bp,如图2所示,H7N9禽流感病毒有两大分支,分别为长三角分支(Yangtze River Delta)和珠三角分支(Pearl River Delta)。HA基因系统进化树表明苏州分离株均属长三角分支,与A/Zhengjiang/1/2017(H7N9)等华东地区其他地方第五波流行季分离到的病毒同源性最高。与前几波流行季分离的病毒有共同的祖先,但是分属不同的进化分支,与本市在2013年第一波H7N9流行季分离的病毒株A/Suzhou/3/2013(H7N9)也不在同一分支上,这表明H7N9病毒仍在不停的进化。此次苏州分离株HA基因同源性为98.7%~100%。与候选疫苗株A/Shanghai/02/2013(H7N9)的HA基因的核酸序列一致性为97.6%~98.1%。所有苏州分离株HA基因核酸序列1 014位和1 015位之间没有核苷酸插入,没有发现类似A/Guangdong/SP440/2017和A/Taiwan/1/2017等的高致病性突变株。
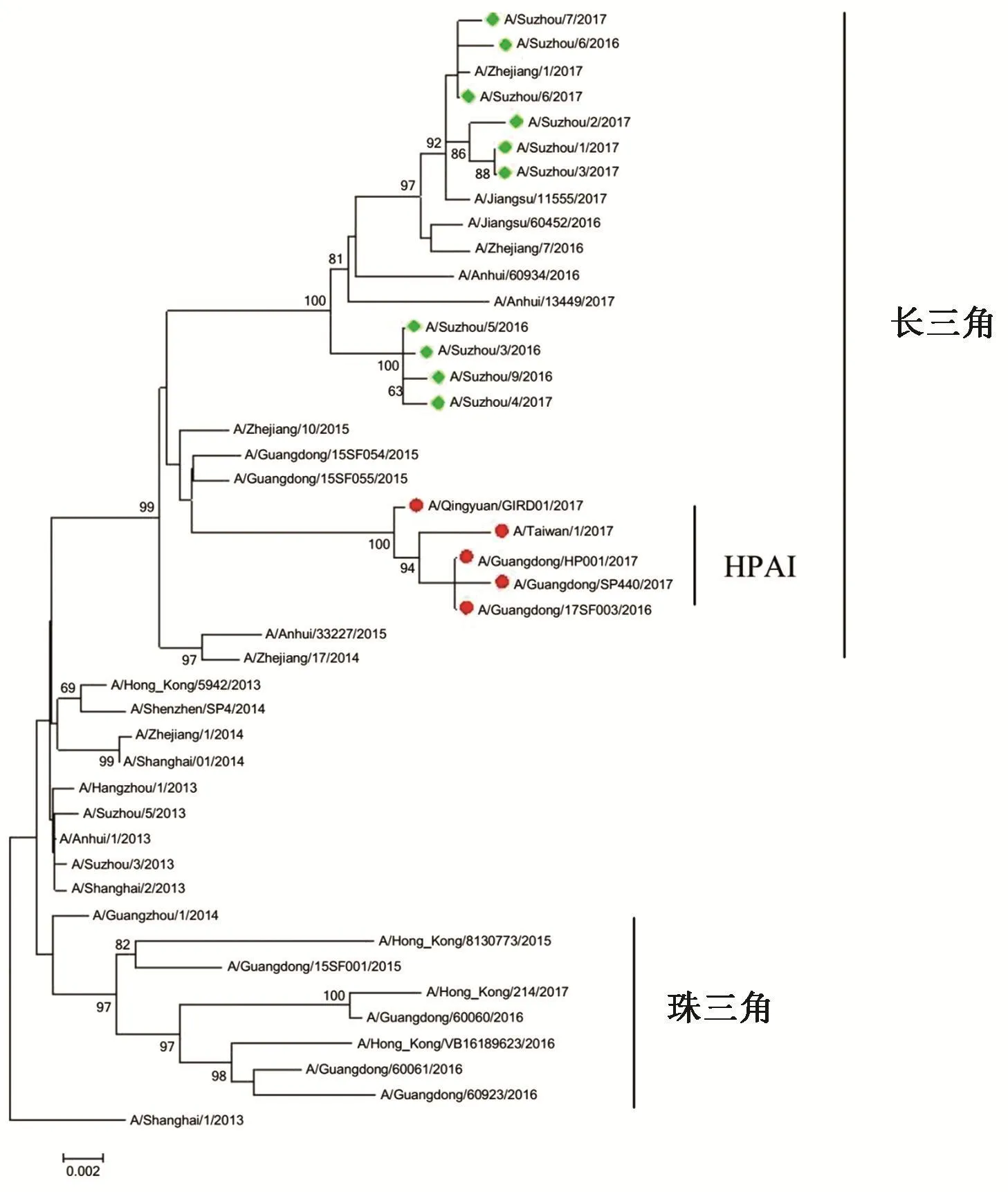
图2 苏州市2016—2017年第5波H7N9疫情病毒分离株HA基因进化树Fig.2 Phylogenetic tree of HA gene of H7N9 viruses isolated from the fifth wave in Suzhou city from 2016 to 2017
2.3 氨基酸序列分析2016—2017年流行季分离到的苏州株HA蛋白的受体结合位点(RBS)关键氨基酸没有改变。与A/Shanghai/02/2013(H7N9)序列相比,所有苏州分离株T168 A,G195 V,Q235 L和G237S(H7 Numbering)等RBS中关键位点氨基酸没有发生突变。H7N9病毒的受体结合偏好性也没有发生改变,仍具备与 SA-α2,3-Gal和 SA-α2,6-Gal结合的能力。广东地区分离到的高致病性突变株A/Guangdong/SF003/2016(H7N9)血凝素切割位点的氨基酸序列为PEVPKRKRTAR↓GLF,但是所有苏州分离株HA1和HA2之间切割位点的氨基酸序列仍为PEIPKGR↓GLF(333~342),337位和338位之间没有发现RKRT四个氨基酸的插入,血凝素连接肽氨基酸序列并未发生改变,说明在苏州地区流行的H7N9病毒对禽类仍然是低致病性的。
2.4 HA蛋白的糖基化位点分析根据NetNGlyc软件的分析结果,HA蛋白总共有5个潜在的糖基化位点,其中HA1有3个,HA2有2个。5个潜在的糖基化位点分别是30(N-G-T)、46(N-A-T)、249(N-D-T)、421(N-W-T)和493(N-N-T)。与候选疫苗株A/Shanghai/02/2013(H7N9)相比,苏州分离株HA蛋白潜在糖基化位点的数量和位置没有发生改变。
3 讨论
苏州人感染H7N9禽流感病毒的病死率为40%,与全国数据(39.4%)相比差异无统计学意义(P>0.05),远高于季节性流感。由于第五波H7N9疫情发生时间早,分布地域广,确诊感染人数多等原因,引起广发的社会关注[3]。此次疫情尚未完全结束,苏州目前也正遭受H7N9病毒的影响。在苏州市人感染H7N9病毒的主要途径是接触活禽或暴露于活禽市场,H7N9病毒的检出高峰在春节前1个月,这可能与此时处在活禽消费高峰,人们暴露于活禽或活禽市场的机会增加有关,此外,冬季气温较低,H7N9病毒在外环境中存活时间较长也可能是感染人数增加的原因。在此波疫情中,H7N9病毒的流行特征没有发生明显改变一致,与之前的研究结果[6-8]。
与季节性流感病毒偏好结合SA-a-2,6-Gal受体不同,禽流感病毒偏好结合SA-α-2,3-Gal受体[9-10]。禽流感病毒必须突破种间屏障,能够与SA-a-2,6-Gal有效结合才能感染人类。而病毒能否与SA-a-2,6-Gal结合主要影响因素是由受体结合位点中关键氨基酸。研究表明禽流感病毒RBS中T168 A,G195 V,Q235 L和G237S(H7 Numbering)突变能够增加病毒与人类受体的结合能力[11-14]。与候选疫苗株A/Shanghai/02/2013(H7N9)相比,苏州分离株在这些关键氨基酸位点没有发生突变,这表明H7N9病毒目前还不具备在人际间持续传播的能力。
HA基因序列分析结果表明所有苏州分离株均为长三角分支,并且H7N9病毒仍在不停的进化。第五波流行季中台湾和广东地区出现了高致病性突变株,发现HA蛋白的切割位点插入了RKRT四个氨基酸,使原本对禽类低致病的H7N9病毒突变为对禽类高致病性[5],这对家禽养殖业将产生重要影响。但是,目前所有苏州分离株的HA蛋白切割位点氨基酸序列并未发生改变,苏州地区流行的H7N9病毒对禽类仍然是低致病性的。
流感病毒糖基化位点的减少有利于病毒免疫逃避以及与受体的结合[15-16]。研究表明H7N9病毒HA蛋白头部糖基化位点的改变会对病毒的适应性产生影响[17]。苏州H7N9病毒分离株HA蛋白潜在的糖基化位点没有发生可使病毒传播能力增强的改变。
值得警惕的是,已经有一些聚集性H7N9病例被证实[18-20],在每起聚集性疫情中,仅有2~3个确诊病例,未有3代病例出现。苏州在第五波H7N9疫情中也发现了一起家庭聚集性病例,与之前的聚集性疫情相似,仅1对有血缘关系的父女两人被确诊感染H7N9病毒,其他密切接触者均未感染,表明H7N9病毒仅具有有限的人传人能力。
本研究初步讨论了苏州市第五波H7N9病毒疫情的流行情况及病毒HA基因的分子特征。总之,人感染H7N9病毒是散发事件,绝大多数病例之间没有流行病学联系。基因分析表明病毒的传播模式并未发生改变,但是为有效应对潜在的大流行,仍有必要密切监测病毒可能出现的变异并进行深入研究。
利益冲突无

