饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂生长性能、营养物质消化率、氮代谢及毛皮品质的影响
乜 豪 杨福合 张铁涛 崔 虎 司华哲 王中成 谢静静 高秀华*
(1.中国农业科学院饲料研究所,生物饲料开发国家工程研究中心,农业部饲料生物技术重点实验室,北京 100081;2.中国农业科学院特产研究所,长春 130112)
益生菌是指定植于动物肠道、生殖系统内,能产生确切健康功效,从而改善机体微生态平衡、发挥有益作用的活性微生物的总称[1]。益生菌作为动物饲料添加剂具有促生长、提高饲料消化率、增强动物免疫能力、预防及治疗疾病等功能[2-4]。因此,具有无污染、无残留和无毒副作用等优点的益生菌作为饲料添加剂使用倍受关注。Hu等[5]研究得出,饲粮中添加枯草芽孢杆菌KN-42可以改善仔猪的生长性能和胃肠健康。刘江坤等[6]研究得出,断奶仔猪饲粮中添加枯草芽孢杆菌(PB6株)制剂可显著提高仔猪的平均日增重(ADG)和蛋白质消化率,降低料重比(F/G),改善仔猪肠道的微生态平衡,缓解断奶应激对仔猪的不利影响。侯璐等[7]研究发现,断奶仔猪饲粮中添加粪肠球菌等益生菌可以提高其平均日采食量(ADFI)和平均日增重,降低腹泻率,提高机体免疫力和蛋白质利用率。贡筱等[8]研究发现,在育成期蓝狐饲粮中添加益生菌(枯草芽孢杆菌和粪肠球菌)可提高蓝狐的生长性能和蛋白质、脂肪消化率,降低氮排出,提高氮沉积。荆祎等[9]研究发现,水貂饲粮中添加貂源乳杆菌和屎肠球菌可显著提高干物质和蛋白质消化率,降低粪氮排出量,提高机体免疫功能。国内外将枯草芽孢杆菌和粪肠球菌应用于猪等动物上的报道[5-7]较多,但还未见应用于冬毛期水貂的报道。为此,本试验拟通过研究饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂生长性能、营养物质消化率、氮代谢及毛皮品质的影响,筛选出其在冬毛期水貂饲粮中的适宜添加量,为枯草芽孢杆菌和粪肠球菌在水貂生产中的应用提供理论依据。
1 材料与方法
1.1 试验材料
试验所用益生菌均由北京思科福生物科技有限公司提供,枯草芽孢杆菌来源是土壤,粪肠球菌来源是猪肠道。经测定,枯草芽孢杆菌制剂有效活菌数≥1×1010CFU/g,粪肠球菌制剂有效活菌数≥1×1010CFU/g。
1.2 试验动物及饲粮
在农业部长白山野生生物资源重点野外科学观测试验站的毛皮动物生产基地随机选择健康、体重为(1 767.94±174.20) g的135日龄雄性水貂70只。国内目前没有统一的水貂饲养标准,参照NRC(1982)[10]水貂与狐营养需求并结合国内相关研究报道[11],配制冬毛期水貂基础饲粮,此水貂饲粮为干粉料型,其组成及营养水平见表1。
1.3 试验设计与饲养管理
试验采用单因素完全随机试验设计,将70只水貂随机分成7组,每组10个重复,每个重复1只。Ⅰ组为对照组,饲喂基础饲粮;Ⅱ、Ⅲ和Ⅳ组在基础饲粮中分别添加1×108、1×109和1×1010CFU/kg枯草芽孢杆菌,即每千克饲粮中添加0.01、0.10和1.00 g枯草芽孢杆菌制剂;Ⅴ、Ⅵ和Ⅶ组在基础饲粮中分别添加1×108、1×109和1×1010CFU/kg粪肠球菌,即每千克饲粮中添加0.01、0.10和1.00 g粪肠球菌制剂。育成期后,水貂已适应干粉料,故没有预试期,分组完成后即开始试验,试验期70 d。试验水貂均单笼饲养,每天08:00和15:00各饲喂1次,2种益生菌均为每日添加,先溶解在水中,然后加入一定量的饲粮,混合均匀后进行饲喂,自由饮水,试验于2016年9—11月在农业部长白山野生生物资源重点野外科学观测试验站进行。
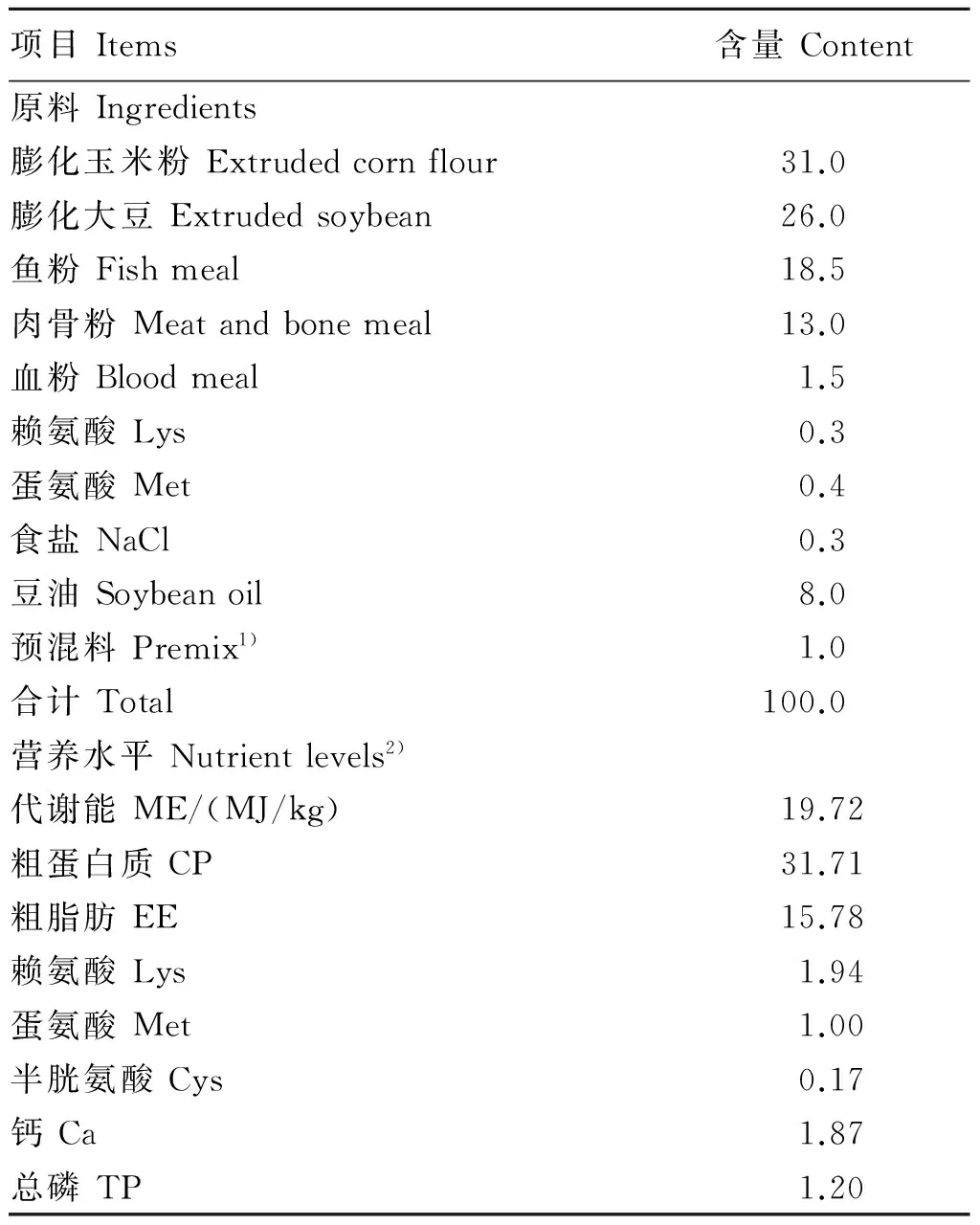
表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of the diet: VA 10 000 IU,VD32 000 IU,VE 100 IU,VB16 mg,VB210 mg,VB66 mg,VB120.1 mg,VK31 mg,VC 400 mg,烟酸 niacin acid 30 mg,泛酸 pantothenic acid 40 mg,生物素 biotin 0.2 mg,叶酸 folic acid 1 mg,胆碱 choline 400 mg,Fe 82 mg,Cu 20 mg,Mn 120 mg,Zn 50 mg,I 0.5 mg,Se 0.2 mg,Co 0.3 mg。
2)代谢能为计算值(代谢能=18.8×粗蛋白质+39.8×粗脂肪+17.6×碳水化合物),其他为测定值。ME was a calculated value (ME=18.8×CP+39.8×EE+17.6×carbohydrate), while the others were measured values.
1.4 消化代谢试验
试验第32天,每组挑选6只体重相近的水貂进行消化代谢试验,消化代谢试验时间为2016年10月16日至2016年10月18日,共计3 d。采用全收粪法,消化代谢试验期间饲养管理与日常饲养管理相同。每天收集尿液,在每100 mL尿液中加入2 mL的10%硫酸溶液,加4滴甲苯用于防腐,保存于-20 ℃备用。每天收集的粪便称重后按鲜重的5%加入10% 硫酸溶液,并加少量甲苯防腐,保存于-20 ℃备用。将3 d的尿液和粪便分别混合均匀后取样,其中粪便于65 ℃烘干至恒重,磨碎过40目筛,制成风干样本,以备实验室分析。
1.5 测定指标及方法
试验第1天早晨对每只水貂进行空腹称重,为初始体重,试验结束后空腹称重,作为终末体重,计算出每组水貂的平均日增重;记录每只水貂每天的给料量和剩料量,计算每组水貂的平均日采食量以及料重比。试验结束后屠宰,屠宰前对毛皮品质进行鉴定,由4名中国农业科学院特产研究所毛皮动物营养研究专家组成评分小组进行打分,品质评分为1~12分[12-13],根据毛绒丰满度、颜色、光泽度和平齐度分为4个等级,具体标准如下:1~3分,针毛弯曲、脱毛自咬伤残、破损等;4~6分,毛色不光亮、平齐度低、颜色不均匀等;7~9分,毛绒较丰足,毛色黑,毛被较光亮,背、腹部毛绒较平齐、柔和,无伤残等;10~12分,毛绒丰足,毛色黑,毛被光亮,背、腹部毛绒较平齐、柔和,无伤残,针毛无弯曲,无夏毛未脱净等。水貂体长用软尺测量,为鼻尖到尾根的长度;水貂针毛长和绒毛长使用直尺测量,选水貂背中部针毛和绒毛,为毛尖到毛根部的长度。
饲粮及排泄物中的干物质含量采用烘箱烘干法进行测定,参考GB/T 6435—2006[14];粗脂肪含量采用索氏抽提法进行测定,参考GB/T 6433—2006[15];粗蛋白质含量采用FOSS凯氏定氮仪以凯氏定氮法进行测定,参考GB/T 6432—1994[16];钙含量以高锰酸钾滴定法测定,参考GB/T 6436—2002[17];总磷含量以钒钼酸铵比色法测定,参考GB/T 6437—2002[18];盐酸水解法测定氨基酸含量,参考GB/T 5009.124—2003[19]。
1.6 数据处理
结果以平均值±标准差表示,试验数据采用SPSS 22.0软件进行统计分析,采用单因素方差分析(one-way ANOVA)进行差异显著性检验,其中P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂生长性能的影响
由表3可知,各试验组终末体重和平均日增重均高于对照组,且Ⅵ组终末体重与对照组的差异达显著水平(P<0.05),Ⅳ、Ⅵ和Ⅶ组的平均日增重与对照组的差异达显著水平(P<0.05)。Ⅱ组料重比与对照组差异不显著(P>0.05),其他试验组均显著低于对照组(P<0.05)。各组平均日采食量差异不显著(P>0.05)。
2.2 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂营养物质消化率的影响
由表4可知,各组干物质采食量、干物质排出量和干物质消化率均差异不显著(P>0.05)。Ⅵ组蛋白质消化率显著高于对照组以及Ⅱ和Ⅴ组(P<0.05)。各组脂肪消化率均在90%以上,且各试验组脂肪消化率均显著高于对照组(P<0.05)。
2.3 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂氮代谢的影响
由表5可知,各试验组食入氮、粪氮和尿氮与对照组差异不显著(P>0.05)。Ⅳ和Ⅵ组氮沉积显著高于对照组(P<0.05)。各试验组净蛋白质利用率和蛋白质生物价值均高于对照组,但差异不显著(P>0.05)。
2.4 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂毛皮品质的影响
由表6可知,各试验组毛皮品质略优于、体长略高于对照组,但差异均不显著(P>0.05)。各组针毛长差异不显著(P>0.05)。Ⅳ组绒毛长显著高于Ⅴ组(P<0.05),但针绒比显著低于Ⅴ组(P<0.05)。
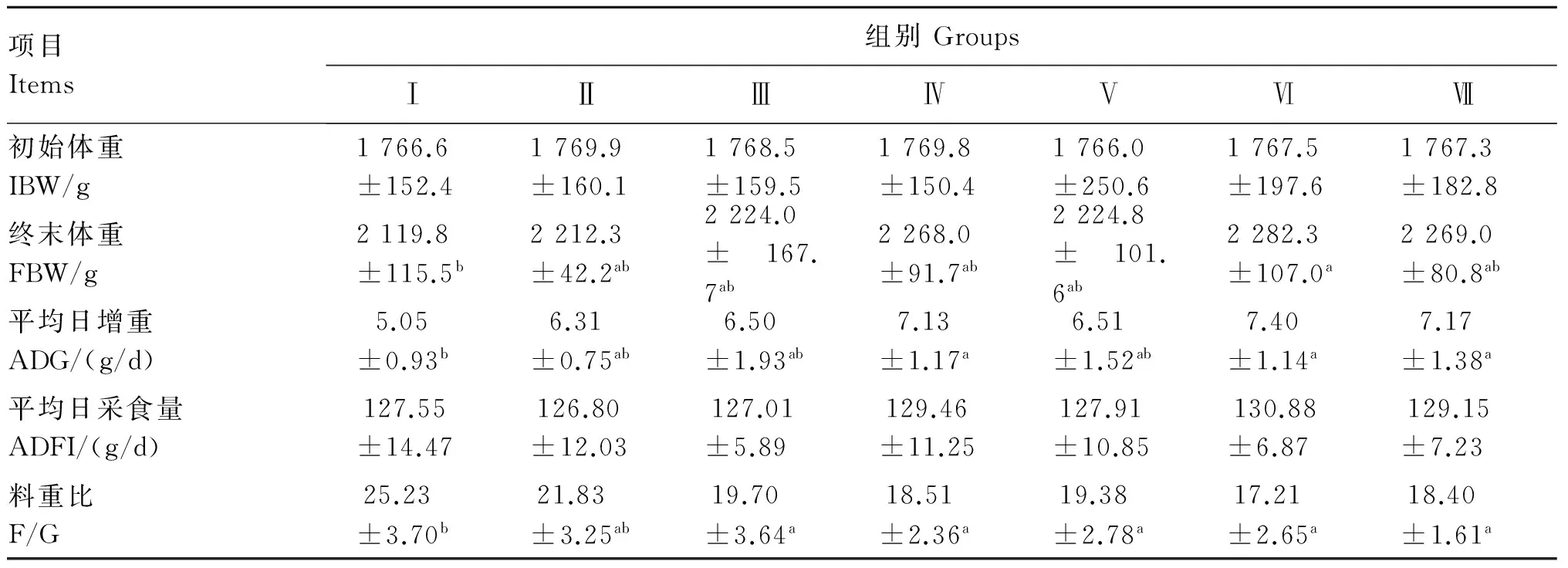
表3 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂生长性能的影响
同行数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
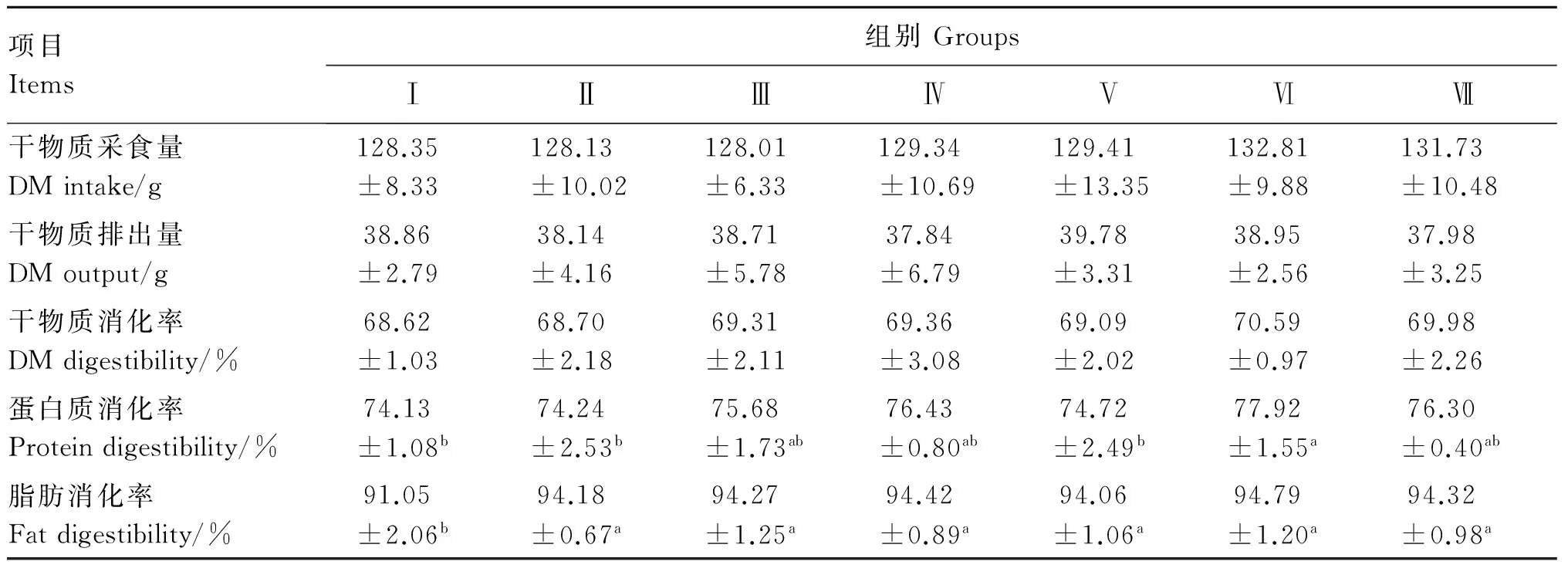
表4 饲粮中添加枯草芽孢杆菌和粪肠球菌对冬毛期水貂营养物质消化率的影响
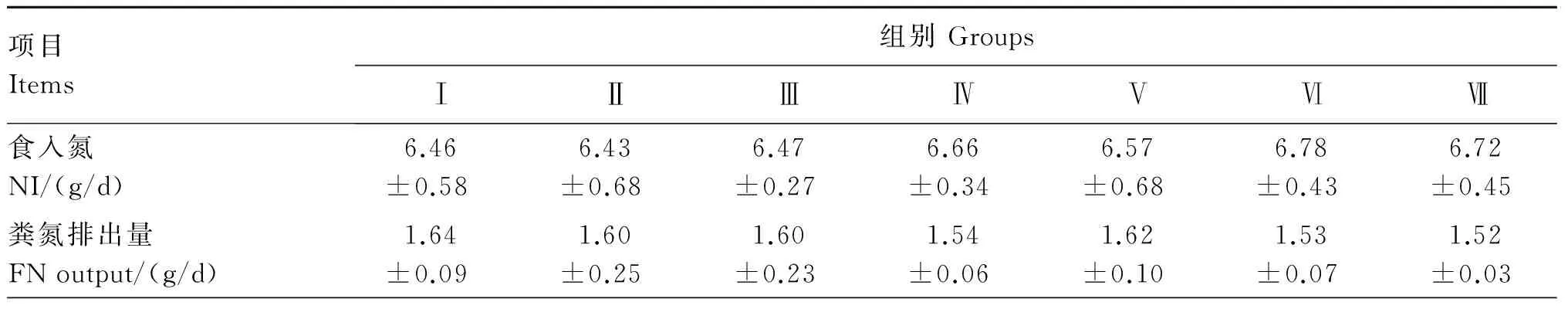
表5 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂氮代谢的影响
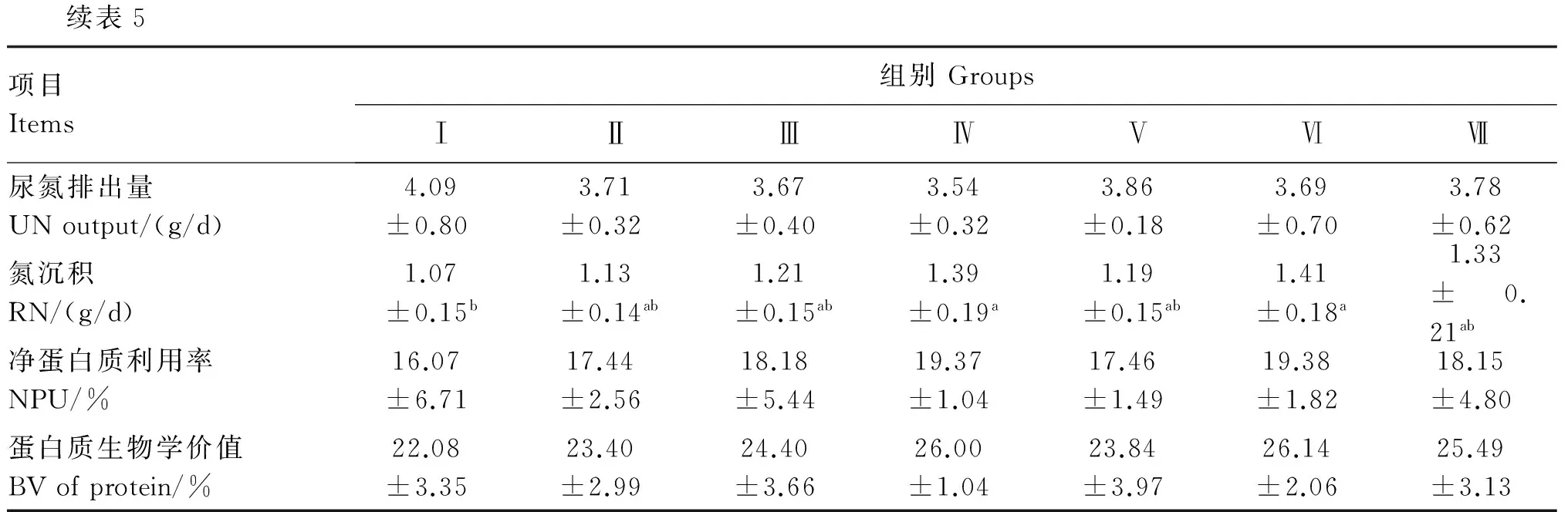
续表5项目Items组别GroupsⅠⅡⅢⅣⅤⅥⅦ尿氮排出量UNoutput/(g/d)4.09±0.803.71±0.323.67±0.403.54±0.323.86±0.183.69±0.703.78±0.62氮沉积RN/(g/d)1.07±0.15b1.13±0.14ab1.21±0.15ab1.39±0.19a1.19±0.15ab1.41±0.18a1.33±0.21ab净蛋白质利用率NPU/%16.07±6.7117.44±2.5618.18±5.4419.37±1.0417.46±1.4919.38±1.8218.15±4.80蛋白质生物学价值BVofprotein/%22.08±3.3523.40±2.9924.40±3.6626.00±1.0423.84±3.9726.14±2.0625.49±3.13

表6 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂毛皮品质的影响
3 讨 论
3.1 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂生长性能的影响
益生菌作为饲料添加剂使用,动物采食后益生菌后可部分定植于动物肠道内,在肠道内发挥不同的作用[1]。枯草芽孢杆菌等需氧型益生菌可迅速消耗掉肠道中的游离氧,利于消化道优势厌氧菌生长,抑制致病性需氧菌繁殖,从而恢复动物肠道健康,进而提高动物生长性能;粪肠球菌等乳杆菌进入肠道产生大量乳酸,降低肠道pH,抑制致病菌生长,提高酸性蛋白酶活性,有助于动物消化,提高动物生长性能[20]。Cui等[21]报道,饲粮中添加枯草芽孢杆菌制剂可显著提高猪的平均日增重,提高生长性能。周映华等[22]研究发现,饲粮中添加枯草芽孢杆菌可显著提高断奶仔猪的平均日增重,降低料重比,提高生长性能。本试验条件下,当饲粮中添加1×1010CFU/kg枯草芽孢杆菌时,水貂的平均日增重最高,料重比最低,说明冬毛期水貂饲粮中枯草芽孢杆菌添加量为1×1010CFU/kg时效果最佳,这与在水貂育成期上所得结果[23]一致。水貂育成期饲粮中枯草芽孢杆菌添加量达1×1011CFU/kg时,发现其对生长性能的影响并不显著[23],其原因可能是大量枯草芽孢杆菌较长时间的添加造成水貂肠道失衡,对其生长性能的增长效果甚微。Ross等[24]研究得出,将乳酸杆菌和屎肠球菌(猪粪中提取)添加到猪的饲粮中可提高其平均日增重。史自涛[25]研究发现,饲粮中添加粪肠球菌可提高断奶仔猪试验第15~31天的平均日增重和平均日采食量,改善生长性能。本试验结果显示:饲粮中粪肠球菌添加量为1×109CFU/kg时,水貂的平均日增重和终末体重均显著高于对照组,料重比显著低于对照组,说明冬毛期水貂饲粮中粪肠球菌添加量为1×109CFU/kg时效果最佳。
3.2 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂营养物质消化率的影响
脂肪是影响冬毛期饲粮中能量水平的主要营养成分,冬毛期水貂对能量的需求较高,而研究表明能量水平可影响动物的采食量[26],本试验中,各组水貂饲喂同一基础饲粮,能量水平一致,其干物质采食量无显著差异。Giang等[27]报道,饲粮中添加益生菌(芽孢杆菌和乳酸菌等)可显著提高育肥猪粗蛋白质消化率和干物质消化率。魏清甜[28]研究发现,保育仔猪饲粮中添加粪肠球菌(>2×109CFU/kg)可显著提高其粗蛋白质和粗脂肪的消化率,与抗生素组无显著差异。本试验结果显示,各组间干物质消化率差异不显著,但随着益生菌添加量的提高呈现出上升趋势;粪肠球菌添加量为109CFU/kg时,蛋白质消化率显著高于对照组、1×108CFU/kg枯草芽孢杆菌组和1×108CFU/kg粪肠球菌组;添加枯草芽孢杆菌或粪肠球菌的各试验组脂肪消化率均高于对照组。这与前人的研究结果一致,即添加益生菌可提高动物对蛋白质和脂肪的消化率,这是因为益生菌定植于肠道后,会分泌蛋白酶、脂肪酶和乳酸等,降低肠道pH,增强肠道蠕动,从而促进营养物质消化吸收。本试验条件下,1×108CFU/kg枯草芽孢杆菌组和1×108CFU/kg粪肠球菌组蛋白质消化率显著低于1×109CFU/kg粪肠球菌组,可能是益生菌添加量较少,在饲料混合过程中未充分搅拌均匀所致。对比育成期水貂相关试验发现,冬毛期水貂对蛋白质的消化吸收减少。研究表明,毛皮动物对脂肪消化率较其他动物高,最高时超过90%,且随饲粮脂肪水平的升高,脂肪消化率呈升高趋势[29]。荆祎等[9]报道,饲粮中添加植物乳杆菌和屎肠球菌对水貂的脂肪消化率有促进作用,且其脂肪消化率高于90%。本研究得到了相同的结果,各组脂肪消化率均高于90%,且添加枯草芽孢杆菌或粪肠球菌的各试验组的脂肪消化率显著高于对照组。
3.3 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂氮代谢的影响
动物饲粮中含氮物质进入机体后,部分未被消化吸收,随粪便排出;其他部分则被消化吸收,用于机体合成蛋白质,代谢产物则随尿液排出[30]。动物排泄物中的含氮物质会对土地和水源造成极大污染,是引起环境污染的源头之一[31]。本试验结果发现,饲粮中添加枯草芽孢杆菌或粪肠球菌后,粪氮和尿氮排出量呈现出降低的趋势,而净蛋白质利用率和蛋白质生物学价值呈现升高的趋势;此外,1×1010CFU/kg枯草芽孢杆菌组和1×109CFU/kg粪肠球菌组氮沉积显著高于对照组。上述结果说明添加枯草芽孢杆菌和粪肠球菌提高了蛋白质的利用率,降低了氮排放,提高了氮沉积。
3.4 饲粮中添加枯草芽孢杆菌或粪肠球菌对冬毛期水貂毛皮品质的影响
水貂是一种毛皮动物,其毛皮质量的高低决定了其经济价值,而水貂毛皮质量的高低与毛皮品质、皮张大小、皮张平齐度和皮张柔软度等有关[13]。朴厚坤等[32]指出,水貂体表面积与体重存在直线回归关系,冬毛期水貂体重越大所获得水貂皮张越大。本试验结果得出,饲粮中添加枯草芽孢杆菌或粪肠球菌后,水貂体重有所提升,且粪肠球菌添加量为1×109CFU/kg时体重较对照组显著升高;此外,各试验组水貂体长与对照组相比呈升高趋势。由此可以得出,各试验组水貂皮张大小要优于对照组。Gugolek等[33]研究发现,饲粮中添加粪肠球菌和嗜酸性乳杆菌可显著提高北极狐的毛皮品质(包括体长、颜色、光泽度和皮张大小等)。本试验结果发现,饲粮中添加1×1010CFU/kg枯草芽孢杆菌或1×109CFU/kg粪肠球菌时,针毛长与对照组无显著差异,但略高于其他试验组;1×1010CFU/kg枯草芽孢杆菌组绒毛长最高且显著高于1×108CFU/kg粪肠球菌组,同时其针绒比最低且显著低于1×108CFU/kg粪肠球菌组。针绒比越低,毛皮平齐度越高,1×1010CFU/kg枯草芽孢杆菌组绒毛长最高,针毛长也较长,同时其针绒比最低,表明该组水貂的毛皮平齐度是最高的。
4 结 论
饲粮中添加1×1010CFU/kg枯草芽孢杆菌或1×109CFU/kg粪肠球菌可提高水貂的生长性能、营养物质消化率、氮沉积和毛皮品质。
参考文献:
[1] FULLER R.Probiotics in man and animals[J].Journal of Applied Bacteriology,1989,66(5):365-378.
[2] NUNES R V,SCHERER C,POZZA P C,et al.Use of probiotics to replace antibiotics for broilers[J].Revista Brasileira de Zootecnia,2012,41(10):2219-2224.
[3] REID G,FRIENDSHIP R.Alternatives to antibiotic use:probiotics for the gut[J].Animal Biotechnology,2002,13(1):97-112.
[4] REID G.Probiotics to prevent the need for,and augment the use of,antibiotics[J].Canadian Journal of Infectious Diseases and Medical Microbiology,2006,17(5):291-295.
[5] HU Y L,DUN Y H,LI S N,et al.Effects ofBacillussubtilisKN-42 on growth performance,diarrhea and faecal bacterial flora of weaned piglets[J].Asian-Australasian Journal of Animal Sciences,2014,27(8):1131-1140.
[6] 刘江坤,芦春莲,李同洲,等.枯草芽孢杆菌(PB6株)制剂对断奶仔猪生产性能的影响[J].畜牧与兽医,2014,46(2):37-39.
[7] 侯璐.猪源粪肠球菌的特性及对仔猪生长性能和免疫力影响的研究[D].硕士学位论文.呼和浩特:内蒙古农业大学,2010.
[8] 贡筱.饲粮中添加枯草芽孢杆菌和粪肠球菌对蓝狐生产性能、消化代谢及免疫功能的影响[D].硕士学位论文.北京:中国农业科学院,2014.
[9] 荆祎,李光玉,刘晗璐,等.不同益生菌添加剂对水貂生长性能及血清生化指标的影响[J].经济动物学报,2013,17(3):140-145.
[10] NRC.Nutrient requirements of mink and foxes[S].Washington,D.C.:National Academy Press,1982.
[11] 张海华,张铁涛,刘晓颖,等.不同饲粮蛋白质和脂肪水平对育成期雄性水貂生长性能及血清生化指标的影响[J].动物营养学报,2016,28(10):3248-3255.
[12] SANDBØL P,CLAUSEN T,HEJLESEN C.Methionine and methyldonors for mink (Mustelavison) in the furring period[EB/OL].[2016-11-24]https://www.researchgate.net/publication/237793382_Methionine_and_Methyldonors_for_Mink_Mustela_vison_in_the_Furring_Period.
[13] WU X Z, LIU Z, ZHANG T T,et al.Effects of dietary copper on nutrient digestibility,tissular copper deposition and fur quality of growing-furring mink (Mustelavison)[J].Biological Trace Element Research,2014,158(2):166-175.
[14] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 6435—2006饲料中水分和其他挥发性物质含量的测定[S].北京:中国标准出版社,2007.
[15] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 6433—2006饲料中粗脂肪的测定[S].北京:中国标准出版社,2006.
[16] 国家技术监督局.GB/T 6432—1994饲料中粗蛋白测定方法[S].北京:中国标准出版社,1994.
[17] 中华人民共和国国家质量监督检验检疫总局.GB/T 6436—2002饲料中钙的测定[S].北京:中国标准出版社,2002.
[18] 中华人民共和国国家质量监督检验检疫总局.GB/T 6437—2002饲料中总磷的测定 分光光度法[S].北京:中国标准出版社,2002.
[19] 中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.124—2003食品中氨基酸的测定[S].北京:中国标准出版社,2003.
[20] 易维学.饲用粪肠球菌和枯草芽孢杆菌的体外评价研究[D].硕士学位论文.武汉:华中农业大学,2010.
[21] CUI C,SHEN C J,JIA G,et al.Effect of dietaryBacillussubtilison proportion of Bacteroidetes and Firmicutes in swine intestine and lipid metabolism[J].Genetics and Molecular Research,2013,12(12):1766-1776.
[22] 周映华,周小玲,吴胜莲,等.不同剂量枯草芽孢杆菌对断奶仔猪生产性能及腹泻的影响[J].饲料博览,2012(4):29-61.
[23] 乜豪,张铁涛,崔虎,等.饲粮中添加枯草芽孢杆菌或粪肠球菌对育成期水貂生长性能、营养物质消化率及氮代谢的影响[J].动物营养学报,2017,29(11):4003-4009.
[24] ROSS G R,GUSILS C,OLISZEWSKI R,et al.Effects of probiotic administration in swine[J].Journal of Bioscience and Bioengineering,2010,109(6):545-549.
[25] 史自涛.粪肠球菌对断奶仔猪的营养生理效应研究[D].硕士学位论文.重庆:西南大学,2015.
[26] 杨颖.日粮能量水平及来源对水貂生产性能和营养物质消化代谢的影响[D].硕士学位论文.北京:中国农业科学院,2013.
[27] GIANG H H,VIET T Q,OGLE B,et al.Effects of supplementation of probiotics on the performance,nutrient digestibility and faecal microflora in growing-finishing pigs[J].Asian-Australasian Journal of Animal Sciences,2011,24(5):655-661.
[28] 魏清甜.粪肠球菌替代饲用抗生素对保育仔猪生产、免疫、肠道发育及肠道微生物的影响[D].硕士学位论文.南京:南京农业大学,2014.
[29] 张婷,钟伟,李光玉.毛皮动物脂肪营养研究进展[C].中国毛皮动物科学研究进展——2014年全国毛皮动物专业学术研讨会论文集.北京:中国农学会,2014.
[30] AHMED I,KHAN M A.Dietary arginine requirement of fingerling Indian major carp,Cirrhinusmrigala(Hamilton)[J].Aquaculture Nutrition,2004,10(4):217-225.
[31] YANO F,王全军,王安.减少集约化生产动物排泄物中氮和磷的措施[J].国外畜牧科技,2000,27(3):11-14.
[32] 朴厚坤,张南荃.毛皮动物饲养学[M].长春:吉林农业大学出版社,1986.
[33] GUGOLEK A,LOREK M O,ROTKIEWICZ Z,et al.Effects of probiotic bacteria on the performance of arctic foxes,pathomorphology and microflora of their alimentary tracts[J].Czech Journal of Animal Science,2004,49(6):265-270.

