关于131I标记酪氨酸修饰的血管靶向肽GX1用于消化道肿瘤诊治的实验研究
曲士颖,王铁,黄京伟
(北京朝阳医院 核医学科,北京 100020)
胃肠道肿瘤是人类常见的一类恶性肿瘤,而且很多患者发现时就已处于肿瘤的进展期或晚期,加之目前的医疗技术尚缺乏有效的治疗对策,故死亡率很高。科学家们也因此在不断地探索更高效的新的诊断和治疗方法[1]。随着肿瘤生长依靠新生血管生成学说的出现,关于肿瘤新生血管抑制相关的治疗方法的研究也应运展开[2]。近年来放射性核素标记小分子多肽辅助肿瘤显影在肿瘤的诊断与治疗中悄然兴起,其中包括对治疗性放射性核素标记靶向性小肽或单抗进行放射治疗的方法[3]。放射性靶向治疗是其中的一种,即采用放射性核素标记配体做示踪剂,使之与高表达的受体或分子结合,可使肿瘤部位显影并可利用其放射效应对肿瘤细胞进行杀伤[4]。此外,将其与肿瘤导向治疗药物联合,可以达到增强肿瘤治疗疗效、降低身体其它部位药物毒性和不良反应的目的[5]。GX1短肽是一种新近筛选开发出的环状小肽,其氨基酸序列为CGNSNPKSC。大量的研究结果提示GX1在体内外都具有肿瘤血管内皮细胞靶向性,不失为一种新的肿瘤血管标记配体,可以联合其他抗肿瘤药物,在肿瘤的抗血管生成治疗领域大展身手[6]。本研究拟合成酪氨酸(Tyr)修饰的GX1短肽,探讨131I标记该修饰短肽(Tyr- GX1)标记消化道肿瘤的相关分子影像敏感性,为诊断以及进一步开发体外放射治疗研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 主要试剂包括:Tyr修饰GX1短肽:为上海吉尔生化公司合成并纯化;Iodogen包被管:按照J.M.Walker所述方法制备[7];Na131I溶液:为北京原子高科股份有限公司生产;单通道γ射线放射性测量仪:为西安志达科技有限公司生产;CRC- 15PET型活度计:为美国CAPINTEC公司生产;SPECT显像仪:为美国GE公司生产的Millennium Hawkeye VG型双探头SPECT显像仪。
1.1.2 实验动物 取雌性4~6周Balb/c裸鼠(上海邦耀生物科技有限公司)36只用于试验研究,于SPF清洁级环境喂养,符合动物实验质量标准。
1.1.3 细胞与试剂 人结肠癌细胞LOVO,人胃低分化腺癌细胞系SGC7901细胞(均由中科院上海细胞生物研究所提供),细胞培养使用RPMI- 1640培养液(Hyclone公司),胎牛血清购自上海翊圣生物科技有限公司。
1.2 实验方法
1.2.1 标记方法及放化纯测定 应用Iodogen碘标法标记Tyr- GX1短肽。在包被管中迅速按顺序依次加入Tyr- GX1短肽(10 μg·20 μl-1)、Na131I溶液(11.1 MBq),在pH 7.4的磷酸盐缓冲液控制反应体系体积40 μl,于室温静置完成标记。使用纸层析法测定标记产物的标记率和放射化学纯度,并计算比活度。丙酮(展开剂Ⅰ),氨水(展开剂Ⅱ)∶乙醇∶水按照1∶2∶5配制,131I- Tyr- GX1肽的Rf=0.0~0.1,游离131I的Rf=0.8~1.0。
1.2.2 标记率测定 测定其中131I放射性百分率:通过131I- Tyr- GX1肽于室温下分别与人血清、鼠血清、PBS等溶液混合,分别在0、6、12、24 h测定标记率。
1.2.3 细胞培养与动物模型的建立 肿瘤细胞常规培养于含10%胎牛血清的RPMI 1640培养液中,于37 ℃、5% CO2及饱和湿度的孵箱中培养,观察细胞生长并取对数生长期的细胞,用0.25%胰酶消化后培养基重悬收集离心细胞,洗涤后调整细胞密度用于转染实验动物制成荷结肠癌裸鼠、荷胃癌裸鼠等实验动物模型。具体方法:准备瘤源,将肿瘤组织放置在无菌生理盐水中,用无菌眼科剪剔除出血及坏死组织,分割成若干小块,每块直径约1 mm备用。麻醉裸鼠,消毒,腹腔注射4%水合氯醛0.1 ml·kg-1,裸鼠四肢紧张度明显降低,角膜反射迟钝,皮肤痛觉消失时完成麻醉,取仰卧位固定四肢,75%酒精消毒。将切好备用的肿瘤组织移植到裸鼠体内。
1.2.4 标记肽在荷瘤裸鼠体内的生物学分布 荷人胃癌移植瘤和结肠癌移植瘤裸鼠每种肿瘤设3只一组,共设6组,两种肿瘤模型合计裸鼠共36只。每只裸鼠通过尾静脉注射7.4 MBq·200 μl-1的131I- Tyr- GX1肽,于注射后不同时间点处死裸鼠,解剖并取其相关组织称重、测定放射性计数,经物理衰变校正后计算每克组织百分摄取率(%ID·g-1)和肿瘤与非肿瘤组织的放射性摄取比值(T/NT)。
1.2.5 荷瘤裸鼠体内SPECT显像 荷瘤裸鼠分别经尾静脉注射11.1 MBq·300 μl-1的131I- Tyr- GX1肽,于注射后不同时间点分别行裸鼠SPECT显像。利用ROI技术计算不同时相T/NT。
1.3 统计学处理
SPSS 17.0统计软件包用于相关数据的分析,统计分析采用卡方检验、t检验以及方差分析等所有统计学检验均为双侧检验,检验水准α=0.05,即P<0.05为差异具有统计学意义。
2 结 果
2.1 标记肽的标记率与稳定性
用直接标记法标记Tyr- GX1、GX1短肽,测定标记率在90%~97%范围,无需纯化,比活度也满足成像的需求。通过与生理盐水和EDTA、新鲜人血清以及半胱氨酸在一定条件下混合,观察24 h内标记率变化情况,未见各个混合溶液中标记率的明显变化,提示稳定性良好。详见表1。
表1标记率与稳定性情况分析
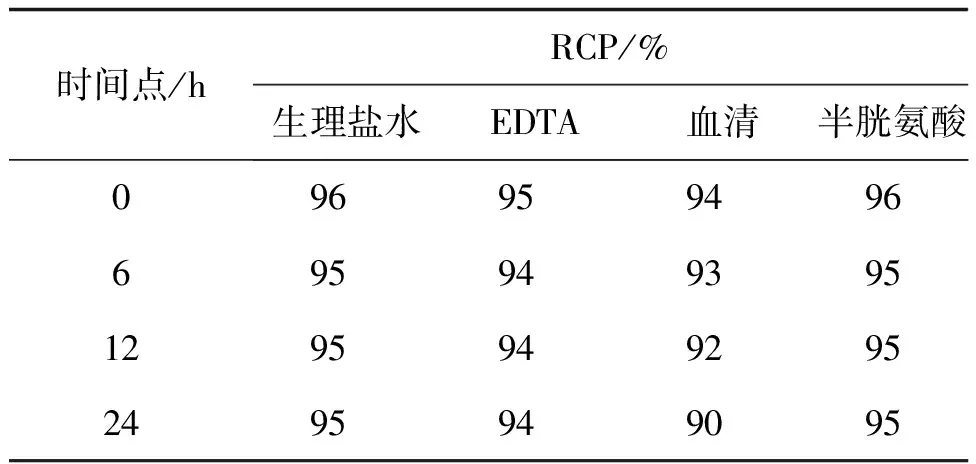
时间点/hRCP/%生理盐水EDTA血清半胱氨酸09695949669594939512959492952495949095
2.2 24 h显影结果分析
131I标记Tyr- GX1后经尾静脉注射入裸鼠体内,分析24 h显像等结果,探讨Tyr- GX1短肽的肿瘤血管靶向性等特征。本研究中荷胃癌动物Tyr- GX1组自8 h开 始,实验动物右后肢背侧荷瘤部位放射性浓聚灶高于心血池本底,随时间延长逐渐递增;肿瘤部位和心血池本底放射性比值随时间递增。荷结肠癌动物Tyr- GX1组也自8 h开始实验动物右后肢背侧荷瘤部位放射性浓聚灶高于心血池本底,随时间延长逐渐递增,到18 h达到高峰后略有下降;肿瘤部位和心血池本底放射性比值始终高于1。结肠癌组T/NT数值持续高于胃癌组。两种消化道肿瘤的浓聚及达到峰值时间各有特征。详见表2。
表2Tyr-GX1在胃癌与结肠癌成像中的T/NT水平
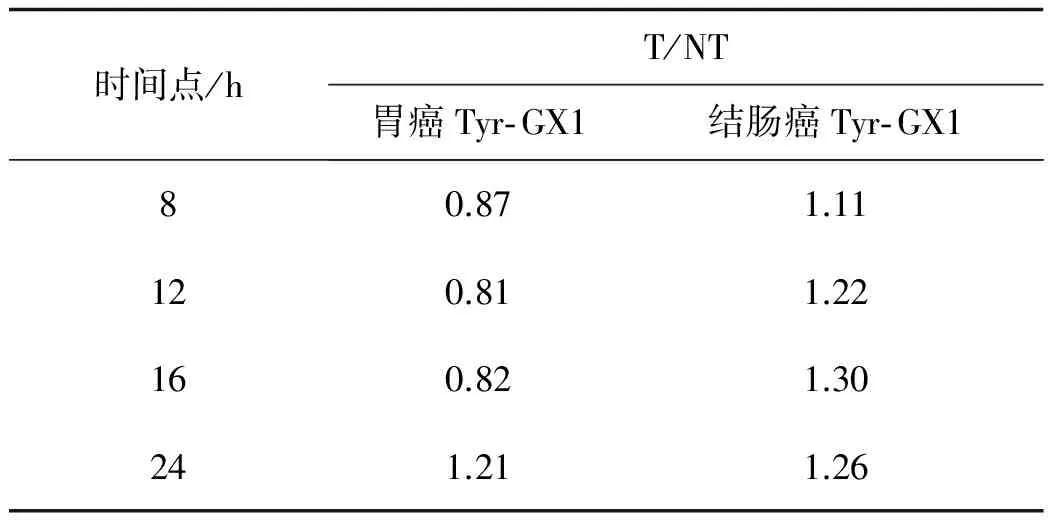
时间点/hT/NT胃癌Tyr⁃GX1结肠癌Tyr⁃GX180.871.11120.811.22160.821.30241.211.26
2.3 Tyr- GX1对肿瘤血管靶向性的情况
分批处死动物,分别取血、心、肝、肾等不同器官组织样本,称重后测量实验动物体内放射性计数(%ID·g-1)。计算公式:每克组织注射剂量分布(%ID·g-1)=各组织器官的放射性分布(cpm)/各组织器官的重量(g)/注射剂量。本研究中在荷胃癌和结肠癌组,示踪剂在各器官均显示出快速清除,其中肾脏的放射性较高,肿瘤组织的放射性也比较高,高于肌肉、肠、甲状腺和胃。在肝脏、肺脏以及血液中早期放射性浓聚较高,随时间延长逐渐下降,检测结果提示甲状腺的放射性含量在胃癌组和结肠癌组分别是0.08和0.10% ID·g-1。肿瘤组织的放射性在0.5 h分别为1.29和1.31% ID·g-1,24 h降为 0.55和0.42% ID·g-1,是肌肉组织的3~4倍。详见表3。
3 讨 论
放射性标记短肽成像的相关研究是近年来兴起的一门新的分支学科,为分子生物学与医学影像学结合的学科,更先进的造影剂增强剂不断出现,更先进的成像仪器设备不断发展,都推动了这个学科的发展,其中放射性核素成像就是一个方面,该领域主要关注肿瘤等疾病的先进诊断、监测和疗效评估方法[8]。目前核素标记抗体或者短肽已经成功地在多种肿瘤的显影诊断或治疗领域中得到了应用,因为不同核素具有各自独特的理化性质,此外它们的获得难易程度也不尽相同,加之价格等因素,目前临床中应用的核素包括18F、99Tcm还有131I等等[9]。
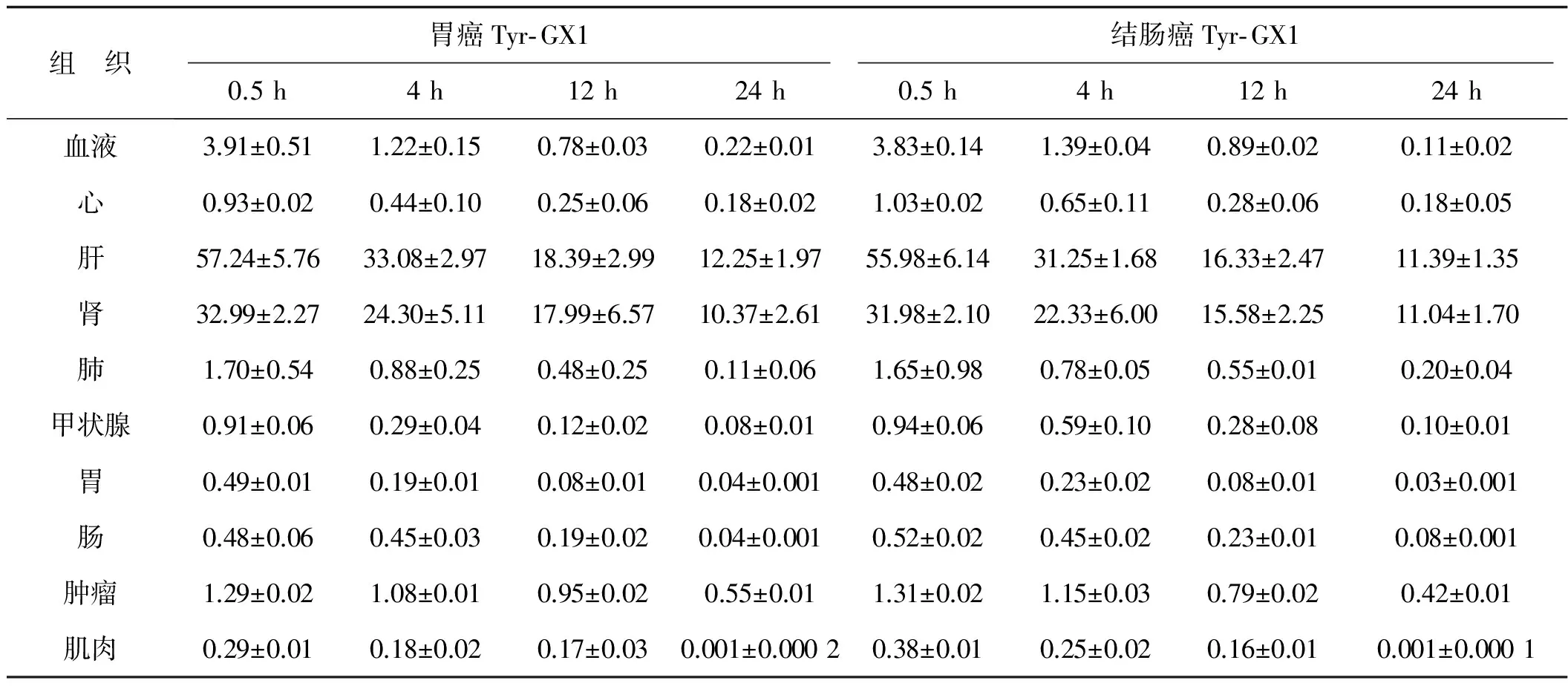
表3 Tyr- GX1在荷人源胃癌与结肠癌移植瘤动物体内生物学分布特征 %ID·g-1
消化道肿瘤在内的大多数恶性肿瘤在其生长以及转移等过程中会需要依赖新生血管的生成,新生的肿瘤血管内皮细胞在其细胞膜上存在的受体分子表达往往出现异常状态,科学家们则正是利用了这些肿瘤血管内皮细胞表面表达的特异性,不断在开发血管靶向治疗的新方法,比如很多已经应用于临床治疗的肿瘤血管抑制疗法、放射性靶向治疗等[10]。GX1短肽是一种新近筛选开发出的环状小肽,其氨基酸序列为CGNSNPKSC,大量的研究结果提示GX1在体内外都具有肿瘤血管内皮细胞靶向性,不失为一种新的肿瘤血管标记配体,可以联合其他抗肿瘤药物在肿瘤的抗血管生成治疗领域大展身手[11]。然而不同类型的肿瘤细胞表面及新生血管内皮细胞表达整合素受体的水平有很大差异,导致其对GX1短肽的摄取率也存在差异[12]。为此,采用局部修饰、多聚体化或连接耦合剂等方法增加配体与受体的结合力、改善药代动力学,提高肿瘤的摄取率;对多肽的化学修饰,加快其在正常组织中代谢清除,降低肝脏摄取和提高T/NT的数值[13]。因此本研究即在GX1短肽的环状二硫键外引入Tyr以后,对其进行生物学活性以及肿瘤靶向性等进行分析探讨,并使用放射性核素标记该修饰肽,进一步对结肠癌或胃癌的实验动物体内的生物学分布等情况进行探索。
本次研究结果提示,在荷胃癌和结肠癌组示踪剂在各器官均快速清除,肾脏的放射性较高,肿瘤组织的放射性也比较高。在肝脏、肺脏以及血液中早期放射性浓聚较高,24 h时检测结果提示甲状腺的放射性含量在胃癌组和结肠癌组分别是0.08和0.10% ID·g-1,随时间延长逐渐下降,提示标记物具有良好的体内稳定性。同时研究结果中还发现,肿瘤组织的放射性在0.5 h分别为1.29和1.31% ID·g-1,24 h降为0.55和0.42% ID·g-1,是肌肉组织的3~4倍。提示131I标记Tyr- GX1具有活体内肿瘤组织血管的靶向性。活体内肿瘤血管具有一定的靶向性,即生物分子进入人或动物体内后会不可避免地与内环境因素相关联,包括涉及到被相关酶类分解、出现特异性的代谢特征等,另外还能同体内一些分子结合而改变其原有的生物学行为。因此良好的肿瘤血管导向性分子应该以生物学稳定性为基础,以确保其可以快速从血液中得以清除,减少对正常血管的结合,同时提高靶组织结合率,为相关靶向治疗提供良好的基础[14- 15]。
总之,本研究提示131I标记Tyr- GX1具有良好的体内肿瘤血管靶向性,与肿瘤组织结合率较高,且两种消化道肿瘤的浓聚及达到峰值时间各有特征。
[参考文献]
[1] 陈晓宇,黄陈,裘正军.早期胃癌的治疗现状与进展[J].现代生物医学进展,2015,15(12):2352- 2354.
[2] 郭振英,曹伯良.血管内皮生长因子及相关促肿瘤血管生成分子及靶向治疗[J].中华病理学杂志,2010,39(4):282- 285.
[3] ZHI J L,CHI H C.Peptides as targeting probes against tumor vasculature for diagnosis and drug delivery[J].J Transl Med,2012,10(1):2386- 2398.
[4] 潘中允.放射性核素治疗学[M].北京:人民卫生出版社,2006:298- 304.
[5] AVRAM A M.Radioiodine scintigraphy with SPECT/CT:an important diagnostic tool for thyroid cancer staging and risk stratification[J].J Nucl Med Technol,2014,42(3):170- 180.
[6] 李明,殷继鹏,惠晓丽,等.131I标记Tyr- GX1在荷瘤裸鼠体内分布和显像研究[J].现代生物医学进展,2013,13(9):1601- 1604.
[7] WALKER J M.The protein protocols handbook[M].Totowa,NJ:Humana Press Inc,1996:673- 674.
[8] 高文,张东生,刘璐.放射性核素在肿瘤内照射治疗领域的应用进展[J].东南大学学报:医学版,2004,23(5):344- 346.
[9] 杨爱民,于燕,邓惠兴,等.99Tcm- HL91 和 18F-FDG显像与放疗关系的实验研究[J].国际放射医学核医学杂志,2011,35(4):217- 219.
[10] 向敏,朱玲,刘馨,等.抗肿瘤血管生成靶向治疗进展[J].现代肿瘤医学,2014,22(9):2237- 2240.
[11] 刘惊涛,惠晓丽,刘秦元,等.肿瘤血管内皮特异性靶向肽GX1与NGR在胃癌中显像差异分析[J].现代肿瘤医学,2014,22(4):729- 732.
[12] 方如塘,惠晓丽,殷继鹏,等.新生血管特异性结合肽GX1抑制小鼠视网膜新生血管生成的实验研究[J].陕西医学杂志,2012,41(10):1275- 1277.
[13] CHEN B,CAO S,ZHANG Y,et al.A novel peptide (GX1) homing to gastric cancer vasculature inhibits angiogenesis and cooperates with TNF alpha in anti- tumor therapy[J].BMC Cell Biol,2009,9(10):63.
[14] De OLIVEIR É A,FAINTUCH B L,TARGINO R C,et al.Evaluation of GX1 and RGD- GX1 peptides as new radiotracers for angiogenesis evaluation in experimental glioma models[J].Amino Acids,2016,48(3):821- 831.
[15] 惠晓丽,刘惊涛,刘洋,等.肿瘤血管内皮特异性靶向肽 GX1 在结肠癌与肺癌中显像差异分析[J].现代肿瘤医学,2015,23(13):1783- 1786.

