微小RNA-30b-3p在肝脏缺血再灌注损伤小鼠肝组织中的表达及意义
赵延兵,张 玮,苏瑜恒,李世朋,王 振
(1.焦作市人民医院普外科二区,河南 焦作 454002;2.新乡医学院第一临床学院肝脏疾病研究实验室,河南 卫辉 453100;3.天津市器官移植重点实验室,天津 300192)
肝脏缺血再灌注损伤(ischemia-reperfusion injury,IRI)多见于肝脏外科手术操作过程中[1],可直接影响术后患者的预后、手术成功率甚至生存率。寻找保护缺血肝细胞的关键靶点,减少IRI的发生,是亟待解决的临床课题[2]。微小RNA30b-3p(microRNA30b-3p,miR-30b-3p)是miR-30家族中重要一员,在多种病理生理过程中起到调控作用[3]。本课题组前期研究发现,miR-30b-5p可抑制肝细胞自噬活性而减轻肝脏IRI[4],miR-30b-3p与miR-30b-5p关系密切,但miR-30b-3p参与肝脏损伤与修复的研究尚未见报道。本研究通过观察miR-30b-3p在小鼠肝脏缺血再灌注中的表达及作用,旨在为肝脏IRI的防治提供新的理论依据。
1 材料与方法
1.1实验动物及分组无特定病原体级雄性健康C57BL/6小鼠40只,5~6周龄,体质量20~23 g,购自军事医学研究所动物供应中心,随机分为IRI组、假手术组、miRNA阴性对照(miRNA negative control,miR-NC)组和miR-30b-3p agomir组,每组10只。所有小鼠喂以标准饲料,自由摄食、饮水。
1.2主要试剂与仪器miR-30b-3p agomir、miR-NC购自广州锐博生物公司,兔源抗鼠一抗Bcl-2、Fas相关死亡域蛋白(Fas-associated with death domain protein,FADD)、Bax、Caspase-3、Cleave Caspase-3、β-actin、羊抗兔二抗购自美国Cell Signaling Technology公司,实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒、荧光脱氧核糖核苷酸末端转移酶介导的缺口末端标记法检测(terminal deoxynucleotidyl transferase dUTP nick end labeling,TUNEL)试剂盒购自德国Roche公司,miRNA专用提取试剂盒、miRNA专用反转录试剂盒、聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)、4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)、Tris-HCl-Tween缓冲盐溶液(Tris-HCl-Tween phosphate buffer saline,TBST)、放射免疫沉淀测定 (radioimmunoprecipitation assay,RIPA)裂解液、二辛可酸(bicinchoninic acid,BCA)蛋白测定试剂盒、氧化二氨基联苯胺(3,3′-diaminobenzidine,DAB)组织化学染色试剂套装均购自天津麦兰波公司;蛋白印迹电转系统购自美国Bio-Rad公司,qRT-PCR仪购自德国Roche公司,组织蜡块切片机购自德国Leica公司,G-BOX显影仪购自英国Syngene公司,TD-24K离心机购自湖南湘仪实验室仪器开发有限公司,BS-220全自动生物化学分析仪购自深圳迈瑞医疗国际股份有限公司。
1.3实验方法
1.3.1小鼠肝脏IRI模型制备各组小鼠建模前24 h禁食,不禁水;IRI组、miR-NC组及miR-30b-3p agomir组小鼠使用水合氯醛麻醉,从小鼠腹正中做切口,暴露腹腔脏器,用血管夹夹闭肝左、中叶脉管干(约占全肝2/3的肝脏缺血),缺血1 h后松开血管夹,完成后关腹,再灌注时间为12 h[5],miR-NC组和miR-30b-3p agomir组小鼠建立模型前24 h分别经尾静脉注射10 nmol·L-1的miR-NC[4]或miR-30b-3p agomir 0.3 mL;假手术组小鼠仅进行开腹及关腹等操作,不进行脉管夹闭。
1.3.2小鼠血清丙氨酸氨基转移酶(alanineaminotransferase,ALT)和天冬氨酸氨基转移酶(aspartictransaminase,AST)水平检测建模处理完成后处死小鼠,经下腔静脉取血1 mL,常温静置6 h,然后使用TD-24K离心机3 000 r·min-1离心15 min后取血清,采用BS-220全自动生物化学分析仪检测血清ALT、AST水平。
1.3.3苏木精-伊红(hematoxylin-eosin,HE)染色观察小鼠肝组织病理学变化取各组小鼠肝脏组织,采用体积分数4%中性甲醛溶液固定,梯度乙醇(体积分数70%、80%、90%、95%、100%)脱水,二甲苯透明,制作组织石蜡标本,并将肝脏石蜡标本进行连续切片,63 ℃烤片,然后脱蜡、水化,苏木精染色15 min,盐酸乙醇溶液分化5 s,氨水溶液返蓝 1 min,伊红染色5 min,然后脱水、透明、封片,在显微镜下观察并拍照。
1.3.4免疫组织化学法检测各组小鼠肝组织中Caspase-3表达将肝组织石蜡标本作连续切片,63 ℃烤片,然后脱蜡、水化、体积分数3%H2O2孵育 22 min,微波炉抗原修复12 min,然后自然缓慢冷却至室温。加一抗(Caspase-3),4 ℃下湿盒中孵育过夜。滴加含有二抗的工作液,显色试剂盒显色,然后复染、脱水、透明、封片,在显微镜下观察并拍照。采用Image J软件检测Caspase-3染色相对灰度值。
1.3.5荧光TUNEL法检测肝细胞凋亡石蜡切片常规脱蜡、水化,按照TUNEL操作说明处理切片,然后再滴加TUNEL反应混合液,37 ℃下避光湿盒孵育1 h。滴加DAPI溶液后在荧光显微镜下拍摄图片,采用Image J软件计算细胞核为红色的细胞所占百分率。
1.3.6qRT-PCR检测肝组织中miR-30b-3p表达使用miRNA专用提取试剂盒提取肝组织miRNA,然后进行反转录。采用嵌合荧光法行qRT-PCR,以U6为内参,miR-30b-3p上游引物序列为5′-GCTGCGGTGTAGACATCTAATAC-3′,下游引物序列为5′-ATCCAGTGCAGGGTCCGACG-3′;U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCAC-GAATTTGCGT-3′,按照qRT-PCR试剂盒说明书配置PCR体系,然后上机,测定循环阈值(cycle threshold,CT)。目的基因定量=2-△△CT,其中△△CT=△CT实验组-△CT对照组,△CT=CTmiR-30b-3p-CTU6。
1.3.7Westernblot检测小鼠肝组织中Bcl-2、FADD、Bax和CleaveCaspase-3蛋白的表达将新鲜的肝组织匀浆,RIPA裂解液裂解后收集各组细胞的总蛋白,采用BCA蛋白测定试剂盒测定总蛋白量。然后经电泳、转膜、封闭,加一抗(Bcl-2、FADD、Bax、Cleave Caspase-3与β-actin,稀释比例12 000),4 ℃环境下孵育过夜。TBST洗涤后,加二抗(13 500)室温孵育1 h,滴加化学发光液进行化学发光反应,在G-BOX仪下显影、拍照,然后利用Imag J软件检测各蛋白相对表达量。

2 结果
2.14组小鼠肝组织病理学变化假手术组小鼠肝脏组织学形态正常,无病理学改变(图1A);IRI组小鼠的肝组织中可见部分区域肝细胞水肿,甚至气球样变,中央静脉充血和点灶状坏死,且嗜中性粒细胞浸润较多(图1B)。miR-NC组小鼠肝组织中可观察到肝细胞水肿或气球样变,中央静脉充血和点灶状坏死,且嗜中性粒细胞浸润较多(图1C);miR-30b-3p agomir组小鼠肝组织中可观察到肝细胞水肿明显减轻,中央静脉无充血,点灶状坏死明显减少,无嗜中性粒细胞浸润(图1D)。

A:假手术组;B:IRI组;C:miR-NC组;D:miR-30b-3p agomir组。
图1各组小鼠肝组织病理学变化(HE染色,×400)
Fig.1Pathologicalchangesofthelivertissuesofmiceineachgroup(HEstaining,×400)
2.24组小鼠血清ALT、AST水平比较结果见表1。IRI组和miR-NC组小鼠血清ALT、AST水平显著高于假手术组,差异均有统计学意义(P<0.05);miR-30b-3p agomir组与假手术组小鼠血清ALT、AST水平比较差异无统计学意义(P>0.05);miR-30b-3p agomir组小鼠血清ALT、AST水平显著低于IRI组,差异有统计学意义(P<0.05);miR-NC组与IRI组小鼠血清ALT、AST水平比较差异无统计学意义(P>0.05);miR-30b-3p agomir组小鼠血清ALT、AST水平显著低于miR-NC组,差异有统计学意义(P<0.05)。
表14组小鼠血清ALT、AST水平比较


组别nALT/(U·L-1)AST/(U·L-1)假手术组1089.7±24.5108.0±33.4IRI组10365.8±68.9a478.5±98.7amiR-NC组10377.3±86.3a422.0±114.5amiR-30b-3pagomir组10113.3±75.6bc171.7±77.8bc
注:与假手术组比较aP<0.05;与IRI组比较bP<0.05;与miR-NC组比较cP<0.05。
2.34组小鼠肝组织中miR-30b-3p相对表达量比较假手术组、IRI组、miR-NC组和miR-30b-3p agomir组小鼠肝组织中miR-30b-3p相对表达量分别为9.6±2.3、3.3±1.6、4.5±2.8、12.7±2.5。与假手术组比较,IRI组、miR-NC组小鼠肝组织中miR-30b-3p相对表达量显著降低,miR-30b-3p agomir组小鼠肝组织中miR-30b-3p相对表达量显著升高,差异均有统计学意义(P<0.05)。miR-30b-3p agomir组小鼠肝组织中miR-30b-3p相对表达量显著高于IRI组,差异有统计学意义(P<0.05);miR-NC组与IRI组小鼠肝组织中miR-30b-3p相对表达量比较差异无统计学意义(P>0.05)。miR-30b-3p agomir组小鼠肝组织中miR-30b-3p相对表达量显著高于miR-NC组,差异有统计学意义(P<0.05)。
2.44组小鼠肝细胞凋亡率比较结果见图2。假手术组、IRI组、miR-NC组和miR-30b-3p agomir组小鼠肝细胞凋亡率分别为(10.3±6.6)%、(42.8±8.1)%、(40.5±7.3)%、(13.3±5.6)%。IRI组和miR-NC组小鼠肝细胞凋亡率显著高于假手术组,差异有统计学意义(P<0.05);miR-30b-3p agomir组与假手术组小鼠肝细胞凋亡率比较差异无统计学意义(P>0.05)。miR-30b-3p agomir组小鼠肝细胞凋亡率显著低于IRI组,差异有统计学意义(P<0.05);miR-NC组与IRI组小鼠肝细胞凋亡率比较差异无统计学意义(P>0.05)。miR-30b-3p agomir组小鼠肝细胞凋亡率显著低于miR-NC组,差异有统计学意义(P<0.05)。

A:假手术组;B:IRI组;C:miR-NC组;D:miR-30b-3p agomir组。
图24组小鼠肝细胞凋亡情况(TUNEL,×400)
Fig.2Hepatocyteapoptosisofmiceinthefourgroups(TUNEL,×400)
2.54组小鼠肝组织中Caspase-3相对表达量比较Caspase-3在肝细胞的细胞质内呈棕黄色,假手术组小鼠肝组织中Caspase-3阳性染色强度较弱(图3A),IRI组与miR-NC组小鼠肝组织Caspase-3 阳性染色强度较明显(图3B、3C),而miR-30b-3p agomir组小鼠肝组织中Caspase-3阳性染色强度较弱(图3D)。假手术组、IRI组、miR-NC组和miR-30b-3p agomir组小鼠肝组织中Caspase-3相对表达量分别为46.4±8.1、177.7±24.5、193.7±20.3、48.3±7.9。IRI组和miR-NC组小鼠肝组织中Caspase-3 相对表达量显著高于假手术组,差异有统计学意义(P<0.05);miR-30b-3p agomir组与假手术组小鼠肝组织中Caspase-3相对表达量比较差异无统计学意义(P>0.05)。miR-30b-3p agomir组小鼠肝组织中Caspase-3相对表达量显著低于IRI组,差异有统计学意义(P<0.05);miR-NC组与IRI组小鼠肝组织中Caspase-3相对表达量比较差异无统计学意义(P>0.05);miR-30b-3p agomir组小鼠肝组织中Caspase-3相对表达量显著低于miR-NC组,差异有统计学意义(P<0.05)。

A:假手术组;B:IRI组;C:miR-NC组;D:miR-30b-3p agomir组。
图34组小鼠肝组织中Caspase-3表达(免疫组织化学,×400)
Fig.3ExpressionofCaspase-3inlivertissuesofmiceinthefourgroups(immunohistochemistry,×400)
2.64组小鼠肝组织中Bcl-2、FADD、Bax和CleaveCaspase-3蛋白表达比较结果见图4和表2。与假手术组比较,IRI组、miR-NC组小鼠肝组织中FADD、Bax及Cleave Caspase-3蛋白相对表达量显著增加,Bcl-2蛋白相对表达量显著减少,差异均有统计学意义(P<0.05);miR-30b-3p agomir组与假手术组小鼠肝组织中FADD、Bax、Cleave Caspase-3及Bcl-2蛋白相对表达量比较差异无统计学意义(P>0.05)。与IRI组比较,miR-30b-3p agomir组小鼠肝组织中FADD、Bax及Cleave Caspase-3蛋白相对表达量显著降低,Bcl-2蛋白相对表达量显著增加,差异均有统计学意义(P<0.05);miR-NC组与IRI组小鼠肝组织中FADD、Bax、Cleave Caspase-3及Bcl-2蛋白相对表达量比较差异无统计学意义(P>0.05)。与miR-NC组比较,miR-30b-3p agomir组小鼠肝组织中FADD、Bax及Cleave Caspase-3蛋白相对表达量均显著降低,Bcl-2蛋白相对表达量显著增加,差异均有统计学意义(P<0.05)。
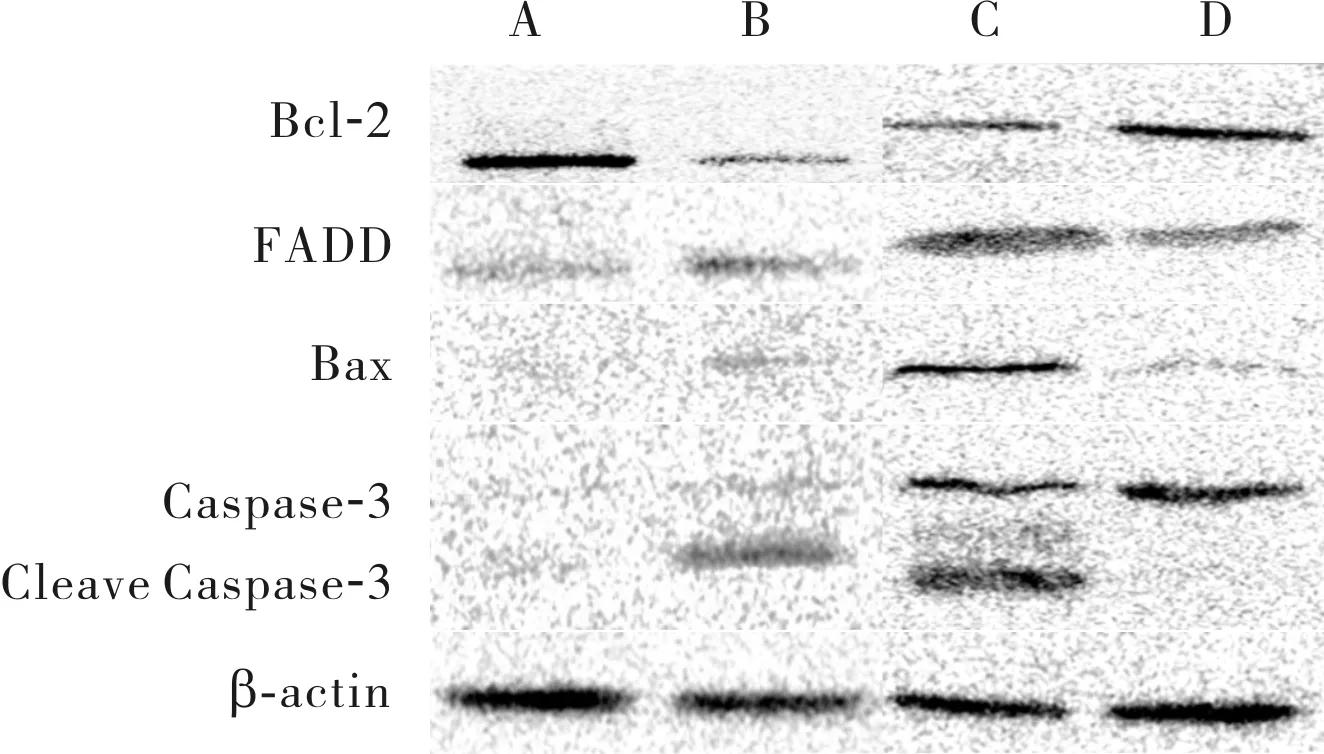
A:假手术组;B:IRI组;C:miR-NC组;D:miR-30b-3p agomir组。
图44组小鼠肝组织中Bcl-2、FADD、Bax及CleaveCaspase-3蛋白表达(Westernblot)
Fig.4ExpressionofBcl-2,FADD,BaxandCleaveCaspase-3proteininlivertissuesofmiceinthefourgroups(Westernblot)
表24组小鼠肝组织中FADD、Bax、CleaveCaspase-3及Bcl-2蛋白相对表达量比较


组别nFADDBaxCleaveCaspase-3Bcl-2假手术组100.73±0.210.24±0.090.15±0.081.76±0.32IRI组101.09±0.27a0.52±0.14a0.99±0.14a0.27±0.11amiR-NC组101.23±0.25a0.75±0.15a1.15±0.32a0.36±0.12amiR-30b-3pagomir组100.86±0.09bc0.25±0.07bc0.12±0.06bc0.66±0.08bc
注:与假手术组比较aP<0.05;与IRI组比较bP<0.05;与miR-NC组比较cP<0.05。
3 讨论
肝脏IRI主要发生于肝切除、肝移植与创伤过程中,是影响肝外科手术后预后的主要原因之一,而其产生的机制尚不清楚[6]。miRNA是一类内源性的序列较短且不参与RNA编码过程的小分子RNA,其作用模式是与其靶基因的信使RNA互补配对,从而抑制该信使RNA的翻译,是一类在基因的转录翻译中起转录后调节作用的非编码RNA,通过对靶基因进行转录后表达的调控,在生物的发育、繁殖、细胞分化凋亡、致病机制方面发挥重要作用[7-9]。近年有研究表明,miRNA有希望成为临床治疗的潜在新靶点[10]。miRNA并不能翻译成相应的多肽或蛋白质,而是在机体生理活动过程中起着多种调控作用,其与细胞增殖与凋亡、新陈代谢、组织损伤修复等过程的调控有密切关系[11-13]。研究显示,miRNA在不同器官组织缺血再灌注过程中的表达水平有显著差异[14],提示IRI的发生与miRNA水平变化存在一定关联。miR-30b-3p是miR-30家族中重要一员,其作用机制在肿瘤领域的研究报道较多,如抑制内源性miR-30b-3p和miR-30d-5p表达,可促进前列腺癌细胞生长[3]。而miR-30b-3p在肝脏IRI过程中的表达及作用尚未见报道。在本研究中,小鼠肝脏经缺血再灌注处理后,肝组织中出现嗜中性粒细胞浸润、肝细胞水肿,甚至出现坏死等病理改变,且小鼠血清ALT、AST水平均显著升高,表明缺血再灌注处理可使肝脏出现损伤;同时IRI组小鼠肝组织中miR-30b-3p相对表达量显著降低,而凋亡相关蛋白FADD、Bax及Cleave Caspase-3表达量显著增加,提示miR-30b-3p可能参与肝脏IRI过程。小鼠经miR-30b-3p agomir预处理后肝细胞水肿显著减轻,中央静脉无充血,点灶状坏死明显减少,无嗜中性粒细胞浸润,同时小鼠血清ALT、AST水平均显著下降,提示miR-30b-3p预处理可以减轻小鼠肝IRI。
肝细胞损伤后的恶性结局主要是坏死和凋亡。坏死其实是一种应对外部损伤时所引发的非程序性细胞死亡,可引发炎症反应;而细胞凋亡为I型程序性细胞死亡,是为维持内环境稳定,由基因控制的细胞自主的有序死亡。如肾IRI过程中,凋亡信号分子被激活,进而诱导肾脏细胞凋亡[15]。细胞凋亡调控的分子机制主要通过依赖Caspase的经典凋亡和非依赖性Caspase细胞程序性死亡2种形式[16]。在外在或内在因素作用下,Caspase依赖的细胞凋亡信号通路或自杀相关因子/自杀相关因子配体信号通路被激活,可进一步活化FADD、Caspase-8等下游分子[17];与此同时,抗凋亡相关蛋白Bcl-2亦参与了细胞凋亡过程[18],而Bax和Bcl-2蛋白平衡状态决定了细胞是否凋亡[19-20]。Bcl-2作为抗凋亡调控的主要分子,在调控细胞凋亡信号方面有举足轻重的作用[21]。当细胞受到内外因素刺激时,FADD蛋白激活无活性的Caspase-3 蛋白酶原,裂解成活性形式的Cleave Caspase-3蛋白酶,后者再作用于Caspase-7/8等,使它们发生逐级活化。Caspase酶被激活后,降解各自的多种死亡底物,调节Bax/Bcl-2蛋白平衡,引起DNA降解和细胞凋亡形态学改变,从而介导细胞凋亡过程[16]。本研究结果表明,与miR-NC组比较,miR-30b-3p agomir组小鼠肝细胞凋亡率下降,且小鼠肝组织中Caspase-3 表达量显著减少,提示miR-30b-3p预处理可抑制缺血再灌注处理诱导的小鼠肝组织中Caspase-3表达,同时FADD、Bax及Cleave Caspase-3蛋白表达量亦显著减少,而抗凋亡相关蛋白Bcl-2表达量显著增加,提示miR-30b-3p预处理可抑制诱导的Caspase-3凋亡通路活化,减少肝细胞凋亡,从而减轻小鼠肝IRI。
综上所述,肝脏经缺血再灌注处理后,肝组织中FADD蛋白表达增加,继而激活Caspase-3,并改变 Bax/Bcl-2蛋白平衡,从而介导肝细胞凋亡,最终导致肝损伤;而miR-30b-3p预处理可以抑制FADD/Caspase-3信号通路所介导的肝细胞凋亡,从而改善肝IRI。miR-30b-3p可作为保护缺血肝细胞的分子靶点。
参考文献:
[1] LIN Y Z,LU Z Y,LIANG X H,etal.Effect of breviscapine against hepatic ischemia reperfusion injury[J].JSurgRes,2016,203(2):268-274.
[2] COVINGTON S M,BAULER L D,TOLEDO-PEREYRA L H.Akt:a therapeutic target in hepatic ischemia-reperfusion injury[J].JInvestSurg,2017,30(1):47-55.
[3] KUMAR B,KHALEGHZADEGAN S,MEARS B,etal.Identification of miR-30b-3p and miR-30d-5p as direct regulators of androgen receptor signaling in prostate cancer by complementary functional microRNA library screening[J].Oncotarget,2016,7(45):72593-72607.
[4] LI S P,HE J D,WANG Z,etal.miR-30b inhibits autophagy to alleviate hepatic ischemia-reperfusion injury via decreasing the Atg12-Atg5 conjugate[J].WorldJGastroenterol,2016,22(18):4501-4514.
[5] 麻勇,汪大伟,刘连新,等.小鼠肝脏部分缺血再灌注损伤模型的建立[J].中华消化外科杂志,2013,12(9):703-707.
[6] 刘国岩,荚卫东,许戈良,等.肝脏缺血再灌注损伤的机制及防治进展[J].国际外科学杂志,2013,40(1):50-53.
[7] 刘云,周晓玉.微小RNA与肺发育及肺相关疾病的研究进展[J].中华实用儿科临床杂志,2015,30(22):1748-1750.
[8] THORBURN J,FRANKEL A E,THORBURN A.Regulation of HMGB1 release by autophagy[J].Autophagy,2009,5(2):247-249.
[9] 莫珍珍,周瑶,徐红,等.miRNA在哮喘小鼠肺组织及肥大细胞中的表达差异[J].中华实用儿科临床杂志,2015,30(21):1637-1639.
[10] ROZALSKI M,RUDNICKA L,SAMOCHOCKI Z.MiRNA in atopic dermatitis[J].PostepyDermatolAlergol,2016,33(3):157-162.
[11] 王来娣,郑云,蒋拾贝,等.miRNA在脂代谢中的研究进展[J].动物营养学报,2013,25(7):1446-1452.
[12] 郭臻,周宏灏,张伟.miRNA调控网络的遗传变异研究进展[J].中华医学遗传学杂志,2015,32(1):109-112.
[13] 祝烨,宋鑫.miRNA与lncRNA的相互调控作用在肿瘤中的研究进展[J].基础医学与临床,2015,35(11):1554-1558.
[14] ZHOU Y,CHEN Q,LEW K S,etal.Discovery of potential therapeutic miRNA targets in cardiac ischemia-reperfusion injury[J].JCardiovascPharmacolTher,2016,21(3):296-309.
[15] 金小雪,吕艳霞.肾脏缺血再灌注损伤及其修复与细胞凋亡的关系研究进展[J].中华器官移植杂志,2012,33(10):637-639.
[16] YANG Y,DU J,LIU F,etal.Role of caspase-3/E-cadherin in helicobacter pylori-induced apoptosis of gastric epithelial cells[J].Oncotarget,2017,8(35):59204-59216.
[17] KONG X,LUO J,XU T,etal.Plumbagin enhances TRAIL-induced apoptosis of human leukemic Kasumi1 cells through upregulation of TRAIL death receptor expression,activation of caspase-8 and inhibition of cFLIP[J].OncolRep,2017,37(6):3423-3432.
[18] KASAI S,SASAKI T,WATANABE A,etal.Bcl-2/Bcl-xL inhibitor ABT-737 sensitizes pancreatic ductal adenocarcinoma to paclitaxel-induced cell death[J].OncolLett,2017,14(1):903-908.
[19] YANG Z,GENG Y,YAO Z,etal.Spatiotemporal expression of Bcl-2/Bax and neural cell apoptosis in the developing lumbosacral spinal cord of rat fetuses with anorectal malformations[J].NeurochemRes,2017,42(11):3160-3169.
[20] 石景鹤,高静,王家勤.拉莫三嗪对癫痫大鼠学习记忆能力及海马组织中Bax和Bcl-2蛋白表达的影响[J].新乡医学院学报,2017,34(1):10-13.
[21] 赵学发,杨名慧,葛正龙.紫外线照射对SD大鼠晶状体上皮细胞p53、Bax、Bcl-2表达的影响[J].眼科新进展,2017,37(5):423-427.

