CRH介导妊娠期慢性应激致子代雄鼠抑郁
况 亮,吕逸丽,韩振敏,陈 鹏,姚余有,2,唐 伟
抑郁症是一种常见的心境障碍,实验研究[1]显示,抑郁的发病与下丘脑、杏仁核、大脑皮层和海马等部位异常有关。本课题组前期研究[2]显示,妊娠期慢性应激可引起子代雄鼠呈现抑郁症状,但其机制不明。促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)主要由下丘脑室旁核分泌,大脑皮层、杏仁核、海马等脑组织也表达一定量的CRH[3]。以往研究[2,4]显示高水平CRH可能与抑郁的发生有关,但CRH是否介导妊娠期慢性应激致抑郁尚不清楚。因此,该研究拟用妊娠期慢性不可预见性复合应激建立子代雄鼠抑郁模型,并用CRHR1拮抗剂(antalarmin)对子鼠进行干预,观察子代雄鼠抑郁程度并进一步探讨其作用机制。
1 材料与方法
1.1试剂与仪器antalarmin hydrochloride(美国Sigma公司);雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)单克隆抗体(美国Abcam公司);β-actin单克隆抗体、山羊抗兔二抗、化学发光检测试剂盒(上海碧云天生物技术有限公司);小鼠CRH酶联免疫试剂盒(武汉华美生物公司);电泳仪、凝胶成像分析系统(北京Tanon公司);强迫游泳图像采集及分析系统(上海欣软公司);旷场实验图像采集及分析系统(荷兰Noldus公司)。
1.2实验动物与分组8周龄SPF级小鼠,雌性40只,雄性10只,由安徽医科大学实验动物中心提供。遵循安徽医科大学生物医学伦理委员会动物饲养要求,室温为(23±1)℃,摄食饮水自由,50%的相对湿度,饲养1周。按照雌雄比例2 ∶1在晚上19:00合笼,第2天早上07:00前检查阴栓,查到阴栓的小鼠单独饲养,并标记为受孕第1天,并将孕鼠按2 ∶1随机分为慢性应激组和正常处理组。慢性应激组正常饲养1周,受孕第8天施加应激:束缚、禁水(24 h)、夹尾(5 min)、温水游泳(30 ℃,15 min)、禁食(24 h)、改变居住环境(让鼠在潮湿的垫料上生存24 h)、冰水游泳(4 ℃,5 min)等7种应激方式。小鼠每天随机接受一种应激方法(禁水、禁食除外),直至小鼠分娩。正常处理组正常饲养即可。子代雄鼠母乳喂养21 d断奶,随机分为三组(n=10):正常对照组(Control组)、产前应激+溶剂对照组(CPS组)、产前应激+CRHR1拮抗剂组(CPS+ANT组),CPS+ANT组子代雄鼠于产后21~41 d每天腹腔注射微量CRHR1拮抗剂[5](20 μg/g),CPS组和Control组注射等量的生理盐水。
1.3行为学实验
1.3.1旷场实验 每组随机选取8只子代雄鼠于产后45 d进行旷场实验,在实验的过程中确保实验室安静,旷场实验时将小鼠转移至试验箱的中央,于2 min后开始测试,记时3 min,记录小鼠爬行总路程、平均速度、穿越象限次数、站立次数。每结束一次实验,用酒精擦拭旷场实验箱并清理小鼠的粪便和尿液,待酒精挥发完,再换下一只小鼠进行实验。
1.3.2强迫游泳实验 每组随机选取8只子代雄鼠于产后47 d进行强迫游泳实验,第1天将三组小鼠置于装有25 ℃水的钢化玻璃桶中游泳15 min(水深30 cm,直径20 cm),一次实验只能用一只鼠,以免小鼠互相影响。第2天,随机将子代雄鼠放入装有水的钢化玻璃桶中(水深及温度与前1 d相同),录像、记录并观察小鼠6 min内后4 min小鼠在桶内禁止不动时间,即小鼠在水面漂浮不动或仅有四肢微小的动作维持身体平衡的时间。
1.3.3糖水偏好实验 每组随机选取4只子代雄鼠于产后50 d进行糖水偏好实验,小鼠单笼饲养在安静的鼠房内,每笼放置两个水瓶(大小、形状,颜色相同)。第一个24 h,两瓶都放置相同重量1%的蔗糖水,使小鼠适应蔗糖的甜味;第二个24 h,让小鼠适应两种不同甜味的饮用水,其中一瓶装有1%的蔗糖溶液,第二瓶装有相同体积的饮用水;第三个24 h,禁食禁水24 h,随后给予相同重量的蔗糖水和纯水进行糖水偏好实验,24 h后对两水瓶进行称重,计算糖水偏好率。
1.4HE染色观察病理形态学改变所有行为学实验结束后,随机选取5只小鼠,眼球取血,颈椎脱臼处死,在冰上取脑。用4%多聚甲醛将取下来的脑组织固定,然后脱水、包埋,最后于前囱后3 mm作6 μm的冠状切片。应用HE染色技术将每组相同位置的脑组织切片进行染色,每组取6张,在显微镜下观察海马CA3区神经元的形态变化,拍照保存。然后用Image-Pro Plus Image 软件计算出神经元的数目并求出平均值。
1.5Westernblot法检测海马组织mTOR的表达量冰上取脑结束后,将取出的全脑在冰上进行海马剥离,置于匀浆机中,提取总蛋白,应用BCA试剂盒测定海马组织蛋白的总浓度并定量,变性10 min。灌制8%的胶,每孔上样28 μg;电泳(60 V/50 min,120 V/300 min);转膜(200 mA/300 min);室温封闭1.5 h;洗膜3次;一抗4 ℃孵育24 h;洗膜3次,二抗室温孵育1.5 h;洗膜,滴加显影液,测量条带的光密度值。所用抗体浓度:一抗 β-actin(兔单抗,1 ∶2 000)、mTOR(兔单抗,1 ∶1 000),二抗(羊抗兔,1 ∶2 000)。
1.6ELISA法检测海马CRH水平用研磨机将海马研碎,按照说明书离心取海马组织上清液并测量海马组织CRH浓度。

2 结果
2.1CRHR1拮抗剂抑制妊娠期慢性应激致子代雄鼠抑郁与Control组相比,CPS组强迫游泳实验中小鼠不动时间增多(P<0.05);糖水偏好实验中糖水偏好率下降(P<0.05);旷场实验中鼠爬行总路程、平均速度、穿越象限次数、站立次数减少(P<0.05);与CPS组相比,CPS+ANT组强迫游泳实验中小鼠不动时间减少(P<0.05),糖水偏好率增高(P<0.05),旷场实验中鼠爬行总路程、平均速度、穿越象限次数、站立次数增加(P<0.05)。见表1。
2.2CRHR1拮抗剂改善妊娠期慢性应激所致的子代雄鼠海马CA3区神经元病理改变HE染色结果显示,Control组小鼠海马CA3区神经元染色清晰,数量相对较多,排列紧密,细胞核表现出圆形,核仁较明显;CPS组神经元排列疏松,数量相对较少,脱失现象明显,部分细胞核浓染、固缩。CPS+ANT组小鼠海马CA3区神经元染色清晰,数量较多,呈椎体状、圆球状,细胞核呈圆形,核仁明显。用Image-Pro PlusImage分析软件计数海马CA3区神经元总数,结果显示与Control组(173.000±8.888)相比,CPS组(85.667±8.737)神经元总数明显减少(P<0.05);与CPS组相比,CPS+ANT组(171.667±6.506)神经元总数明显增多(P<0.05)。见图1。
2.3CRHR1拮抗剂上调妊娠期慢性应激子代雄鼠海马下降的mTOR的表达Western blot结果显示,与Control组相比,CPS组小鼠海马组织mTOR表达量减少(P<0.05);与CPS组相比,CPS+ANT组小鼠海马组织的mTOR表达量增加(P<0.05);Control组与CPS+ANT组小鼠海马组织mTOR表达量差异无统计学意义。见图2。
2.4妊娠期慢性应激致子代雄鼠海马CRH水平升高ELISA法检测小鼠海马CRH结果显示,3组子代雄鼠海马CRH浓度差异有统计学意义,与Control组相比,CPS组子代雄鼠海马CRH水平升高(P<0.05);与CPS组相比,CPS+ANT组小鼠海马CRH水平降低(P<0.05),见图3。
3 讨论
CRH神经元处于HPA轴顶端、具有整合心理和物理刺激的功能,被公认为是应激反应的中枢驱动力[6]。CRH主要由下丘脑室旁核分泌,大脑皮层、海马、杏仁核等脑组织也表达一定量的CRH[7]。本研究结果显示,CPS组较Control组海马组织CRH浓度上升,说明妊娠期慢性应激可致子代海马组织CRH升高。
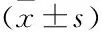
表1 CRHR1拮抗剂抑制妊娠期慢性应激致子代雄鼠抑郁
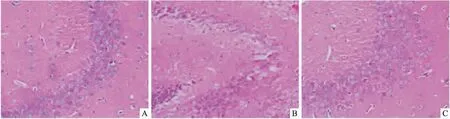
图1 CRHR1拮抗剂改善妊娠期慢性应激所致的子代雄鼠海马CA3区神经元 HE×40
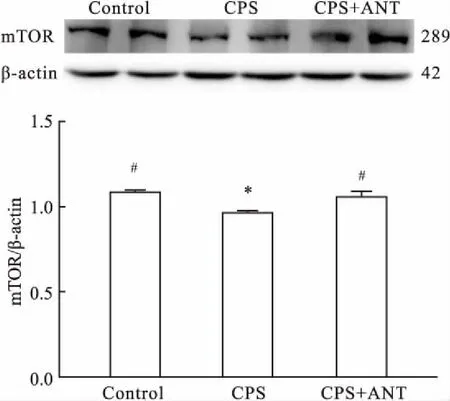
图2 CRHR1拮抗剂上调妊娠期慢性应激子代雄鼠海马下降的mTOR的表达量
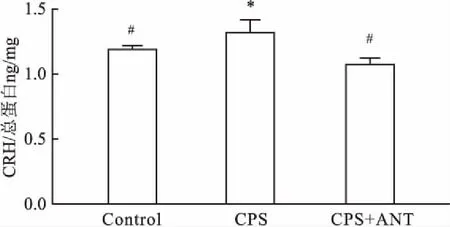
图3 妊娠期慢性应激致子代雄鼠海马CRH水平升高
强迫游泳实验、糖水偏好实验和旷场实验是目前测量小鼠抑郁程度的常用实验。实验很好的分析了小鼠的无助程度、对快感缺乏的程度和在新环境中的探索行为。本研究行为学实验显示CPS组子代雄鼠较Control组小鼠静止漂浮时间增多;糖水偏好实验中糖水偏好率下降;旷场实验中鼠爬行总路程、平均速度、穿越象限次数、站立次数减少。CPS+ANT组较CPS组小鼠静止漂浮时间减少,糖水偏好率上升,旷场实验中鼠爬行总路程、平均速度、穿越象限次数、站立次数增多。说明妊娠期慢性应激导致子代雄鼠行为学改变,使子代雄鼠产生抑郁样行为,CRHR1拮抗剂可逆转妊娠期慢性应激致子代雄鼠抑郁,提示CRH介导了妊娠期慢性应激致子代雄鼠抑郁。
实验研究[8-9]显示,海马部位异常与抑郁的发病有关,其中CA3区与抑郁的形成密切相关。因此该区神经元数目、形态结构和功能的改变必然会导致行为学的改变。本实验的海马CA3区HE染色结果显示,CPS组较Control组海马CA3区神经元数量明显减少,并且排列疏松紊乱,异常神经元明显增多,部分细胞核浓染、固缩,而CPS+ANT组较CPS组海马CA3区神经元染色清晰,数量较多,核浓染、固缩减少。说明CRHR1拮抗剂逆转妊娠期慢性应激致子代雄鼠海马CA3区神经元损伤,提示CRH致海马CA3区神经元损伤可能是妊娠期慢性应激致子代雄鼠抑郁的原因。
mTOR信号通路是调控细胞生长与增殖的一个关键通路,该通路将从营养分子、能量状态以及生长因子传来的信号整合在一起,从而调控生命过程。mTOR分为mTORC1 和mTORC2,mTORC1信号在调节神经元的存活和分化、树突的长度和分支、轴突的生长和突触的可塑性中发挥重要作用,同时也介导抑郁的发病[10-11]。本研究显示,CPS组较Control组海马mTOR明显下降,CPS+ANT组较CPS组海马mTOR明显上升并接近Control组水平。说明CRH受体拮抗剂可上调mTOR水平。提示妊娠期慢性应激通过升高的CRH下调mTOR的表达进而致子代雄鼠抑郁。
本研究结果还显示, CPS+ANT组较CPS组海马组织CRH浓度下降,提示CRHR1拮抗剂可以降低海马CRH水平,其机制是否与CRHR1拮抗剂下调糖皮质激素浓度有关尚不清楚,有待于进一步研究。
综上所述,CRH介导了妊娠期慢性应激致子代抑郁[12-13],其机制可能与妊娠期慢性应激致子代海马CRH升高,下调mTOR蛋白表达,进而引起海马 CA3 区神经元损伤有关。
参考文献
[1] Duman R S, Aghajanian G K. Synaptic dysfunction in depression: potential therapeutic targets.[J]Science, 2012, 338(6103): 68-72.
[2] 韩振敏, 况 亮, 王正玉, 等. 妊娠期慢性应激对不同性别子代抑郁的影响[J]. 安徽医科大学学报, 2017, 52(7): 998-1002.
[3] Ivy A S, Rex C S, Chen Y, et al. Hippocampal dysfunction and cognitive impairments provoked by chronic early-life stress involve excessive activation of CRH receptors[J]. J Neurosci, 2010, 30(39): 13005-15.
[4] Brunton P J. Effects of maternal exposure to social stress during pregnancy: consequences for mother and offspring[J]. Reproduction, 2013, 146(5): R175-89
[5] Liu R, Yang X D, Liao X M, et al. Early postnatal stress suppresses the developmental trajectory of hippocampal pyramidal neurons: the role of CRHR1[J]. Brain Struct Funct, 2016, 221(9): 4525-36.
[6] Galesi F L, Ayanwuyi L O, Mijares M G, et al. Role of Hypothalamic-Pituitary-Adrenal axis and corticotropin-releasing factor stress system on cue-induced relapse to alcohol seeking[J]. Eur J Pharmacol, 2016, 788: 84-9.
[7] Maras P M, Baram T Z. Sculpting the hippocampus from within: stress, spines, and CRH[J]. Trends Neurosci, 2012, 35(5): 315-24.
[8] Morales-Medina J C, Iannitti T, Freeman A, et al. The olfactory bulbectomized rat as a model of depression: The hippocampal pathway[J]. Behav Brain Res, 2017, 317: 562-75.
[9] Gilbert P E, Brushfield A M. The role of the CA3 hippocampal subregion in spatial memory: a process oriented behavioral assessment[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2009, 33(5): 774-81.
[10] Child N D, Benarroch E E. mTOR: its role in the nervous system and involvement in neurologic disease[J]. Neurology, 2014, 83(17): 1562-72.
[11] Li N, Lee B, Liu R J, et al. mTOR-dependent synapse formation underlies the rapid antidepressant effects of NMDA antagonists[J]. Science, 2010, 329(5994): 959-64.
[12] Chen Y, Dube C M, Rice C J, et al. Rapid loss of dendritic spines after stress involves derangement of spine dynamics by corticotropin-releasing hormone[J]. J Neurosci, 2008, 28(11): 2903-11.
[13] Erhardt A, Muller M B, Rodel A, et al. Consequences of chronic social stress on behaviour and vasopressin gene expression in the PVN of DBA/2OlaHsd mice-influence of treatment with the CRHR1-antagonist R121919/NBI 30775[J]. J Psychopharmacol, 2009, 23(1): 31-9.

