黄河下游典型水库浮游植物群落结构及其与环境因子的关系
侯 伟, 陈 燕, 孙韶华, 李 祥, 李 伟, 胡 芳, 赵清华, 贾瑞宝
(山东省城市供排水监测中心, 山东 济南 250021)
1 研究背景
浮游植物作为水生态系统的主要初级生产者之一,是物质传递和能量流动的基础,对维持水生态系统健康有重要作用[1-2]。由于其生长周期短,对环境变化敏感,其数量及群落结构可很好地反映水质状况。因此,对水体中浮游植物群落结构的研究是了解其生态系统结构和功能的基础。反之,环境条件的变化也可直接或间接影响浮游植物群落结构[3]。浮游植物的种类组成及数量分布通常呈季节性变化[4-5],尤其在四季分明的温带地区[6-7]。此外,浮游植物群落结构是判断水体富营养化程度的重要指标[8-9]。在不同营养状态水体中,浮游植物的种类组成和数量变化有明显差异;富营养化水体通常以蓝藻为优势类群[10-11],而中营养水体的浮游植物群落则具多样性[12-13]。韩博平[3]在广东大中型水库开展了浮游植物群落及富营养化的调研,指出多数水库为中-富营养状态,浮游植物种群常年以蓝藻门为优势类群。在我国热带、亚热带水库中,影响浮游植物群落结构的主要因素有透明度、氮、磷、悬浮物等[4-6],而在中国北方,由于水温、光照季节变化明显,化学需氧量、水温、热分层、降雨量、水量等是影响浮游植物群落结构的主要环境因子[7-9]。
济南位于黄河下游地区,水库承担了该市75%的城市用水,为保障工农业生产和生活饮用水发挥着关键作用。按水源类型划分,该市水库主要包括山区水库和引黄水库[10]。黄河下游山区水库由自然降雨和地表径流汇集而成;引黄水库的水源来自黄河,黄河水经过引黄闸提取、清污和沉沙后进入水库,流域内的地表径流不直接排入水库。两种水库由于水源、水文及水动力过程的差异,其营养状态及生态系统的结构可能存在一定差异。目前,有关山区与引黄水库的浮游植物群落结构及其影响因子研究较少,仅侯翠荣[11]对两座山区和引黄水库的浮游植物种类组成进行过调研,但没有对两种类型水库的浮游植物群落结构动态进行比较分析。为弥补对黄河下游典型水库浮游植物群落结构研究的不足,本研究于2012年9月至2013年8月对黄河下游的山区(卧虎山、锦绣川)和引黄(鹊山、玉清)水库的水质及浮游植物群落结构进行了调查研究,关注浮游植物群落结构在该区域典型水库中的时空变化及其与环境因子的关系,旨在从浮游植物群落结构的角度发现山区与引黄两种典型供水水库间的生态差异,为评估黄河下游地区不同水源类型的水库水质及其生态环境提供基础数据和参考。
2 材料与方法
2.1 区域概况
以济南市卧虎山(E116°57′N36°29′)、锦绣川(E117°10′N36°30′)、鹊山(E116°57′N36°46′)和玉清(E116°59′N36°40′)水库为调查对象(图1),该4座水库均处于黄河中下游地区(图1)。其中,卧虎山和锦绣川水库为山区水库,分别属天然蓄水的大型和中型水库,库容分别为11 700×104m3和2 414×104m3,流域面积较大,分别为557和166 km2。鹊山和玉清为中型引黄水库,库容分别为4 600×104m3和4 850×104m3。4座水库建库时间较晚,在1988至2000年间。

图1 卧虎山、锦绣川、鹊山和玉清水库的地理位置及主要河流示意图
2.2 采样方法与样品处理

2.3 数据处理
采用SPSS 16.0软件进行方差(One-way ANOVA)分析、主成分分析(PCA)及相关分析。
3 结果分析
3.1 水库环境参数

水中Chl a浓度能够反映浮游植物生物量的高低,体现了水体初级生产力和富营养化水平。采样期间,卧虎山水库的Chl a浓度显著高于其他3座水库,平均为32.0 μg/L;锦绣川水库的最低,均值仅为6.0 μg/L;鹊山和玉清水库的Chl a浓度居中,分别为12.1和11.9 μg/L。

表1 4座水库环境参数的均值(最小值~最大值)
注:不同的字母表示有显著差异(One-way ANOVA,P<0.05)
3.2 浮游植物群落组成特征
本文调查期间,共检出浮游植物55种,其中绿藻门(Chlorophyta)种类最多,有23种,蓝藻门(Cyanophyta)13种,硅藻门(Bacillariophyta)17种,金藻门(Chrysophyta)2种。卧虎山、锦绣川、鹊山和玉清水库的浮游植物种类数相近,分别为37、36、34和29种。图2为水库浮游植物种类组成。4座水库均以绿藻门种类数最多,其次是蓝藻、硅藻,金藻门种类最少;锦绣川水库中硅藻门类群比蓝藻多。4座水库中常见的属有:脆杆藻属(Fragilaria Lyngbye)、浮丝藻属(Planktonema)、小环藻属(Cyclotella)、小球藻属(Chlorella)。

图2 4座水库的浮游植物种类组成
采样期间,鹊山和卧虎山水库浮游植物丰度显著高于其他2座水库(One-way ANOVA,p<0.05),平均分别为1 398×104和1 381×104cells/L;玉清水库为1 111×104cells/L,锦绣川水库浮游植物丰度最低(378×104cells/L)(图3)。各水库浮游植物丰度季节差异较大,但基本以蓝藻门、硅藻门为主要类群,其中卧虎山、鹊山和玉清3座水库蓝藻门丰度范围分别为56×104~1 481×104、11×104~3 198×104、10×104~2 431×104cells/L,硅藻门丰度范围分别为27×104~1 741×104、18×104~3 500×104、13×104~2 341×104cells/L,两个门类浮游植物丰度较高的时间多为枯水期(图3)。 时间上,2013年卧虎山水库的浮游植物丰度明显低于2012年,仅在4月份由于较高的蓝藻丰度有峰值(图3(a)),锦绣川水库浮游植物丰度较小且全年变化不大(图3(b))。2座引黄水库浮游植物丰度的季节变化相似,均呈现丰水期高于其他季节的趋势(图3(c)、3(d))。
3.3 浮游植物群落结构与环境因子的关系
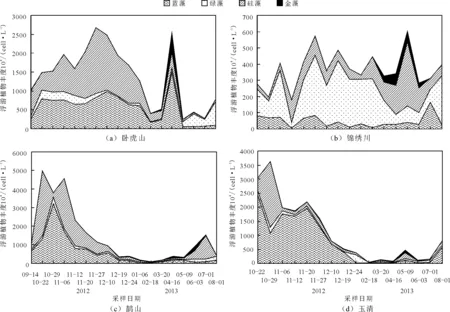
图3 2012-2013年采样期间卧虎山、锦绣川、鹊山和玉清水库浮游植物丰度
浮游植物的生长往往受到诸多环境因子的影响,但营养盐的可获得性一般被认为是影响浮游植物生物量的主要因素[13]。本研究中,Spearman相关分析结果显示,浮游植物丰度与TP、TN∶TP极显著相关(P<0.01)(表2);而与N的相关性却不显著,表明磷可能是浮游植物生长的首要限制性营养盐。此外,浮游植物丰度与Chl a、SD、TOC极显著相关(表2),表明浮游植物可能是水库总有机碳和Chl a的主要贡献者,其生长影响了水体透光率。
将山区和引黄水库的浮游植物丰度分别与环境因子进行回归拟合。结果显示,引黄水库的浮游植物与环境因子的关系更加密切(图4(a)~4(d))。除Chl a、TOC、SD和TN∶TP(质量比)外,山区水库浮游植物丰度还与TP显著相关(r=0.519,p<0.01),而引黄水库的则与水温关系密切(r=0.611,p<0.01),表明山区和引黄水库浮游植物生长除与光辐射和氮磷比有关外,还分别受到磷含量和水温的影响。

表2 4座水库浮游植物细胞丰度与环境因子Spearman相关关系
注:*表示显著相关(p<0.05,2-tailed) **表示极显著相关(p<0.01,2-tailed)。

图4 山区和引黄水库浮游植物丰度与Chl a、TOC、SD和TN∶TP(质量比)的相关性分析
将上述理化及生物变量进行KMO and Bartlett's 检验,结果为0.705,表明现有数据较适合做主成分分析。特征值大于1的主成分共有4个,第一主成分特征值为5.789,贡献率为35.41%;第二主成分特征值为3.328,贡献率为23.14%;第三主成分特征值为2.183,贡献率为21.15%;第四主成分特征值和贡献率分别为1.343和10.62%;4个主成分累计贡献率为90.31%。表3为4个主成分的载荷矩阵。
根据因子的载荷及特征值计算每个主成分的因子系数,结果如下:





表3 因子载荷矩阵

4 讨 论
浮游植物是水生态系统的重要部分,作为物质代谢和能量循环的初级生产者,对维持生态平衡有重要作用,也是反映水体富营养化程度的主要指标。自然水体中,影响浮游植物群落结构的因子是多方面的,包括营养状态[4,14]、水温[14-15]、风力[16]、光辐射[17]等。浮游植物种类组成与水体营养状态关系密切,通常营养水平低的水体中浮游植物种类更具多样性,本研究中,贫-中营养的锦绣川水库浮游植物种类较多。卧虎山水库同时具有较高的营养状态指数(TLI)和浮游植物种类数,这可能是因为卧虎山水库由锦绣川和锦云川、锦阳川3座水库的水源汇合而成,多个水源引起卧虎山水库浮游植物种类具有多样性;水源相同的2座引黄水库的浮游植物种类数相近,表明山区和引黄水库浮游植物的种类组成不仅与营养状态有关,还与水体来源及类型有密切关系。
相关分析结果显示,山区和引黄水库浮游植物均受到透明度和氮磷比的影响。本研究中4座水库的透明度较低,尤其是卧虎山、鹊山和玉清水库,年均在1.1~1.3 m。较低的光辐射条件不仅影响了浮游植物数量,还改变了浮游植物种类组成,卧虎山、鹊山和玉清水库通常以蓝藻为优势类群(图3)。这是因为低光环境可能会改变浮游植物与营养盐之间的作用,Zhang等[18]指出水下的有效光线低于250 μmol/(m2·s)时蓝藻可能成为优势类群。透明度与浮游植物丰度的关系也反映了在中营养、中-富营养水库中,光辐射是影响浮游植物群落结构的关键因子。这与侯伟等[4]、黄成等[5]在对亚热带水库浮游植物种群研究中得出的结论一致。本研究中,氮磷比是影响4座水库浮游植物生长的另一个环境因素,4座水库TP浓度基本处于0.01~0.03 mg/L,即在低营养状态下,氮磷比可能成为浮游植物生长的限制因子。在我国北方地区,由于对农业化肥的大量使用,地表径流带入大量含磷污染废水,导致水体磷元素含量升高。由于磷肥中含有溶解性磷酸盐,可被浮游植物直接吸收利用转化为细胞内磷,从而使水中磷元素含量增加,进而引起浮游植物生物量的增加。Masson等[19]同样在美国魁北克北部27个冰川湖泊中发现藻类生物量与总磷有极显著的正相关关系。国内外诸多研究关注了氮磷比对浮游植物生长的影响,焦立新等[20]研究表明云南洱海的浮游植物生物量年内变化受m(N)/m(P)的影响,而日变化则主要受ρ(TP)的影响。吴世凯等[21]发现当水中TP<0.035 mg/L时,浮游植物生物量与氮磷比呈显著负相关。两种类型水库浮游植物生长的不同点在于山区与引黄水库浮游植物丰度还分别受到TP和水温的影响。山区与引黄水库的磷含量虽无显著差异,但山区水库氮磷比显著高于引黄水库(表1),使得磷成为浮游植物生长的限制因子。而在引黄水库,水温成为浮游植物生长的主要限制因子。水温和营养盐尤其是磷含量对浮游植物群落生长的影响已被很多研究揭示。Arhonditsis等[22]和Hudzik等[23]在研究中都发现总磷、透明度和水温等是影响浮游植物群落结构的重要环境因子。除主要的环境因子以外,水源(锦阳川和锦云川水库、黄河)的浮游植物群落结构及浮游动物的上-下行效应可能也在一定程度上影响了水库内浮游植物群落结构,需要进行进一步的深入研究。
5 结 论
本文通过对黄河下游地区2类4座典型水库水质调研,开展了浮游植物群落结构动态变化及其与环境因子关系的研究,得出以主要下结论:
(1)采样期间,共检出浮游植物55种,其中绿藻门种类最多;4座水库中常见的属有:脆杆藻属(Fragilaria Lyngbye)、浮丝藻属(Planktonema)、小环藻属(Cyclotella)、小球藻属(Chlorella)。浮游植物丰度空间差异较大,波动范围为27×104~4 971×104cells/L;时间上,丰水期丰度高于其他两个时期。
(2)两种类型水库浮游植物群落结构的差异与水体来源及类型有密切关系,山区和引黄水库浮游植物丰度分别受TP、水温的限制。统计分析结果表明,离子类型、水体营养水平及氮磷组成、水温对氮循环过程的影响等因素直接或间接地影响了4座水库浮游植物的群落结构。
参考文献:
[1] HARRIS G P. Phytoplankton Ecology[M]. Springer Netherlands, 1986.
[2] SALMASO N, NASELLI-FLORES L, PADISK J. Functional classifications and their application in phytoplankton ecology[J]. Freshwater Biology, 2015,60(4):603-619.
[3] 韩博平. 广东省大中型水库富营养化现状与防治对策研究[M].北京:科学出版社, 2003.
[4] 侯 伟, 黄 成, 江启明 等. 粤北三座典型中型水库富营养化与浮游植物群落特征[J]. 生态环境学报, 2011,20(5):913-919.
[5] 黄 成, 侯 伟, 顾继光 等. 珠江三角洲城市周边典型中小型水库富营养化与蓝藻种群动态[J]. 应用与环境生物学报, 2011,17(3):295-302.
[6] 江启明, 侯 伟, 顾继光 等. 广州市典型中小型水库营养状态与蓝藻种群特征[J]. 生态环境学报, 2010,19(10):2461-2467.
[7] 薛俊增, 方 伟, 蔡 桢 等. 乌伦古河流域克孜赛水库浮游植物群落组成[J]. 生物学杂志, 2011,28(1):62-65.
[8] 黄廷林, 曾明正, 邱晓鹏 等. 温带季节性分层水库浮游植物功能类群的时空演替[J]. 中国环境科学, 2016,36(4):1157-1166.
[9] 卞少伟, 于洪贤, 马成学 等. 桃山水库浮游植物群落结构及水质营养状态评价[J]. 水生态学杂志, 2012,33(1):53-57.
[10] 侯 伟, 孙韶华, 贾瑞宝. 中国北方山区水库与引黄水库富营养化特征[J]. 中国环境监测, 2016,32(2):58-63.
[11] 侯翠荣. 高藻高有机污染水源水处理技术研究[D].济南:山东大学, 2008.
[12] 国家环境保护总局《水和废水监测分析方法》编委会. 水和废水监测分析方法:第四版[M]. 北京:中国环境科学出版社, 2002.
[13] SEVERIANO J D S, MELOMAGALHES E M D, MOURA A D N. Effects of zooplankton and nutrients on phytoplankton:an experimental analysis in a eutrophic tropical reservoir[J]. Marine & Freshwater Research, 2016,68(6):1061-1069.
[14] YANG Yang, PETTERSSON K, PADISK J. Repetitive baselines of phytoplankton succession in an unstably stratified temperate lake (Lake Erken, Sweden):a long-term analysis[J]. Hydrobiologia, 2016,764(1):211-227.
[15] IACHETTI C M, LLAMES M E. Light limitation helps stabilize the phytoplankton assemblage steady-state in a temperate and highly turbid, hypertrophic shallow lake (Laguna Chascomús, Argentina)[J]. Hydrobiologia, 2015,752(1):33-46.
[16] 杨 婷. 气象因子与太湖蓝藻水华的响应关系研究[D].南京:南京信息工程大学, 2012.
[17] DUBOURG P, NORTH R L, HUNTER K, et al. Light and nutrient co-limitation of phytoplankton communities in a large reservoir:Lake Diefenbaker, Saskatchewan, Canada[J]. Journal of Great Lakes Research, 2015,41:129-143.
[18] ZHANG Min, YU Yang, YANG Zhen, et al. The distribution of phytoplankton along trophic gradients and its medi. [J]. Journal Canadien Des Sciences Halieutiques Et Aquatiques, 2012, 69(2):348-348.
[19] MASSON S, PINEL-ALLOUL B, SMITH V H. Total phosphorus-chlorophyll a size fraction relationships in southern Québec lakes[J]. Limnology & Oceanography, 2000,45(3):732-740.
[20] 焦立新, 赵海超, 王圣瑞 等. 洱海水体氮磷时空分布及其对ρ(Chla)的影响[J]. 环境科学研究, 2013,26(5):527-533.
[21] 吴世凯,谢 平,王松波,等.长江中下游地区浅水湖泊群中无机氮和TN/TP变化的模式及生物调控机制[J].中国科学(D辑),2005,35(z2):111-120.
[22] ARHONDITSIS G B, WINDER M, BRETT M T, et al. Patterns and mechanisms of phytoplankton variability in Lake Washington (USA)[J]. Water Research, 2004,38(18):4013-4027.