凡纳滨对虾急性肝胰腺坏死综合征研究进展
蒋 葛,沈 辉,万夕和*,乔 毅
(1.江苏省海洋水产研究所,江苏南通 226007;2.上海海洋大学水产与生命学院,上海 201306)
急性肝胰腺坏死综合征(Acute hepatopancreas necrosis syndrome,AHPNS)是近年来影响对虾养殖最为严重的疾病之一。早期该病主要发生于对虾苗期,也被称为早期死亡综合征(Early mortality syndrome,EMS)。该病的肝胰腺坏死症状与对虾其他早期死亡症状明显不同,联合国粮农组织和亚太地区水产养殖联盟(NACA)将之命名为急性肝胰腺坏死综合征(Acute hepatopancreas necrosis syndrome,AHPNS)。
1 凡纳滨对虾AHPNS流行病学
2009年,AHPNS首先在我国海南省暴发,越南、马来西亚、泰国、菲律宾相继暴发该病[1-2]。2011年,越南受该病影响区域超过68%;我国福建、广东及广西等省份因AHPNS病情影响,凡纳滨对虾产量下降80%以上;2012年,泰国凡纳滨对虾产量也因该病影响而减半[3]。2013年,太平洋东岸的墨西哥西北部地区也受到该病的影响[4]。我国华东、华北地区凡纳滨对虾主产地关于AHPNS的相关报道较少,影响程度相对低于华南地区。
凡纳滨对虾发生AHPNS后体色发白,虾壳变软,摄食明显减少,活力减弱,行动迟缓,少数对虾体表出现黑斑;肝胰腺颜色暗淡苍白或糜烂发红,部分对虾的肝胰腺明显萎缩或者异常肥大,空肠空胃。苗种投放10 d就可发病死亡,濒死虾很少出现在池边或水面。
迄今为止,AHPNS只发生于凡纳滨对虾、斑节对虾和中国明对虾。已有的研究显示,在凡纳滨对虾虾苗、幼虾阶段等都能检测到病原的存在。但近几年来,AHPNS的发生季节不明显,放苗60 d后常有发生。高温季节、放养密度高等对虾发病率较高,养殖集中区域发病率较高,单养池塘的对虾患病机率和受影响程度均高于混养池塘。
2 病原
2.1 AHPNS病原
有关对虾AHPNS病原的研究报道较多,已有的研究结果认为,一类携带有特定致病基因的弧菌是该病发生的病原,其中主要是副溶血性弧菌。藻毒素、对虾种质下降和环境因子等外界因子可促使对虾发生AHPNS。
Tran L等[1]对从越南AHPNS发病虾池中分离出1株哈维氏弧菌(Vibrioharveyi),浸泡感染后对虾病死率达100%,死亡对虾的临床症状与病理组织学变化与AHPNS典型症状完全相同。Joshi J等[3]从泰国病虾中分离出数株副溶血性弧菌,肌注感染对虾,其中一组24 h内100%死亡,死亡个体病理组织学变化与AHPNS病虾相同。而另一组48 h后才出现死亡,所有菌株检测均为阳性。Liu L等[5]在上海的AHPNS发病虾池中分离出1株欧文斯氏弧菌(Vibrioowensii),认为该菌株为AHPNS致病菌株。Xuan D等[6]认为从病虾体内分离的1株坎氏弧菌可导致AHPNS的发生。
2.2 AHPNS致病弧菌的毒力因子
副溶血性弧菌是AHPNS的主要致病菌,也是一种人渔共患的致病菌,溶血素是其主要致病因子,包括耐热性直接溶血素(thermostable direct hemolysin,TDH)、相对耐热直接溶血毒素( TDH-related hemolysin,TRH) 、不耐热性溶血素 (thermolabile hemolysin,TLH)等,以TDH和TRH为主。Soto-rodriguez S A等[3]和Joshi J等[4]研究发现,所分离的发生AHPNS的副溶血性弧菌(VPAHPNS)泰国和墨西哥株均携带TLH,不携带TDH和TRH,这与副溶血性弧菌主要人类临床致病菌株表型不一致,分析认为该种副溶血性弧菌导致人虾共患疾病的可能性很小。Moonyoung将副溶血性弧菌的环境株、临床株以及AHPNS株型分别感染凡纳滨,发现AHPNS株型组24 h对虾致死率达100%,环境株与临床株组96 h致死率仅为0和30%,表明AHPNS株型毒力更强。同时发现AHPNS株型增殖时间比其他株型更快。Joshi J等[3]应用特异性基因标记技术在4株VPAHPNS中发现依赖卵磷脂溶血素(LDH)的存在。
Tang K F J等[7]对虾VPAHPNS中获得3个毒素复合物(TC)类似物的基因,其中富含GC区的结构命名为tc-GIvp,它可编码调节因子及毒素,是VPAHPNS所特有。Han J E等[8]于VPAHPNS菌株中发现了一段69 kb大小的隐藏质粒“pVA1”,非VPAHPNS菌株中均没有发现,分析认为该隐藏质粒可能编码了VPAHPNS的毒力因子。
Tran L等[1]利用VPAHPNS菌液上清肛门注射感染后,对虾也表现出AHPNS的临床症状,表明该菌株胞外产物具有高毒力。Sirikharin R等[9]纯化VPAHPNS的菌液上清用来感染健康对虾,48 h内引起健康对虾极高的死亡率,SDS琼脂糖凝胶电泳发现两段分子质量分别为12 ku和50 ku的蛋白PirA、PirB。
Lee C T等[10]研究发现,VPAHPNS产生的二元毒素结构与苏云金芽胞杆菌所产生的伴孢晶体结构相似,毒力效应也与苏云金芽胞杆菌Cry蛋白毒力作用相似,都表现为插入宿主细胞膜上形成穿模孔洞,细胞内外渗透压发生改变,使靶细胞损伤甚至死亡。将编码两者效应蛋白的序列进行比对后同源性不到10%,但是却与发光杆菌属、短杆菌属编码二元蛋白质毒素序列的同源性最为相近。
Lee将接合缺少PirvpAB操纵子的pVA1-like质粒的VP菌株进行回归感染试验,结果未出现感染现象,进一步证明了PirA和PirB是AHPNS发生的主要毒力因子的观点。Lee C T等[10]认为PirA和PirB单独作用都可以致使健康对虾出现AHPNS的临床症状,当对虾肝胰腺检出PirB时,肝胰腺同时出现了明显的病变。Han J E等[11]在从AHPNS病虾体内分离出PirvpAB (+)型副溶血性弧菌2株,PirvpAB(+)坎氏弧菌4株,PirvpAB(-)型副溶血性弧菌3株,PirvpA(-)型副溶血性弧菌3株,对上述菌株进行毒力验证,发现PirvpAB(-)型与PirvpA(-)型菌株并不具有毒力,这表明VP仅含有PirB基因时,并不具有致病力。
Han J E等[8]在菌株VPAHPNS13-028/A3确认含有69 kb 的质粒pVpA3-1,其GC含量为5.9%。编码PirA和PirB的类pir A和pir B基因位于pVpA3-1 3.5 kb片段以内,GC含量为 38.2%,远低于质粒其余片段,可能是后天获得。Lee在质粒pVA1的序列中发现其含有质粒转移基因簇和pndA相移键控系统,这可能与该质粒的水平基因转移有关。Han J E等[11]发现PirvpAB基因与同一质粒上的一段插入序列组成一个复合转座子Tn6264,该插入序列与转座子ISVal1同源性相近。Han认为可能有某种携带Tn6264的未知细菌通过质粒接合等途径将Tn6264转移至弧菌基因组中,并且迅速转移扩散。
VPAHPNS对凡纳滨对虾的免疫调控具有一定的影响。Ponprateep S等[12]研究发现,凡纳滨对虾感染VPAHPNS早期,体内一种多功能巨球蛋白LvA2M表达受到抑制,酚氧化还原酶表达量持续上升,LvA2M对酚氧化还原酶基因的表达有一定调控作用。
3 病理学
有关对虾AHPNS病理学方面的研究主要集中在病理组织学方面。凡纳滨对虾发生AHPNS后肝胰腺组织储存脂肪的细胞囊泡数量明显降低,细胞分泌活动减少,分泌细胞退化,胚胎细胞有丝分裂减少,坏死的细胞从肝胰腺肾小管基底膜掉入消化腔和肠道;肝胰腺中央区域的分泌细胞、纤维细胞和吸收细胞排列紊乱,并向外侧蔓延;细胞核发生不同程度的肿大;组织间隙出现大量的红细胞[13]。AHPNS病虾肠壁变薄,肠腔变小,肠黏膜脱落,肠内无食物或粪便,中肠管壁细胞出现自溶现象[14]。有关对虾发生AHPNS的细胞病理学研究尚未见报道。
4 检测技术
副溶血性弧菌是一种常见的海水细菌,可通过TCBS琼脂等选择培养基来实施检测。但引起AHPNS的弧菌株只是其中携带特定致病基因的一小部分菌株。因此,通过细菌培养进行该病的检测有时无法实现。目前,该病的诊断方法以普通PCR、环介导等温扩增技术及实时荧光定量PCR为主。
4.1 普通PCR
2013年,Flegel 与Lo首次公布了检测VPAHPNS的AP1、AP2两种引物(表1)[15]。Sirikharin R等[16]验证发现AP2占有优势。后续研究中致病因子PirA和PirB被发现,相应编码基因片段ToxA、ToxB测序分析工作完成,灵敏度更高的检测方法也相继被开发出来(表2)。Sirikharin等根据ToxA设计了AP3一步PCR检测法。Soto-rodriguez S A等[3]比较认为,AP3方法更为科学。
2014年,一种套式PCR检测技术AP4被开发出来,Dangtip S等[17]应用104份对虾样品对AP4方法进行验证,准确达100%,最低DNA检测限可至100 fg,灵敏度比AP3提高 100倍。
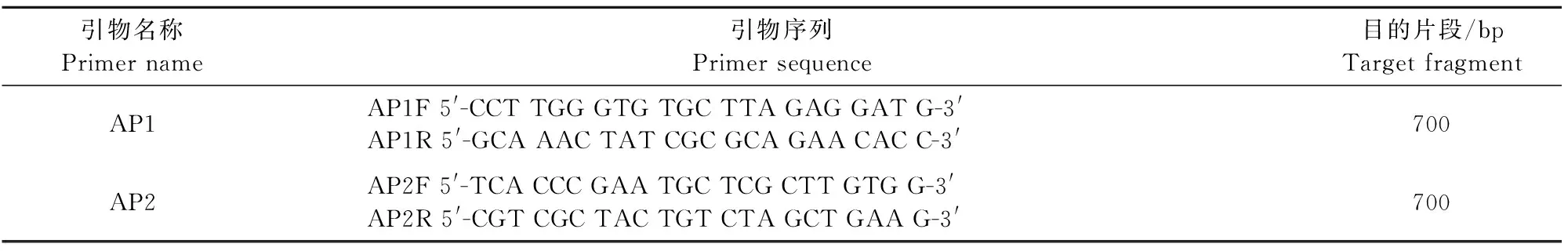
表1 基于PCR检测的AP1和AP2 两种引物

表2 几种引物设计基于ToxA、ToxB的PCR检测技术
4.2 环介导等温扩增
Kongrueng J等[19]以PirvpAB-like基因(AB972427.1)为目的基因设计了4对引物,识别并扩增目的基因上的6个区域,以副溶血性弧菌的管家基因tox-R作为内参基因,成功区别了AHPNS阴性、阳性菌株。使用Tinwongger设计的PCR方法作为对照,核酸灵敏度低至1 pg。
4.3 实时荧光定量PCR
Han J E等[20]以pirA-like为目的基因设计了TaqMan探针,建立了一种VPAHPNS定量PCR检测方法,目的片段为135 bp。通过构建pirA-like的标准质粒制作标准曲线,越南病虾最高检出每mg病虾含有5.8×105拷贝,中国病虾样品最高检出每mg 含1.5×104拷贝,死亡对虾上检出范围为1.8×103拷贝~4.7×106拷贝,发病池水样每mL检出范围为3.5×102拷贝~2.2×106拷贝,该法最低灵敏度为10个拷贝,对于环境样品的定量检测和研究具有重要意义。
5 AHPNS的防控
5.1 选择健康虾苗
选择不携带病原的种虾和健康虾苗是防控对虾AHPNS关键措施之一。2016年,张娜等[21]使用AP3、AP4等PCR检测方法对进口凡纳滨对虾亲虾进行AHPNS病原检测,可有效排除存在AHPNS病原的阳性种虾。为了培育优质的SPF虾苗,应当在源头上严格把关。选择丰年虫、沙蚕等生物饵料也应进行检疫,减少携带病原的生物饵料给种虾或对虾苗种带来的风险。
5.2 维护养殖环境
大多数发病池塘存在养殖密度过高、过度投喂、H2S浓度偏高、过度使用生石灰、缺乏蓄水池等现象,建议应加强管理,外源水须在蓄水池进行暴晒、曝气处理。周边一旦暴发AHPNS,换水必须严格操作。
王磊等[22]从对虾养殖水体和对虾肠道中分离筛选出3株兼具除氮能力的副溶血性弧菌拮抗菌,添加于含有一定量副溶血性弧菌菌液的对虾养殖水体,虾存活率达35%,可很好地调节养殖生态系统。Ching S等[23]开发一种包含黏土、酵母和功能性氨基酸等黏土复合物,可吸附细菌产生的胞外产物,减低VPAHPNS对养殖对虾的影响,但未见更多的有关推广应用的报道。
5.3 饵料控制技术
张盛静等[24]在饲料中添加地衣芽胞杆菌和枯草芽胞杆菌,可提高凡纳滨对虾的抗感染能力,酚氧化酶原、溶菌酶等表达量上升。姜礼燔等[25]从中药成分中筛选出一种NO前体,认为对病原的灭活水平超过氟苯尼考,对于AHPNS的防治具有重要意义。
5.4 科学的投喂方式
应根据对虾生长情况,适时地调整投喂量,避免过度投喂。过度投喂不仅会浪费饲料,污染水质,而且增加对虾消化系统负担,使对虾长期处于亚健康状态。在阴雨天、急剧降温或升温、pH变化剧烈、发生肝胰腺病变、出现白便、水体有泡沫或有异味、倒藻等情况下,应减料或停料。
5.5 药物防治
许多学者对药物防治AHPNS进行了积极有效的探索。Supungul P等[26]从中国明对虾体内分离到一种具有抗脂多糖活性的重组蛋白rALFPm3,对于VPAHPNS具有良好的抗菌活性,最低抑菌浓度为1.25 μmol/L~5.00 μmol/L,rALFPm3可以引起VPAHPNS产生细胞畸变和空泡。Tinh T H等[27]从芒果和柑橘类植物中提取了一类多酚类物质——焦培酸,可以抑制VPAHPNS,MIC为32 μg/mL~64 μg/mL。Junprung W等[28]将感染VPAHPNS的对虾暴露于非致死性热休克蛋白HSP70和HSP90中,试验组存活率提高50%以上。
5.6 生物防治
2014年,Tran L H等[29]研究了对虾与罗非鱼混养来防治AHPNS的技术。研究认为,罗非鱼具有保持微生物群体平衡的能力,在生态系统中,病原菌没有繁殖的机会,细菌密度在一个比较安全的水平,另外,罗非鱼的存在能有效帮助微生物系统应对突然变化,降低发病率。在虾塘中低密度放养罗非鱼,控制底栖藻类,清理塘底,清除死虾去除病原。Jin W J等[30]筛选得到了1株噬菌体pVp-1,能够对22株VPAHPNS中的20株产生明显的抑制作用。
6 结语
对虾急性肝胰腺坏死综合征是近年来对虾养殖中危害最为严重的疾病之一,并且出现逐年严重的趋势。目前亚洲和中南美洲地区都出现了严重的AHPNS病情,建议应重视进口种虾和所培育苗种的病原检测工作,应用现代生物技术开发对该病防治的产品,加强基于生态养殖的防控技术研发和应用,以减少该病的发生。
参考文献:
[1] Tran L,Nunan L,Redman R M,et al.Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp.[J].Dis Aquat Org,2013,105(1):45-55.
[3] Joshi J,Srisala J,Truong V H,et al.Variation inVibrioparahaemolyticus,isolates from a single Thai shrimp farm experiencing an outbreak of acute hepatopancreatic necrosis disease (AHPNS)[J].Aquaculture,2014,s 428-4429(s 428-429):297-302.
[4] Soto-rodriguez S A,Gomezgil B,Lozanoolvera R,et al.Field and experimental evidence ofVibrioparahaemolyticusas the causative agent of acute hepatopancreatic necrosis disease of cultured shrimp (Litopenaeusvannamei) in Northwestern Mexico.[J].Appl Environ Microbiol,2015,81(5):1689-1699.
[5] Liu L,Xiao J,Xia X,et al.Draft genome sequence ofVibrioowensiistrain SH-14,which causes shrimp acute hepatopancreatic necrosis disease[J].Genome Announc,2015,3(6):e01395-1415.
[6] Xuan D,Wang H,Xie G,et al.An isolate ofVibriocampbelliicarrying the pirVP gene causes acute hepatopancreatic necrosis disease[J].Emerg Microbes Infec,2017,6(1):e2.
[7] Tang K F J,Lightner D V.Homologues of insecticidal toxin complex genes within a genomic island in the marine bacteriumVibrioparahaemolyticus[J].FEMS Microbiol Lett,2014,361(1):34-42.
[8] Han J E,Mohney L L,Tang K F J,et al.Plasmid mediated tetracycline resistance ofVibrioparahaemolyticus,associated with acute hepatopancreatic necrosis disease (AHPNS) in shrimps[J].Aquac Rep,2015,2:17-21.
[9] Sirikharin R,Taengchaiyaphum S,Sanguanrut P,et al.Characterization and PCR detection of binary,pir-like toxins fromVibrioparahaemolyticusisolates that cause acute hepatopancreatic necrosis disease (AHPNS) in shrimp.[J].PLoS One,2015,10(5):219-220.
[10] Lee C T,Chen I T,Yang Y T,et al.Correction for Lee et al.The opportunistic marine pathogenVibrioparahaemolyticusbecomes virulent by acquiring a plasmid that expresses a deadly toxin.[J].P Nati Acad Sci,2015,112(39):798-803.
[11] Han J E,Tang K F J,Aranguren L F,et al.Characterization and pathogenicity of acute hepatopancreatic necrosis disease natural mutants,pir AB vp,(‐)V.parahaemolyticus,and pir AB vp,(+)V.campbellii,strains[J].Aquaculture,2017,470:84-90.
[12] Ponprateep S,Vatanavicharn T,Chu F L,et al.Alpha-2-macroglobulin is a modulator of prophenoloxidase system in pacific white shrimpLitopenaeusvannamai[J].Fish Shellfish Immun,2017,62:68-74.
[13] Flegel T W.Historic emergence,impact and current status of shrimp pathogens in Asia[J].J Invertebr Pathol,2012,110(2):166-173.
[14] 苏树叶.凡纳滨对虾“早期死亡综合症”的初步研究[D].海南海口:海南大学,2013.
[15] NACA.Acute hepatopancreatic necrosis disease card (updated June 2014) [EB/OL].Network of Aquaculture Centres in Asia-Pacific (NACA) (www.enaca.org),2014.
[16] Sirikharin R,Taengchaiyaphum S,Sritunyalucksana K,et al.A new and improved PCR method for detection of AHPNS bacteria [EB/OL].Network of Aquaculture Centres in Asia-Pacific (NACA) (http://www.enaca.org/modules/news/article.php?article-id=2030).2014.
[17] Dangtip S,Sirikharin R,Sanguanrut P,et al.AP4 method for two-tube nested PCR detection of AHPNS isolates ofVibrioparahaemolyticus[J].Aquac Rep,2015,2:158-162.
[18] Tinwongger S,Proespraiwong P,Thawonsuwan J,et al.Development of PCR diagnosis for shrimp acute hepatopancreatic necrosis disease (AHPNS) strain ofVibrioparahaemolyticus[J].Fish Pathol,2014,49(4):159-164.
[19] Kongrueng J,Tansila N,Mitraparp-Arthorn P,et al.LAMP assay to detectVibrioparahaemolyticuscausing acute hepatopancreatic necrosis disease in shrimp[J].Aquacult Int,2015,23(5):1-10.
[20] Han J E,Tang K F J,Pantoja C R,et al.qPCR assay for detecting and quantifying a virulence plasmid in acute hepatopancreatic necrosis disease (AHPNS) due to pathogenicVibrioparahaemolyticus[J].Aquaculture,2015,442:12-15.
[21] 张 娜,王津津,谢艳辉,等.进口南美白对虾亲虾急性肝胰腺坏死病的检测分析[J].中国动物检疫,2016,33(7):90-94.
[22] 王 磊,王志杰,高 戈,等.一株兼具氨氮去除能力和对副溶血弧菌拮抗作用的有益菌的筛选及其初步应用[J].渔业科学进展,2016(3):79-84.
[23] Ching S,Chi F,Cravens R.Use of a clay product to decrease the effects of bacterial disease in shrimp:,WO 2016019343 A1[P].2016.
[24] 张盛静,宋晓玲,赵小金,等.饲料中添加益生菌对凡纳滨对虾抗感染和5种免疫基因表达的影响[J].水产学报,2015,39(6):899-907.
[25] 姜礼燔,许云萍,吴 敏.中药一氧化氮NO复合剂在防控对虾肝胰腺坏死症中应用[J].当代水产,2015(4):76-78.
[26] Supungul P, Jaree P, Somboonwiwat K, et al.A potential application of shrimp antilipopolysaccharide factor in disease control in aquaculture[J].Aquac Res,2017,48(3):1775-1779.
[27] Tinh T H,Nuidate T,Vuddhakul V,et al.Antibacterial activity of pyrogallol,a polyphenol compound againstVibrioparahaemolyticusisolated from the central region of Thailand[J].Procedia Chem,2016,18:162-168.
[28] Junprung W,Supungul P,Tassanakajon A.HSP70 and HSP90 are involved in shrimpPenaeusvannameitolerance to AHPNS-causing strain ofVibrioparahaemolyticusafter non-lethal heat shock.[J].Fish Shellfish Immun,2016, 60:237-246.
[29] Tran L H,Fitzsimmons K M,Lightner D V .Tilapia could enhance water conditions,help control EMS in shrimp ponds[J].Global Aquac A,2014(Jan/Feb):26-28.
[30] Jin W J,Han J E,Tang K F J,et al.Potential application of bacteriophage pVp-1:Agent combatingVibrioparahaemolyticus,strains associated with acute hepatopancreatic necrosis disease (AHPNS) in shrimp[J].Aquaculture,2016,457:100-103.

