一种快速鉴定杂交水稻种子纯度的方法
, , , , ,
(安徽丰大种业股份有限公司, 合肥 231100)
种子质量是种子企业生存的根本,杂交种子纯度是种子质量检验的重要指标之一,也是企业购销种子的重要依据[1]。最准确的种子纯度鉴定方法是田间鉴定,但成本高,耗时长,特别是其检测结果滞后的缺点不能满足种子企业经营工作的需要[2]。近年来,随着分子标记的发展, SSR标记因其稳定、重复性好、多态性好等优点,被广泛应用于杂交水稻种子纯度的检验[3]。SSR标记是在DNA水平上的检测,因此不受环境影响,成本低廉,简单快速。
根据《农作物种子检验规程》(GB/T 3543.5—1995),在培养室或温室中,可以用100粒,2次重复。所以运用SSR标记进行杂交种子纯度检测的首要步骤是提取200粒单株的DNA,目前,DNA提取的方法一般为CTAB法和SDS法,这2种方法操作步骤繁琐,耗时长,且提取过程存在有害人体的物质[4],因此DNA的提取成为了SSR标记检测杂交种纯度的限速步骤。高效快速提取基因组DNA的技术在水稻中也有研究[5],但普遍认为其扩增效果不稳定,所以未在水稻杂交种纯度检测中普及[6]。本研究通过96孔PCR板快提法与CTAB法提取的DNA,分别进行PCR扩增检测,为大量检测杂交水稻种子纯度提供了一种高效简便的方法。
1 材料和方法
1.1 材 料
本试验所用的杂交水稻种子两优988及其双亲(R 988(♂)和富1 S(♀))均来自安徽丰大种业股份有限公司制种基地。所有试剂及引物均购自上海生物工程有限公司。
1.2 方 法
1.2.1 种子发芽
随机选取超过100粒杂交水稻种子和10粒双亲种子,放入2个小发芽盒,置于30 ℃恒温箱中,待幼苗长至3~5 cm时取样。
1.2.2 DNA提取
随机选取94株健康幼苗,编号1~94,1株母本健康幼苗,编号95,1株父本健康幼苗,编号96。分别取0.5~1 cm大小的叶片放入96孔PCR板中,每孔中加入40μL 0.25 mol/L的NaOH溶液(NaOH溶液应该浸没植物组织),盖上软胶盖,放置于100 ℃的水浴锅内,加热1 min,取出后每孔加入60μL 0.17 mol/L的Tris-HCl溶液,再置于水浴锅沸水中煮3 min,水煮后的PCR板冷却后即可作为PCR反应的模板,备用。
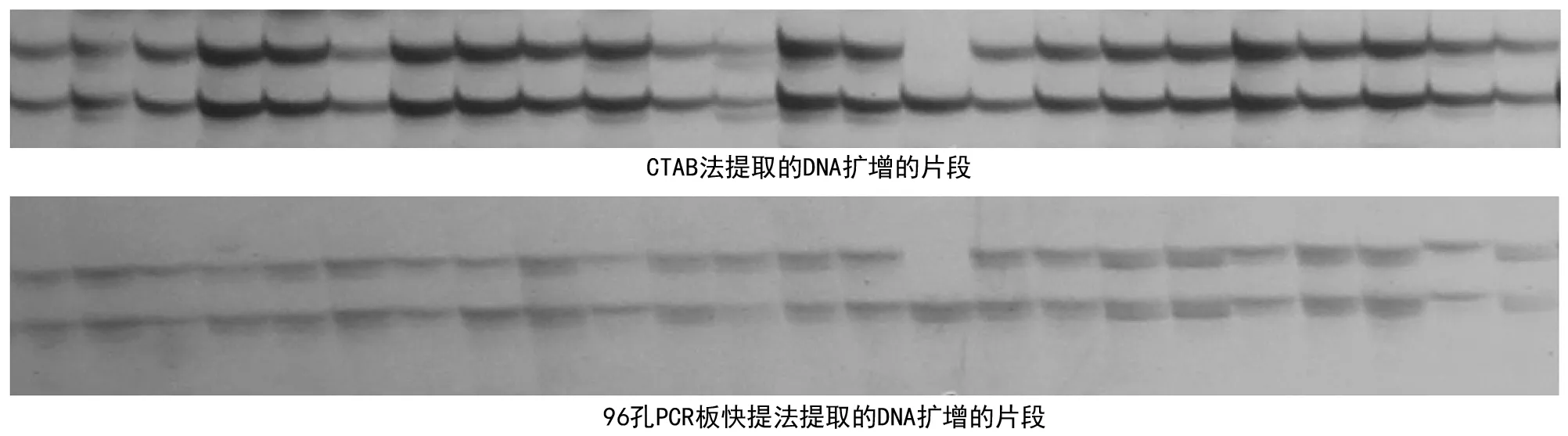
图2 RM 583对两优988部分单株不同方法提取的DNA的扩增结果
对照:编号1~96的幼苗单株,双亲各10个单株幼苗,用常规CTAB法[7-8]提取DNA,并与上述方法提取的DNA 一一对应加入96孔PCR板中,双亲各10个单株的DNA分别混合,备用。
1.2.3 引物筛选
采用中华人民共和国农业行业标准NY/T 1433-2014《水稻品种鉴定技术规程SSR标记法》附录C中推荐的48对SSR引物,对双亲及杂交种子进行多态性筛选。选用在双亲中具有较好多态性的SSR引物。
1.2.4 PCR扩增检测
用筛选得到的SSR引物分别对2种方法提取的两板DNA进行扩增。10μL PCR反应体系:10×Buffer(含Mg2+),2 mM dNTPs,5 U/μLTaqDNA聚合酶,50 ng/μL SSR引物。反应程序:94 ℃预变性4 min,1个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共31个循环;72 ℃延伸5 min,1个循环;4 ℃保存待用。
PCR扩增产物经4%的变性聚丙烯酰胺凝胶电泳分离,并用数码相机拍照保存。
2 结果与分析
2.1 引物的筛选结果
本试验从48对引物中选取了8对引物进行多态性筛选,结果显示,RM 583的多态性最好(图1),可以用于两优988杂交种子的纯度鉴定。RM 583的引物序列为(5′→3′):
RM 583 F:AGATCCATCCCTGTGGAGAG
RM 583 R:GCGAACTCGCGTTGTAATC
2.2 2种方法提取的DNA,PCR扩增检测结果比较
96孔PCR板快提法与常规CTAB法提取的DNA,利用SSR引物RM 583分别进行扩增检测。部分DNA的聚丙烯酰胺凝胶电泳检测表明(图2):同一单株2种不同方法提取的DNA所扩增出来的带型完全一样。表明96孔PCR板快提法完全可以用于水稻杂交种子测纯。
3 讨论与思考
本研究采用96孔PCR板快提法提取水稻幼苗DNA的方法,相比常规CTAB法,大大节省了时间,高效快速且安全无毒,操作简便易行。后续的PCR扩增检测试验显示,此快提法提取的DNA与常规CTAB法提取的DNA进行SSR-PCR检测时,带型完全一致。因此,96孔PCR板快提法可以应用于水稻杂交种子的纯度检测,特别是在需要大量提取水稻幼苗DNA时,其优势非常明显。
关于水稻杂交种测纯的几点思考:
1) 检测数量。
种子企业在不同生产基地生产的种子,分为不同的种子批,每个种子批均应扦样一份待测样品。根据《农作物种子检验规程》(GB/T 3543.5—1995),综合检测成本,选择每个待测样品检测200个单株[9]。检测种子的选择应具有代表性,室内发芽的种子在田间并不能全部长成植株,应选择健康茁壮的幼苗作为检测对象,以缩小室内检测与田间鉴定的差距。
2) 引物选择。
原则上只要在其双亲中具有共显性的多态性,就可以用于杂交种子的纯度检测[10]。但不同SSR引物的杂株辨别率差距较大,单对SSR引物检测杂株类型构成复杂的样品时可靠性较低[11]。所以应该尽可能了解受检样品的生产背景和杂株类型,最好与田间鉴定相结合,选出具有针对性的一对或多对引物供检测[12]。
参考文献:
[1]郭承亮.SSR分子标记在杂交稻种子纯度精确鉴定中的应用[J].中国种业,2014(1):21-23.
[2]郭承亮,袁国保,耿月明,等.利用SSR标记鉴定两系杂交稻种子纯度[J].中国种业,2011(11):40-43.
[3]尤佳,王晋,文朝慧,等.应用SSR技术鉴定杂交种种子纯度的方法探究[J].种子,2015,34(5):46-49.
[4]楼巧君,陈亮,罗利军.三种水稻基因组DNA快速提取方法的比较[J].分子植物育种,2005,3(5):749-752.
[5]陈文岳,包劲松,周祥胜,等.一种可用于PCR分析的水稻DNA简易提取法[J].中国水稻科学,2005,19(6):561-563.
[6]刘毅,赵洪阳,唐金娟,等.一种高通量水稻DNA提取方法及其在种子纯度检测中的应用[J].上海农业学报,2016,32(5):8-10.
[7]詹庆才.利用微卫星DNA标记进行杂交水稻种子纯度鉴定的研究[J].杂交水稻,2002,17(5):46-50.
[8]刘之熙,陈祖武,朱克永,等.利用SSR分子标记快速鉴定杂交水稻种子纯度技术体系的优化[J].杂交水稻,2008,23(1):60-63.
[9]郭承亮,王世才.SSR分子标记在杂交稻种子纯度及杂株类型定量鉴定中的应用[J].中国农技推广,2013,29(1):108-111.
[10]何风华.水稻基因组中的微卫星标记及其应用[J].湖南农业大学学报,2004,30(5):488-491.
[11]赵虹,张宇飞,林梅,等.SSR法鉴定水稻两系杂交种纯度的运用与探讨Ⅴ.不同引物检测同一品种纯度的准确性[J].湖北农业科学,2012,51(20):4 458-4 459.
[12]廖芳丽,赵虹,张宇飞,等.SSR鉴定水稻两系杂交种纯度的运用与探讨Ⅵ.不同引物判定同一样品植株纯度的准确性[J].湖北农业科学,2013,52(1):19-21.

