野山杏果肉中总有机酸对高脂血症大鼠体内抗氧化作用研究
英提扎尔·艾孜木江,阿依姑丽·艾合麦提,李 珊,艾力牙尔·吾不力,古丽杰克热木·伊布拉音
(新疆农业大学食品科学与药学学院,乌鲁木齐 830052)
野山杏(PrunusarmeniacaL.)属蔷薇科,落叶乔木,在我国分布广泛,尤其在新疆的伊犁和哈密等地区分布更为丰富。研究证明,野山杏含有大量的膳食纤维和丰富的有机酸(如:柠檬酸、酒石酸、草酸、苹果酸、富马酸、琥珀酸和抗坏血酸等[1-3])、黄酮类及多种矿质元素[4-5]。有机酸是具有酸性的有机化合物,是植物体内重要的次生代谢产物,研究表明有机酸具有抗炎症反应、抗血栓、抗氧化[6]、降血脂[4]、抗病毒、增加冠脉流量、抑制脑组织脂质过氧化物生成以及保护血管内皮等生理功能[7-8]。目前,课题组已完成了野山杏果肉总有机酸的体外抑制脂质过氧化活性和清除自由基能力的作用[9-10]。本研究着重探讨TOAWA对高脂血症大鼠的体内抗氧化活性及其保肝作用,为新疆野山杏果肉成分的进一步研究、野山杏资源的开发利用以及提高野山杏产品的附加值提供科学依据。
1 仪器与材料
1.1仪器 SK-1混匀器(常州国华电器有限公司);UNICO-UV2000分光光度计(尤尼柯(上海仪器有限公司);DG5033A酶标仪(南京华东电子集团医疗装备有限责任公司);恒温数显水浴锅(北京市医疗设备厂);RE-52AA旋转蒸发器 (上海亚荣生化仪器厂);CHA-S恒温振荡器(常州国华电器有限公司);80-2型低速离心机(上海手术器械厂)。
1.2试药 野山杏成熟果实,产自新疆哈密伊吾县苇子峡乡,经新疆农业大学园林学院周桂林教授鉴定为蔷薇科杏属落叶乔木野山杏(PrunusarmeniacaL.)的果实,冷藏保存。血脂康胶囊(北京北大维信生物科技有限公司,批号20160108);717型阴离子交换树脂(上海山浦化工有限公司,批号20170407);胆固醇(上海蓝季生物科技发展有限公司,批号161020);胆酸钠(批号327021),丙基硫氧嘧啶 (批号150525),上海如吉生物科技发展有限公司; MDA试剂测试盒(批号20170728),SOD 试剂测试盒(批号20170805),GSH-Px试剂测试盒(批号20170801),TG试剂测试盒(批号20170515),TCH试剂测试盒(批号20170516),LDL-C试剂测试盒(批号20170518)和HDL-C试剂测试盒(批号20170515),均由南京建成生物工程研究所提供;其他试剂均为同产分析纯。
1.3动物 健康SD大鼠,雌雄各半,体质量200±20 g,新疆医科大学实验动物中心供应,许可证号:SCXK(新)2016-0003。
2 方法
2.1样品溶液和高脂乳剂的制备 TOAWA的制备:取野山杏干粉,用体积分数为50%的乙醇以料液比1∶10回流提取2次,合并滤液减压浓缩并回收乙醇,浓缩液采用717型阴离子交换树脂作为吸附柱,用稀盐酸做洗脱液,收集洗脱液,减压浓缩,浓缩的洗脱液再用正丁醇反复萃取,分离正丁醇相,减压回收正丁醇,残渣干燥即得淡棕色的总有机酸纯品,采用电位滴定法测定[11]含量为845.4 mg·g-1。实验前将总有机酸和血脂康用质量浓度为5 g·L-1的羧甲基纤维素钠配成所需质量浓度的混悬液。
高脂乳剂按照文献[12]方法配制(10 g胆固醇,20 g猪油,20 g·L-1胆酸钠,1 g丙基硫氧嘧啶,1 mL吐温-80;2 mL丙二醇)
2.2动物的分组、造模与给药 将60只大鼠按照表1随机分为6组,每组10只,雌雄各半,除了空白对照组每天灌服羧甲基纤维素钠外,其余5组上午灌服高脂乳剂,下午高脂模型组灌服羧甲基纤维素钠,阳性对照组灌服血脂康,TOAWA高、中、低剂量组分别灌服不同剂量的TOAWA。实验周期为60 d,每3 d称定体质量1次,便于调整灌胃剂量,期间正常进食、饮水。分组和给药剂量见表1。
表1实验大鼠分组和给药剂量
Tab.1 Experimental rats grouped and given doses

组别高脂乳剂/mL·kg-1·d-15g·L-1羧甲基纤维素钠mL·kg-1·d-1血脂康/g·kg-1·d-1TOAWA/g·kg-1·d-1空白对照组—10——高脂模型组1010——阳性对照组10—0.2—TOAWA 高剂量组10——0.4 中剂量组10——0.2 低剂量组10——0.1
注:—表示未给药或用生理盐水灌胃。
2.3生化指标的测定 于最后一次给药后禁食12 h,不禁水,腹腔注射体积分数为10%的水合氯醛麻醉实验大鼠,心脏采血,制备血清,用于测定血脂,脱臼处死大鼠,并快速取出肝脏、肾及脑组织,用4 ℃的生理盐水清洗干净,其中分离肝脏右小叶供制作病理切片,再分取一部分肝、肾和脑组织,分别加入9倍体积的生理盐水,在4 ℃下分别制成质量浓度为100 g·L-1肝、肾和脑组织的匀浆液,冷冻离心(3 000 r·min-1,10 min),分离上清液,按照试剂盒说明书分别测定血清中的TG、TCH、LDL-C和HDL-C含量以及肝、肾和脑组织匀浆液中的MDA、SOD和GSH-Px等生化指标。
2.4肝脏组织病理学检查 取出肝右小叶用生理盐水洗干净,用100 mL·L-1中性甲醛溶液固定,制作病理切片,进行苏木精-伊红染色,生物显微镜(100×和400×)观察各组肝组织切片,观察其病理学变化。

3 结果与分析
3.1TOAWA对高脂血症大鼠血清的影响 见表2。
表2TOAWA对高血脂大鼠血清中血脂含量的影响
Tab.2 Effects of TOAWA on serum lipids in hyperlipidemia rats
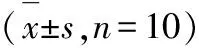
注:高脂模型组与空白对照组比较▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;高脂模型组与其余4组比较*P<0.05,**P<0.01,***P<0.001;TOAWA高、中、低剂量组与阳性对照组比较▼P<0.05,▼▼P<0.01。
由表2可知,与空白对照组相比,高脂模型组TG、TC和LDL-C水平极显著升高(P<0.001),HDL-C水平显著降低(P<0.01),此结果表明,大鼠高脂血症模型诱导成功。与高脂模型组比较,TOAWA高、中、低剂量组与阳性对照组均可显著降低TC、TG 和 LDL-C水平(P<0.01)和升高HDL-C的水平(P<0.05);与阳性对照组相比,TOAWA高剂量组呈现显著的调节血脂作用(P<0.05)、中剂量组无显著性差异、低剂量组调节血脂作用弱于阳性对照组。提示TOAWA能调节高脂血症大鼠血脂水平,且高剂量组的作用更为明显。
3.2TOAWA对高脂血症大鼠肝、肾和脑组织中MDA含量的影响 见表3。由表3可知,模型组肝、肾和脑组织中的MDA水平与空白对照组相比有显著的升高(P<0.01),表明组织中过氧化脂质蓄积;TOAWA高、中、低剂量组与阳性对照组对实验大鼠肝、肾和脑组织中的MDA水平有明显降低(P<0.05),并呈现一定的剂量依赖性,其中肾脏组织中MDA水平降低更为显著(P<0.001)。与阳性对照组比较,TOAWA高、中、低剂量组对受试大鼠肝、肾和脑组织中的MDA水平的降低作用无明显差异,作用影响与阳性对照组相当。结果表明,TOAWA对受试大鼠的肝、肾和脑组织的MDA水平有不同程度的降低作用,且对肾脏与脑组织的作用更为明显。
3.3TOAWA对高脂血症大鼠肝、肾和脑组织中SOD值的影响 见表4。
由表4可知,与空白对照组比较,高脂模型组肝、肾和脑组织中的SOD活性明显低于空白对照组(P<0.001),表明高脂模型组大鼠组织中产生了过氧化损伤;与高脂模型组相比,TOAWA高剂量组和阳性对照组能显著升高肝、肾和脑的SOD活性(P<0.05),TOAWA中、低剂量组能不同程度地升高组织中的SOD活性;与阳性对照组比较,TOAWA高剂量组能升高肝、肾和脑组织中的SOD活性,其中脑组织升高作用较明显(P<0.05),中、低剂量组升高作用较弱,但差异不大。此结果表明,TOAWA能够提高实验大鼠肝、肾和脑组织中的SOD活性,呈现良好的抗氧化能力,其中对肾和脑组织的作用更明显。
表3TOAWA对大鼠肝、肾和脑组织中MDA(nmol·mgprot-1)含量的影响
Tab.3 Effects of TOAWA on the content of MDA(nmol·mgprot-1) in liver kidney and brain tissue of rats
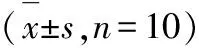
注:高脂模型组与空白对照组比较▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;高脂模型组与其余4组比较*P<0.05,**P<0.01,***P<0.001;TOAWA高、中、低剂量组与阳性对照组比较▼P<0.05。
3.4TOAWA对高脂血症大鼠肝、肾和脑组织中GSH-Px活性的影响 见表5。
表4TOAWA对大鼠肝、肾和脑组织中SOD(U·mgprot-1)活性的影响
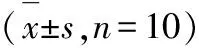
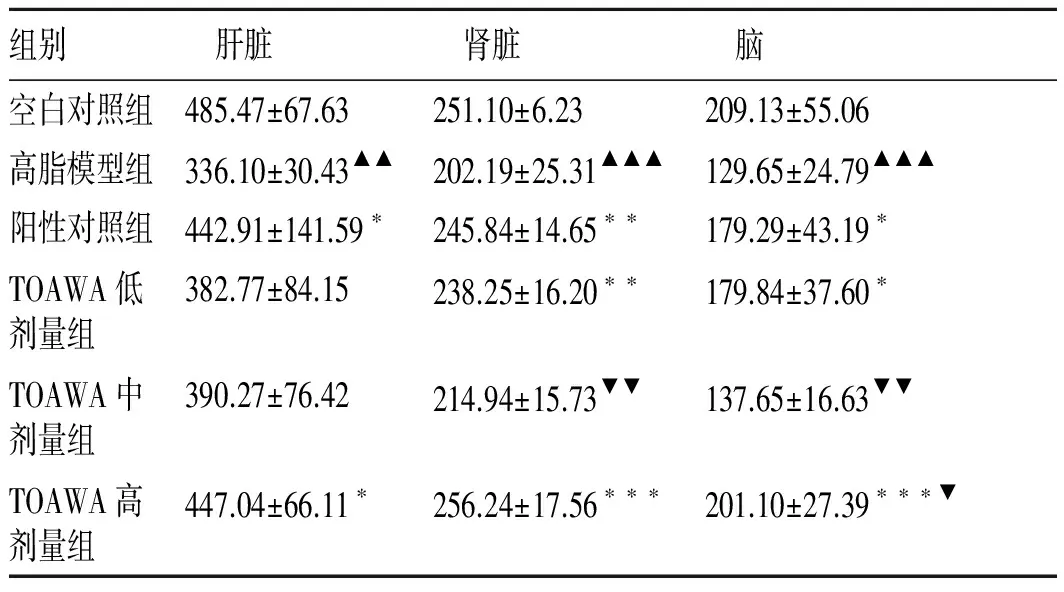
组别 肝脏 肾脏 脑空白对照组485.47±67.63251.10±6.23209.13±55.06高脂模型组336.10±30.43▲▲202.19±25.31▲▲▲129.65±24.79▲▲▲阳性对照组442.91±141.59∗245.84±14.65∗∗179.29±43.19∗TOAWA低剂量组382.77±84.15238.25±16.20∗∗179.84±37.60∗TOAWA中剂量组390.27±76.42214.94±15.73▼▼137.65±16.63▼▼TOAWA高剂量组447.04±66.11∗256.24±17.56∗∗∗201.10±27.39∗∗∗▼
注:高脂模型组与空白对照组比较▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;高脂模型组与其余4组比较*P<0.05,**P<0.01,***P<0.001;TOAWA高、中、低剂量组与阳性对照组比较▼P<0.05,▼▼P<0.01。
由表5可知,高脂模型组与空白对照组相比,肝、肾和脑组织中的GSH-Px的活性显著降低(P<0.001),说明高脂模型组大鼠组织内抗氧化能力明显降低;与高脂模型组相比TOAWA高剂量组和阳性对照组能显著提高肝、肾和脑组织的GSH-Px活性 (P<0.01),TOAWA中、低剂量组可不同程度地提高实验大鼠肝、肾和脑组织中GSH-Px活性,但差异无统计学意义;与阳性对照组相比,TOAWA高剂量组对肝、肾和脑组织中的GSH-Px活性的升高作用较强,其中肝脏组织作用较明显(P<0.01),TOAWA中、低剂量组比阳性对照组作用较弱。结果表明,TOAWA对实验大鼠肝、肾和脑组织均呈现不同程度的抗氧化作用。
表5TOAWA对大鼠肝、肾和脑组织中GSH-Px(U·mgprot-1)活性的影响
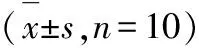

组别 肝脏 肾脏 脑空白对照组568.76±71.98361.73±58.9026.31±5.99高脂模型组426.49±51.99▲▲298.35±26.86▲▲14.09±2.96▲▲▲阳性对照组511.77±58.14∗374.31±57.16∗∗21.66±5.88∗∗TOAWA低剂量组456.10±54.75329.49±30.18▼17.99±2.08TOAWA中剂量组469.57±93.27341.86±32.07∗18.27±3.80TOAWA高剂量组537.67±58.89∗∗▼▼392.26±19.24∗∗∗24.72±3.80∗∗∗
注:高脂模型组与空白对照组比较▲P<0.05,▲▲P<0.01,▲▲▲P<0.001;高脂模型组与其余4组比较*P<0.05,**P<0.01,***P<0.001;TOAWA高、中、低剂量组与阳性对照组比较▼P<0.05,▼▼P<0.01。
3.5大鼠肝脏组织的病理学观察 见图1。由图1可知,空白对照组周边肝细胞结构正常,肝细胞以中央静脉为中心的放射状排列,且规律、整齐、肝窦正常,未见细胞膨胀,无明显的病理形态变化;高脂模型组肝细胞含有较多的白色脂肪油滴,并伴有大量炎性细胞浸润,可见肝细胞索结构紊乱,肝细胞之间连接松散,发生脂肪变性;给予不同剂量TOAWA和血脂康后,TOAWA高、中、低剂量组的脂肪变性程度明显改善,细胞形态开始恢复,其中高剂量组的脂肪病变减少更显著,大部分细胞恢复接近正常形态,阳性对照组肝索和肝窦结构清晰,中央静脉周围肝细胞恢复放射状排列整齐,脂肪油滴明显减少,肝脏切片基本恢复到正常状态。

图1TOAWA对大鼠肝脏组织的病理学变化的影响
A.空白对照组(×100);B.空白对照组(×400);C.高脂模型组(×100);D.高脂模型组(×400);E.阳性对照组(×100);F.阳性对照组(×400);G.TOAWA低剂量组(×100);H.TOAWA低剂量组(×400); I.TOAWA中剂量组(×100);J.TOAWA中剂量组(×400);K.TOAWA高剂量组(×100);L.TOAWA高剂量组(×400)。
Fig.1 Effect of TOAWA on pathological changes of liver tissue in rats
A.control group(×100); B.control group(×400); C.model group(×100); D.model group(×400); E.positive control group(×100); F.positive control group(×400); G.TOAWA low dose group(×100); H.TOAWA low dose group(×400); I.TOAWA middle dose group(×100); J.TOAWA middle dose group(×400); K.TOAWA high dose group(×100); L.high dose group(×400).
4 讨论
随着社会发展,高脂血症发病率呈逐年升高趋势,且患者发病年龄段趋于年轻化[13]。血脂异常与冠心病的发生和心血管疾病的死亡率密切相关[14-16],在高脂血症病理状态下,血管内皮细胞在脂蛋白的作用下产生大量的氧自由基导致血管内膜受损与细胞功能障碍,降低抗氧化能力[17-18]。抗氧化物质可通过提高机体抗氧化能力,清除体内自由基,降低脂质过氧化损伤,抑制机体、组织和细胞的过氧化过程[19-20],从而减轻自由基和过氧化脂质对机体的损伤。因此,在降低血脂的同时,增强机体的抗氧化能力,能更好地控制血脂异常导致的心血管疾病的发生和发展。
本研究以血脂康为阳性对照,通过测定TOAWA对高脂血症大鼠的血清血脂水平与肝、肾和脑组织的抗氧化指标,考察TOAWA对血脂水平的影响与对高血脂诱发的体内过氧化损伤的影响,通过制作肝脏的病理切片,观察TOAWA对肝功能的影响。研究结果表明,TOAWA能明显调节高脂血症大鼠的血脂水平,显著提升高脂血症大鼠肝、肾和脑组织抗氧化活性,对高脂血诱发的体内过氧化损伤有明显的改善作用;TOAWA能使高脂血症导致的肝细胞结构的改变和脂肪浸润的现象得到显著改善,肝细胞的结构基本恢复正常,提示其具有一定的保肝作用。对TOAWA的体内抗氧化活性和保肝作用需深入研究,为将其研发为安全、有效的天然抗氧化剂和功能性食品的添加剂提供科学依据。
参考文献:
[1] 阿依姑丽·艾合麦提.野山杏不溶性膳食纤维的提取及其降血脂作用研究[D].乌鲁木齐:新疆农业大学,2012.
[2] 黄玉香,吴雅清,许瑞安.有机酸提取技术研究进展[J].食品工业科技,2012,33(14):426-428,431.
[3] 李珊,阿依姑丽·艾合麦提,孙鹏,等.RP-HPLC法同时测定新疆野山杏果肉中10种有机酸成分[J].食品工业科技,2017,38(20):250-255.
[4] 阿依姑丽·艾合麦提,戴小华,张华,等.野山杏总黄酮对高血脂大鼠降血脂及抗氧化作用的研究[J].西北药学杂志,2014,29(3):258-261
[5] 姚健,罗俊富,张继.野山杏果肉成分分析及对小鼠小肠蠕动作用的研究[J].中兽医医药杂志,2009,(1):18-20.
[6] 李娜,金敬红,姜洪芳,等.宣木瓜总有机酸的纯化及镇痛抗炎作用[J].中国实验方剂学杂志,2011,17(1):113-116,119.
[7] Zheng Y J,Duan Y T,Zhang Y F,et al.Determination of organic acids in red wine and must on only one RP-LC-column directly after sample dilution and filtration[J].Chromatographia,2009,69(11/12):1391-1395.
[8] Liszt K,Walker J,Somoza V.Identification of organic acids in wine that stimulate mechanisms of gastric acid secretion[J].J Agric Food Chem,2012,(60):7022-7030.
[9] 阿依姑丽·艾合麦提,李珊,英提扎尔·艾合买提,等.野山杏果肉总有机酸体外抑制脂质过氧化活性研究[J].西北药学杂志,2017,32(4):426-430.
[10]阿依姑丽·艾合麦提,李珊,英提扎尔·艾合买提,等.野山杏果肉总有机酸的分离纯化及其清除自由基能力的研究[J].食品科技,2017,42(5):219-223.
[11]国家药典委员会.中国药典:2015年版:四部[S].北京:中国中医药出版社,2015:86.
[12]熊静悦,周帧昊,赵璐,等.脂肪乳剂建立高脂血症模型小鼠的比较研究[J].中医药学刊,2006,24(8):1507-1508.
[13]闫小玲.洛伐他汀联合复方丹参滴丸治疗高血脂并冠心病疗效分析[J].当代医学,2015,21(3):139-140.
[14]尹若熙,薛光辉,李树民,等.沙棘黄酮与阿托伐他汀联用对实验性高脂金黄地鼠高血脂相关指标及肝脏形态的影响[J].西北药学杂志,2013,28(6):599-602.
[15]王谊,吕昊宇,蒋建勤.药物治疗高脂血症的作用机制[J].西北药学杂志,2012,27(2):188-190.
[16]张华,李建瑛,阿依姑丽·艾合麦提.野山杏果肉的保肝作用及其对高脂血症小鼠血脂的影响[J].华西药学杂志,2011,26(4):333-335.
[17]陈修,陈维洲,曾贵云.《心血管药理学》第二版简介[J].Ball Med Res,2000,29(12):18740.
[18]成龙,梁日欣,杨滨,等.红花提取物对高脂血症大鼠降脂和抗氧化的实验研究[J].中国实验方剂学杂志,2006,12(9):25-27.
[19]陈君,杨光,刘文群.小鼠抗衰老实验及微生物抗衰老研究概况[J].中国酿造,2011,(6):13-16.
[20]胡文兵,赵静,陈婷婷,等.青钱柳多糖对高脂血症小鼠的降血脂作用及机制初探[J].现代食品科技,2015,31(11):39-44.

