梭梭水力提升与浅根系植物优势度、丰富度和多度的关系
李宏侠, 杨晓东,3, 吕光辉,4
(1.绿洲生态教育部重点实验室, 新疆 乌鲁木齐 830046; 2.新疆大学 资源与环境科学学院, 新疆 乌鲁木齐 830046; 3.智慧城市与环境建模自治区普通高校重点实验室, 新疆 乌鲁木齐 830046; 4.新疆大学 干旱生态环境研究所, 新疆 乌鲁木齐 830046)
水力提升(hydraulic lift, HL)是指在深层土壤含水量较多或地下水位较浅而表层土壤极端干燥的情况下,深根系植物将处于深层的土壤水或地下水吸收,并通过木质部输导至浅层根系,进而释放到表层土壤中的一种现象[1-2]。由于它能改善水分在土壤中的分布格局,因而能够对干旱环境中浅根系植物的存活、土壤养分循环、微生物和细根的空间分布、群落多样性维持等都起到十分重要的作用[1-7]。梭梭(Haloxylonammodendron)是西北干旱区荒漠林中一个建群种,也是一种深根植物[8-9]。以往研究证明梭梭对干旱和盐碱条件具有高耐受性,是一种重要的固沙植物,在当地生态环境维持、经济和社会发展中都起着非常重要作用[9-10]。极端干旱条件下,深根系植物要从较深的土壤或地下潜水层提升水分,发生水力提升过程,需具备两前提: ①表层土壤干燥而深层土壤含有较丰富水量或地下水位较浅; ②植物根系能够到达孕育较丰富水量的土壤深层[1-2]。新疆艾比湖流域的荒漠地区,年降水量<100 mm,蒸发量>1 600 mm,表层土壤极端干燥,但在艾比湖的湖水和冰川融化水的补给作用下,该地区地下水位较高,土壤深层含水量较丰富[7,11]。梭梭作为生存在这样环境中的一种深根系植物,其满足上述发生水力提升的两个前提。因此,梭梭可能存在水力提升现象。但当前研究中有关梭梭水力提升的报道不多[11]。
艾比湖流域的荒漠中,尽管深层土壤中水储量较丰富,但对在荒漠中生长的大多数植物,其根长密度随土壤深度增加而降低[12-13],仅有少数植物的根系可以到达土壤深层吸收深层土壤水分或地下水。这在整体上限制了植物对水分的利用率,导致植物多样性较低[14-15]。深根系植物水力提升能通过根系将土壤深层水(地下水或土壤深层水)提升至土壤表层,增加表层土壤中的水分含量,为浅根系灌木及草本提供更多的水资源,从而在一定程度上诱导浅根系植物在水力提升发生的区域富集,影响浅根系灌木及草本的长势和植物多样性[7,16-19]。加之,考虑到干旱荒漠内,在水分限制条件下,可供植物吸收的水量决定了植株个体的数目及种类[7,20]。因此,在存在水力提升的前提下,梭梭水力提升可能会改善其伴生浅根系灌木和草本的生长情况,提高梭梭林的物种多度与丰富度。基于以上分析,本文在艾比湖自然保护区内,通过同位素示踪、样方调查和对比分析等方法,验证梭梭的水力提升现象、并探索分析梭梭水力提升与浅根系植物长势、群落多度和丰富度之间的关系。通过研究,旨在回答如下两个科学问题: ①干旱区荒漠林建群种梭梭是否存在水力提升现象? ②假如梭梭存在水力提升,是否会对浅根系植物的长势产生影响?是否会对干旱区荒漠林的物种多样性产生影响?解答上述两个问题,有助于了解干旱区荒漠林内深浅根系植物间的种间关系,对干旱荒漠区植物的利用与保护提供理论支撑。
1 研究区概况
艾比湖流域位于新疆维吾尔自治区博尔塔拉蒙古自治州的精河县西北,是准噶尔盆地西部最低洼地和水盐汇集中心[21]。艾比湖流域多年平均降水量为105.17 mm,年均气温5 ℃,潜在蒸发量为1 316 mm,降水量夏多冬少,年内分配不均,气候极端干燥,日照时数约2 800 h,极端最高气温44 ℃,极端最低气温-33 ℃,年平均温度为6~8 ℃[21]。属典型温带大陆性干旱气候。本研究对象梭梭是新疆艾比湖流域内荒漠林的一个建群种,由它主宰的梭梭林是西北干旱区荒漠中最为常见的一种显域性生态系统类型[9-10]。在艾比湖湿地自然保护区中,梭梭林面积约占当地总面积的2/5。另外,除梭梭外,艾比湖湿地自然保护区的荒漠林还生长有胡杨(Populuseuphratica)、柽柳(Tamarixramosissina)、盐穗木(Halostachyscaspica)、盐节木(Halocnemumstrobilaceum)、琵琶柴(Reaumuriasongonica)和盐爪爪(Kalidiumfoliatum)等[22-23]。
2 研究方法
基于Yang等[7]的方法,利用18O示踪方法验证梭梭是否存在水力提升现象,土壤含水量运用烘干法测定。另外,随机选择在梭梭树冠内外分别设置样方,计算并比较两种样方间植物在长势、丰富度和多度上的差别,以明确梭梭水力提升与多度、丰度、植物长势之间的关系。
2.1 同位素试验
在7月中旬北京时间7:30—9:30间,在艾比湖流域的东大桥管护站附近的梭梭林内,随机选择株型、高度和胸径大体一致但植株间距离>6 m的3株梭梭作为试验组,每株梭梭为1个样地,样地面积以选择梭梭为中心,设置面积为5 m×5 m,3株梭梭共3个样地。另外,在每个试验组样地周边无梭梭生长的区域,设置1个5 m×5 m对照组样地,共设置3个样地。在每个梭梭样地内随机选择3个点,采用土钻采样。采样时将土壤分5层(0—10 cm,10—40 cm,40—70 cm,70—100 cm,100—150 cm),对每层土壤,在3个样地共取9个样品,随后将9个样品混合作为梭梭树冠下每一层土壤的样品,对3个对照组样地作同样处理。将每一土壤混合样品采集后,迅速装入玻璃瓶,盖好瓶塞,用parafilm封口带封口,再将其放置在液氮罐中冷藏,直至测定。样品中重轻同位素含量之比(18O/16O)用中国林业科学院稳定同位素实验室的质谱仪(Thermo, Waltham, MA, USA)进行测定,每样品连续检测3次,为保证测样的精确性,取第3次测定结果为试验结果。标准样品连续测定精度D18O<0.5‰。土壤18O值的千分偏差值(δ)按公式(1)计算。
δ=(Rsample/Rstandard-1)×1 000‰
(1)
式中:Rsample——质谱仪测定结果〔样品中氧元素的重轻同位素的丰度比值(18O/16O)〕;Rstandard——国际通用标准物(Vienna standard mean ocean water for2H/1H and18O/16O)[5]。
2.2 样地设置和群落调查
在东大桥管护站附近的梭梭林内,基于艾比湖流域荒漠林中灌木最小取样面积为5 m×5 m的研究成果(梭梭林在艾比湖湿地自然保护区内是灌木林)[22],本文在植物当年生长季节的6,8,10月,随机共设置5 m×5 m梭梭林的试验样方38个(6,8,10月分别有10,13,15个),以及与其间隔距离>6 m的等面积但未生长梭梭的对照样方37个(6,8,10月分别为11,11,15个)。同时,在每个试验样方和对照样方内,另随机设置了1个1 m×1 m草本样方,试验和对照样方的数量各自共计为38,37个。各灌木和草本样方内,分别调查植物的种类、盖度、多度、胸径、冠幅和高度等。
2.3 植物生长优势度计算
传统生态学上评价物种在某一群落类型内的生长好坏情况,通常采用重要值(重要值=(相对多度+相对频度+相对盖度+相对高度)/400)和基于重要值的优势度指数进行判断:

(2)
式中:n——样方数;ni——样方i内某一物种的重要值;Ni——样方i内全部物种的重要值之和[24]。
一般地,物种的重要值和优势度值越大,表示该物种在群落内生长的越好。但在这一方法中,通常假定一个样方的重要值为1,随后依据样方各物种的特征统计值和所有个体的特征统计值(如多度、盖度、频度和高度等),将重要值1分配给各物种[24]。在这一过程中,当同一物种生长在不同时间和空间的异质样方中时,如选择梭梭树冠下群落和非树冠下群落,林冠下群落由于梭梭对重要值分配的份额最大,致使其他物种的重要值变小。相反,非林冠下群落没有梭梭,可能使得同一物种分配的重要值份额较高。因此,利用传统的重要值和优势度的方法,无法比较梭梭林冠下和非树冠下灌木和草本植物的生长状况。因此,在本文中,基于各物种在样方中多度、盖度、平均高度和频度值,采用了一个计算生长优势度的计算方法[7],以判断植物在不同空间样方上的差异。生长优势度的计算公式为:
(3)
式中:xs——标准化值;xmax,xmin——某一物种在某一样地中某一数量特征的最大值和最小值。
(4)
式中:xsc,xsa,xsh,xsf——某一物种在一样地中盖度、多度、高度和频度的标准化值; DI——某一物种在某样地的优势度指数。
(5)
式中:GDI——某一物种在所有样地上的生长优势度指数;N——样地数量;DIi——某一个给定物种在i样地中的优势度指数。
2.4 数据分析方法
采用配对样本T检验比较δ18O值在梭梭树冠内外土壤间的差别,采用独立样本T检验比较生长优势度、丰度和多度在梭梭林冠内外两种群落间的差别。所有统计过程均在SPSS 19.0中完成,图在Origin 8.0中制作。
3 结果分析
3.1 梭梭树冠下和非树冠下土壤δ18O值的比较
梭梭冠层下土壤δ18O值除在100—150 cm土层略高于同层对照土壤外,其余0—10,10—40,40—70,70—100 cm土层的δ18O值相对同层对照土壤,明显偏负(图1)。将5层土壤纳入整体分析梭梭树冠下和非树冠下土壤间的δ18O值差别时,梭梭树冠层下土壤的δ18O均值显著偏负于非林冠层下土壤(t=-2.62,df=9,p<0.05)(图1)。另外,在土壤剖面的垂直方向上,随土壤深度增加,梭梭树冠下和树冠外土壤的δ18O值逐渐偏负(图1),但树冠内土壤表层(10 cm)到深层(150 cm)的δ18O值相对变化幅度[11.91];其值=〔(10 cm的δ18O值-150 cm的δ18O值)/10 cm的δ18O)〕远高于非梭梭树冠下土壤δ18O值的相对变化幅度[2.21];其值=〔(10 cm的δ18O值-150 cm的δ18O值)/10 cm的δ18O)〕。

注:不同小写字母表示0.05水平差异显著。下同。
3.2 梭梭树冠下和非树冠下土壤剖面含水量的差异
3个生长季过程中,分别测定梭梭树冠下和非树冠土壤剖面含水量发现,梭梭在不同生长季过程中树冠下土壤平均含水量均高于非树冠下,其中100—150 cm土层两者存在显著性差异(p<0.05),其余土层树冠下土壤含水量均极显著高于非林冠下土壤(p<0.001)(表1)。

表1 梭梭树冠层和非树冠层下不同土层土壤含水量的比较
注:不同小字母代表组间存在差异;p<0.001表示组间存在极显著性差异;p<0.05表示组间存在显著性差异。
3.3 植物生长优势度在梭梭树冠下和非树冠下的差别
在梭梭林的生长季节内,梭梭树冠层下和非树冠层下群落共生长有3种灌木,对比这些灌木在两生境生长优势度差别后发现,梭梭树冠下灌木的生长优势度除10月的木质猪毛菜以外均高于非树冠下群落(表1)。同样,梭梭树冠下和非树冠下群落共生长有14种草本植物,对比它们在两生境生长优势度差别后发现,梭梭树冠下草本植物的生长优势度绝大多数高于非树冠下群落(表2),但在8月,叉毛蓬(Petrosimoniasibirica)、侧花沙蓬(Agriophyllumlateriflorum)和对节刺(HoraninoviaFisch)这3种短生草本植物呈现出相反趋势。另外,随生长季的时间沿长,灌木和大部分草本植物的生长优势度均呈现减小趋势(表2),但叉毛蓬、侧花沙蓬和对节刺这3种短生草本植物与总体趋势相反(表2)。
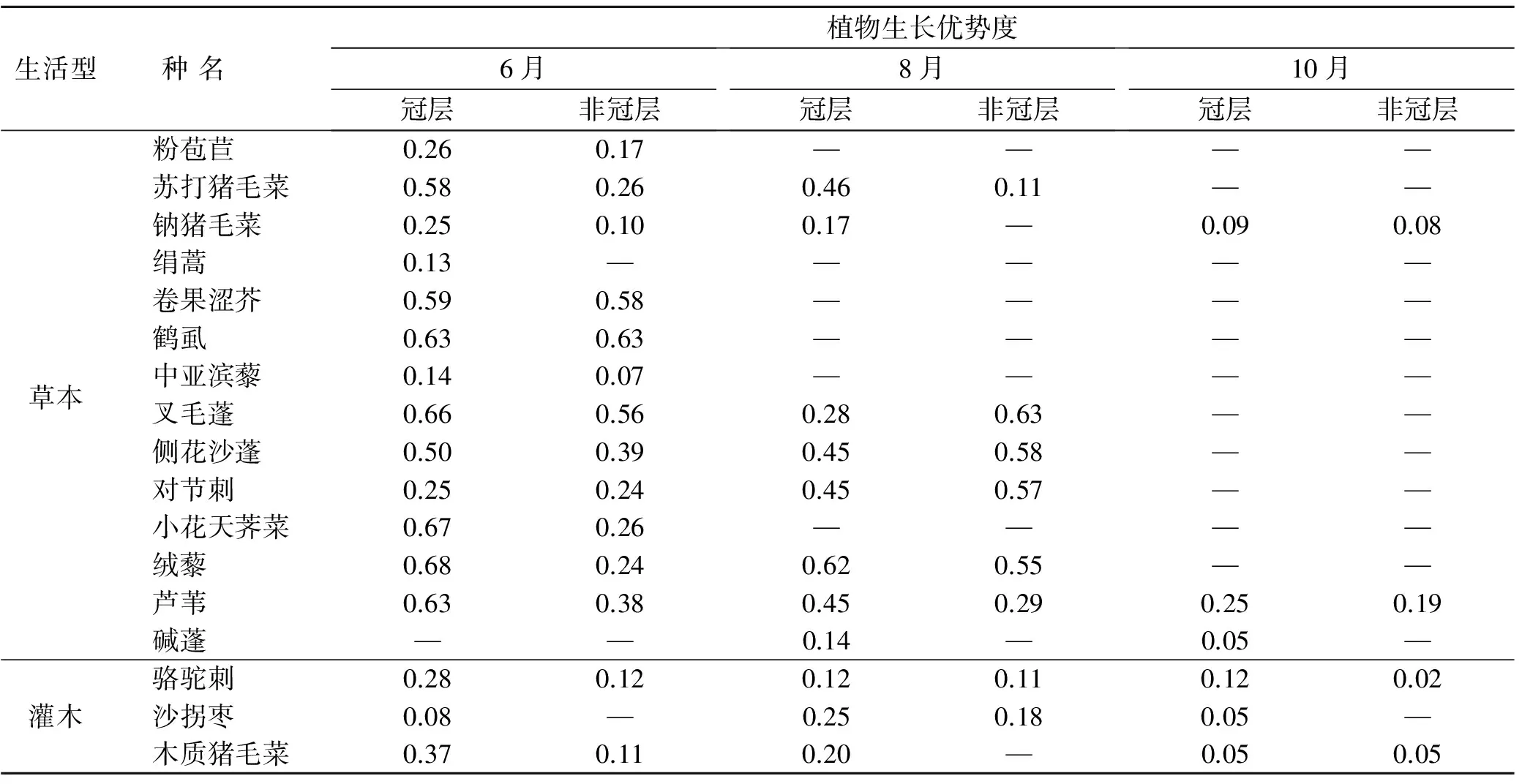
表2 植物生长优势度在梭梭树冠下和非树冠下的差别
注:“—”表示植物已完成生活史或调查样方时没有观测到数据致使该时段未有数据。各物种拉丁学名为:粉苞苣(Chondrillajuncea),苏打猪毛菜(Salsolasoda),钠猪毛菜(Salsolanitraria),绢蒿(Seriphidiumtransiliense),卷果涩芥(Malcolmiascorpioides),鹤虱(Lappulaplatyacantha),中亚滨藜(Atriplexcentralasiatica),小花天荠菜(Heliotropiummicranthum),绒藜(Londesiaeriantha),芦苇(Phragmitesaustralis),碱蓬(Suaedaglauca),骆驼刺(Alhagisparsifolia),沙拐枣(CalligonumL.),木质猪毛菜(Salsolaarbuscula)。
3.4 物种多度和丰富度在梭梭树冠下和非树冠下的差别
在植物生长季6,8,10月,梭梭树冠下群落的灌木的多度和丰富度均显著高于非树冠下群落(p<0.05)(图2)。同样,梭梭树冠下群落的草本植物的多度和丰富度也均显著高于非树冠下群落(p<0.05)(图2)。

图2 物种多度和丰富度在梭梭树冠下和非树冠下的差别
4 讨 论
水分在不同土壤层间运输时,物理、化学和生物的吸附和传导等作用,会使得氧同位素分馏,从而改变土层间的18O/16O值。相反,植物根系将水分吸收后,在根和茎内水传输过程中氧同位素不会发生分馏[5-6,25],即:植物根和茎内水的δ18O值与土壤中可供植物吸收的水的δ18O值相近[5-6,25]。在新疆艾比湖流域的荒漠林内,植物主要利用的水源为冰川消融后补给形成的地下水,以及由地下水进一步补给形成的深层土壤水[15]。这两种水源为当地的最初水源,其δ18O值最低[15]。在土壤垂直剖面上,随土壤深度减小,水分在土层间运输时的自身所经历的物理、化学和生物作用使得δ18O值随土壤深度减小逐渐偏正或不断增加。一般认为,地面蒸发是水分在土壤中从深运输至浅的基本动力,它是物理、化学和生物作用造成氧同位素在土层间分馏的前提[6,25]。本文中,梭梭的树冠下和非树冠下土壤样品均在北京时间7:30—9:30收集,这段时间地面蒸发作用十分微弱,由蒸发提供动力的土层间水分迁移过程尚未开始。因此,引起氧同位素分馏的其他物理、化学和生物的吸附和传导等作用在树冠内外的差别不大。水力提升作为水分通过植物根系从土壤深层或地下水运输至土壤浅层的一个过程,在试验中,若在浅层土壤中存在来自深层土壤或地下水的水分,说明植物发生了水力提升过程[5,7]。在相同土壤及气象环境条件下,倘若梭梭存在水力提升的现象,那么,梭梭深根吸收的深层土壤或地下水通过木质部运输至土壤浅层释放后,会使得浅层土壤的18O/16O值发生变化[5-7,25],即:梭梭将地下水或深层土壤中δ18O值较低的水分通过根系运输并释放到浅层土壤中,改变了浅层土壤的18O/16O值,使得浅层土壤的δ18O值相对没有发生水力提升的区域较低。相反,倘若梭梭不存在水力提升过程,δ18O值在梭梭树冠内外土壤间的差别不大。本研究中,除100—150 cm土层在非树冠下土壤中δ18O值高于树冠下土壤(图1),其余4层土壤在树冠下的δ18O值均明显低于非树冠下土壤。在配对样本T检验结果中,同样也显示树冠下土壤的δ18O显著低于非树冠下土壤(p<0.005)(图1)。对比冠层和非冠层下土壤含水量来看,冠层下土壤含水量显著高于非冠层下土壤(表1)。艾比湖流域荒漠中梭梭林的地下水位约在1.50~1.80 m,土壤深层水和地下水是土壤其余各层的最初水分来源,也是梭梭根系吸收水分的区域,δ18O值在梭梭林冠内外的土壤间差别不大,但在随后,梭梭在夜间可能发生了水力提升现象,将深层δ18O值较低的水分通过木质部释放到浅层土壤,使得梭梭树冠下0—100 cm范围的δ18O值均显著低于树冠外土壤。另外,在土壤剖面的垂直方向上,随土壤深度增加,梭梭树冠下土壤的δ18O值逐渐偏负,其从土壤表层(10 cm)到深层(150 cm)的δ18O值相对变化幅度为11.91,该值远高于非梭梭树冠下土壤的2.21。这也说明梭梭水力提升将土壤深层δ18O值较低的水分运输到土壤浅层,一定程度上减弱了蒸腾对氧同位素的分馏作用,使土壤中δ18O值的变化幅度相对非梭梭树冠下较小。
水分是干旱区荒漠植物群落的主要限制因子[26],群落内植物的生长好坏以及物种共存过程直接依赖于水分空间分布及可利用性[7,27]。本文中,利用各物种在样方中多度、盖度、平均高度和频度值,比较了梭梭树冠内外灌木和草本植物的生长好坏状况。结果表明,在艾比湖流域荒漠梭梭林的植物生长季节内,在6,8,10月梭梭树冠下群落的灌木和草本植物的生长优势度多数高于非树冠下群落(表2)。这可能说明在水分限制的干旱区荒漠中,梭梭水力提升改善了其树冠下水分条件,使伴生灌木和草本植物能够获取更多水分,因而提高了它们的长势。但在本文中,在8月也存在叉毛蓬、侧花沙蓬和对节刺这3种短生草本植物在树冠下样方中生长优势度低于梭梭树冠外。这是因为在8月,这3种短生植物处于生活史末期,由于树冠下较阴凉,相对树冠外区域,当地放牧过程对树冠下区域的干扰较大,这使得大多数处于生活史末期、根系不发达的短生植物被牲畜啃食或破坏提前结束生活史,因而在样方调查时这3个物种个体数量较少,基于多度、盖度、平均高度和频度值计算的生长优势度较低(表2)。另外,对比梭梭树冠内外灌木和草本群落的丰富度和多度后发现,在植物生长季6,8,10月,梭梭树冠下群落灌木和草本植物的多度和丰富度均显著高于非树冠下群落(p<0.05)(图2)。这可能说明,梭梭水力提升将地下水或深层土壤水通过根系提升并释放到表层土壤中,增加了表层土壤中的水分含量,为浅根系灌木及草本提供更多的水资源,从而在一定程度上诱导浅根系植物在水力提升的区域富集,从而提高了树冠下群落灌木和草本植物的多度和丰富度[3,7,16-17,28]。
在水分极端缺乏的干旱区荒漠,任何对水分格局和水分输入有作用的过程都能够改变荒漠植物群落的物种分布和共存模式[7,26-27]。本文的研究结果证实,梭梭具有水力提升现象(图1),该现象可能对树冠下伴生浅根系灌木和草本的长势、多度、丰富度产生影响(图2和表1)。但有研究表明,植被覆盖率和遮阴所形成的“湿岛效应”也会影响土层间18O/16O值的分布[29-30],林冠植物的遮阴作用降低了土壤的蒸发量,使得树冠下土壤的水分含量相对树冠外较高,导致树冠层下土壤的δ18O值较低,即:树冠内外土壤蒸发量不同能够造成树冠内外土壤的δ18O值出现差别。为此,在本试验开展同时,在植物生长季的8月,我们采用土壤蒸散仪观测(EP255, NovalynxInc,美国)并进一步对比了梭梭树冠内外土壤蒸发量的差别。结果表明,梭梭树冠下蒸发皿的蒸发量虽低于树冠外,但两者未有显著性差异(梭梭树冠层下土壤蒸发量=0.83±0.46 cm/(m2·d),非树冠下土壤蒸发量=0.89±0.38 cm/(m2·d),t=-2.01,df=6,p=0.41)。这表明遮阴作用可能对树冠内外土壤的δ18O值差别的影响不大。这也从另一方面说明遮阳对当地浅根系植物多样性未有较大影响。这可能是因为: ①当地梭梭群落植被覆盖率不到4%,稀疏树冠的遮阴作用在树冠下并不明显; ②艾比湖湿地自然保护区位于阿拉山口风区的下风向,空气快速流动使得树冠内外土壤蒸发量无显著差异。但在另一方面,遮阴对土壤蒸发、以及浅根系植物多样性在整个植物生长季都存在影响,是一个长期过程,本文仅挑选8月为数不多几天判断林冠内外土壤蒸发量差别,时间较短。这在一定程度上设计有所不足,后期可通过遮阴试验等进一步验证。
5 结 论
在水分作为限制因子的干旱区荒漠中,深根系植物梭梭具有水力提升现象,它改善了水分在土壤中的分布格局,增加了表层土壤中的水分含量,为浅根系灌木及草本提供更多的水资源,从而使得梭梭树冠下的灌木和草本具有更好的长势。同时,梭梭的水力提升在一定程度上诱导浅根系植物在水力提升的区域富集,从而提高了树冠下群落灌木和草本植物的多度和丰富度[3,7]。相对在资源有限前提下,以往群落构建中基于种间竞争的生态位理论,本文中梭梭群落多样性维持过程可能依靠深根系植物水分利用策略的资源共享过程,这与前人研究有所差别。另外,在水力提升发生区域,富集长势更好的浅根植物意味着它们树冠可以截获更多矿质元素供深根系植物利用——“肥岛效应”[2,7,30-31]。这说明水力提升和“肥岛效应”这两个过程可能在深根系和浅根系植物间形成一个水分和营养的正反馈,共同维持了干旱区荒漠植物群落的多样性。但本文中仍然存在一些不足: ①梭梭树冠内外土壤蒸发量差别的观测时间太短,不能完全排除在长期过程中土壤蒸发对水分空间分布的影响; ②本研究仅用同位素示踪方法验证了梭梭的水力提升现象存在,但对梭梭根系提升水量以及提升水量占树冠下灌木和草本植物的水分利用比例,仍然未知; ③本研究虽提及深浅根植物间的水力提升、“肥岛效应”和“湿岛效应”在干旱区荒漠植物群落多样性维持中的作用,但仅限理论推测,未有试验证明。因此,在未来研究中,还应进一步利用同位素示踪技术,结合遮阴处理和水量的模型估算等方法对以上问题进行佐证。
[参考文献]
[1] Richards J H, Caldwell M M. Hydraulic lift: Substantial nocturnal water transport between soil layers byArtemisiatridentataroots[J]. Oecologia, 1987,73(4):486-489.
[2] Caldwell M M, Dawson T E, Richards J H. Hydraulic lift: Consequences of water efflux from the roots of plants [J].Oecologia, 1998,113(2):151-161.
[4] Prieto I, Martínez T K, Martínez M L, et al. Hydraulic lift through transpiration suppression in shrubs from two arid ecosystems: Patterns and control mechanisms[J]. Oecologia, 2010,163(4):855-865.
[5] Armas C, Padilla F M, Pugnaire F I, et al. Hydraulic lift and tolerance to salinity of semiarid species: Consequences for species interactions [J]. Oecologia, 2010,162(1):11-21.
[6] Dawson T E, Ehleringer J R. Streamside trees that do not use stream water[J]. Nature, 1991,350(6316):335-337.
[7] Yang Xiaodong, Zhang Xueni, Lü Guanghui, et al. Linking Populus euphratica hydraulic redistribution to diversity assembly in the arid desert zone of Xinjiang, China[J]. Plos One, 2014,9(10):e109071.
[8] 许皓,李彦,邹婷,等.梭梭(Haloxylonammodendron)生理与个体用水策略对降水改变的响应[J].生态学报,2007(12),27:5019-5028.
[9] 胡文康.准噶尔盆地南部梭梭荒漠类型、特征及其动态[J].干旱区研究,1984(2):30-40.
[10] 胡式之.中国西北地区的梭梭荒漠[J].植物生态学与地植物学丛刊,1963(z1):83-111.
[11] 杨晓东.胡杨.梭梭的植物根系—土壤水分再分配及调控机理[D].新疆 乌鲁木齐:新疆大学,2011.
[12] Jackson L, Strauss R, Firestone M, et al. Influence of tree canopies on grassland productivity and nitrogen dynamics in deciduous oak savanna [J]. Agriculture, Ecosystems & Environment, 1990,32(1/2):89-105.
[13] 杨晓东,吕光辉.新疆艾比湖湿地自然保护区胡杨根系水分再分配的估算[J].植物生态学报,2011,35(8):816-824.
[14] Meinzer F C, Andrade J L, Goldstein G, et al. Partitioning of soil water among canopy trees in a seasonally dry tropical forest[J]. Oecologia, 1999,121(3):293-301.
[15] 马辉英,杨晓东,吕光辉,等.新疆艾比湖湿地自然保护区荒漠优势种体内的水分来源[J].生态学报,2017,37(3):829-840.
[16] Belsky A, Amundson R, Duxbury J, et al. The effects of trees on their physical, chemical and biological environments in a semi-arid savanna in Kenya [J]. Journal of Applied Ecology, 1989,26(3):1005-1024.
[17] Maestre F T, Bautista S, Cortina J. Positive, negative, and net effects in grass-shrub interactions in Mediterranean semiarid grasslands [J]. Ecology, 2003,84(12):3186-3197.
[18] Sardans J, Peuelas J. Hydraulic redistribution by plants and nutrient stoichiometry:Shifts under global change[J]. Ecohydrology, 2014,7(1):1-20.
[19] Adams R I, Goldberry S, Whitham T G, et al. Hybridization among dominant tree species correlates positively with understory plant diversity [J]. American Journal of Botany, 2011,98(10):1623-1632.
[20] Armas C, Pugnaire F I. Plant interactions govern population dynamics in a semi-arid plant community [J]. Journal of Ecology, 2005,93(5):978-989.
[21] 杨晓东,吕光辉,田幼华,等.新疆艾比湖湿地自然保护区植物的生态分组[J].生态学杂志,2009,28(12):89-94.
[22] 杨晓东,吕光辉,张雪梅,等.艾比湖湿地自然保护区8个乔灌木种群空间分布格局分析[J].植物资源与环境学报,2010,19(4):37-42.
[23] 杨军,傅德平,杨晓东,等.艾比湖湿地自然保护区典型群落物种多样性分析[J].干旱区资源与环境,2010,24(2):145-149.
[24] 张金屯.数量生态学[M].北京:科学出版社,2011.
[25] Dawson T E, Mambelli S, Plamboeck A H, et al. Stable Isotopes in Plant Ecology [J]. Annual Review of Ecology & Systematics, 2002,33(1):507-559.
[26] Polis G A. The ecology of Desert Communities [M]. US: Ecology of Desert Communities, 1991.
[27] 李新荣,何明珠,贾荣亮.黑河中下游荒漠区植物多样性分布对土壤水分变化的响应[J].地球科学进展,2008,23(7):685-691.
[28] Callaway R M. Positive interactions among plants [M]. The Botanical Review, 1995,61(4):306-349.
[29] Allison G B, Barnes C J, Hughes M W. The distribution of deuterium and18O in dry soils(2): Experimental[M]. Journal of Hydrology, 1983,64(1/4):377-397.
[30] Segoli M, Ungar E D, Shachak M. Fine-scale spatial heterogeneity of resource modulation in Semi-Arid“islands of fertility”[J]. Arid Land Research & Management, 2012,26(4):344-354.
[31] Schade J D, Hobbie S E. Spatial and temporal variation in islands of fertility in the Sonoran Desert [J]. Biogeochemistry, 2005,73(3):541-553.

