复元醒脑汤对糖尿病脑梗死模型大鼠梗死体积的影响及其分子机制研究
沈俊逸 赵智明 刘春丽 壮雨雯 徐文俊 蔡 辉
(南京军区南京总医院中西医结合科,江苏南京210002)
脑梗死因高发病率、高致残率、高死亡率及高复发率与心脏病、恶性肿瘤组成人类的三大死亡病因,给人类的健康造成极大的威胁[1]。糖尿病并发脑梗死是糖尿病最常见的血管并发症[2]。microRNAs是一类具有转录后调节活性的内源性单链小分子RNA,长约19~25bp,具有高度保守、非编码、短序列等特性,在转录后阶段调控相关靶基因蛋白质的表达。越来越多的研究结果显示microRNAs与糖尿病的发生发展及预后转归密切相关[3-4]。miR-320还可以抑制血管生成,其抑制剂有可能成为一种治疗糖尿病及其慢性并发症的有效药物。miR-320的靶点包括VEGF、bFGF、IGF-1及其受体IGF-1R在内的多种生长因子及其受体[5]。miR-320负性调控IGF-1及其受体IGF-1R,对糖尿病诱发的血管病变有重要影响。我们在前期研究中发现,中药复原醒脑汤可以减轻胰岛素抵抗,促进血管新生因子VEGF以及SDF-1、CXCR4的表达,促进血管新生,减少脑梗死体积[6-7],但是复原醒脑汤对miR-320的表达以及相关靶点的影响还未得到证实。本研究制作糖尿病脑梗死大鼠模型,观察复原醒脑汤对模型大鼠缺血脑组织miR-320以及IGF-1表达的影响,以期从microRNAs对基因表达调控作用途径阐述复元醒脑汤促进糖尿病脑梗死缺血区血运重建的分子机制与有效作用靶点。
1 实验材料
1.1 动物 150只健康雄性SD大鼠,体质量(250±25)g,购自上海杰思捷实验动物有限公司,动物合格证号:SCXK(沪)2011-009。
1.2 药物与试剂 TTC染色液(2%)购于上海远慕生物科技有限公司;蛋白浓度BCA法测定试剂盒购于美国Thermo公司;肝素钠、SDS-PAGE凝胶配制试剂盒、组织裂解液(RIPA)和ECL化学发光试剂盒购于上海市碧云天生物技术有限公司;Anti-IGF1抗 体,Anti-IGF1 Receptor抗 体 和Anti-GAPDH抗体购于美国abcam公司;RNA抽提试剂盒购于美国ZYMO RESEARCH公司;反转录试剂盒购于Takara公司(大连宝升生物)。复元醒脑汤,药物组成:人参10g(单煎),三七10g,石菖蒲12g,水蛭10g,益母草30g,生南星15g,制大黄9g(后下),浓度388g/L,由上海中医药大学附属龙华医院药剂科制备。
1.3 主要仪器 实时荧光定量PCR仪(Thermo Fisher,美国),化学发光成像系统(天能化学发光成像系统,Tanon-5200Multi),正置显微镜(OLYMPUS,日本),透射电镜(日本电子,JEM-2000EX)。
2 实验方法
2.1 分组与造模 将实验大鼠按随机数字表法随机分为正常组、假手术组、模型组、西药组、中药组,每组30只。糖尿病模型制作:模型组、西药组和中药组大鼠腹腔注射链脲佐菌素(STZ,美国Sigma公司)50mg/kg,随后采用高糖高脂肪食物饲养2周复制糖尿病大鼠模型,连续1周测量血糖大于16.6mmol/L为造模成功。脑梗死模型制作:将3/0单股尼龙线,置于肝素钠中浸泡;用10%水合氯醛(0.35mL/100g)麻醉大鼠,在颈部正中偏右侧行竖直切口,剥离出右侧颈总动脉(CCA)、颈内动脉(ICA)和颈外动脉(ECA);结扎ECA起始端和CCA近心端,用眼科剪在CCA远心端和近心端之间剪一个小口距离颈总动脉分叉5mm,经CCA插入3/0尼龙线至大脑中动脉起始段,深度为(18.5±0.5)mm;维持体温(37.0±0.5)℃;用乙醚再次麻醉大鼠,术后2h把尼龙线轻拔退1cm,作为再灌注0h。正常组不作任何处理;假手术插线深度为10mm,余同造模大鼠。脑梗死造模死亡率为37%,根据评分Berderson(≥1)鉴定造模成功[8],本实验中动物处理方法符合动物伦理学标准。模型组、假手术组、西药组和中药组每组随机挑选成模的15只大鼠,正常组也随机挑选15只正常大鼠进行研究。
2.2 药物干预 根据临床经验,参照陈奇主编《中药药理实验方法学》依实验动物与人体表面积比计算,中药组每日按10.4g/kg体重给予复元醒脑汤灌胃,西药组每日以二甲双胍27mg/kg体重和尼莫地平2.16mg/kg体重灌胃,正常组、假手术组、模型组均给予等容量的生理盐水灌胃,每日2次,连续14d。
2.3 检测指标
2.3.1 脑梗死体积测定 各组大鼠治疗14d后用10%水合氯醛腹腔注射深度麻醉(每组7只),放血,打开颅骨,取出完整的脑组织,用刀片将脑切成6片2mm左右厚度,用2%TTC染色液37℃中避光染色30min[9],拍照并用ImageJ软件分析各组大鼠脑组织梗死体积。
2.3.2 缺血脑组织病理形态学观察 治疗后每组取4只大鼠,深度麻醉后进行心脏灌流,断头取脑组织。每组2只大鼠进行脑组织HE染色,用多聚甲醛(4%)固定,进行组织梯度脱水,包埋,病理切片,染色和封片,于正置显微镜下观察并拍照。每组另外2只大鼠进行透射电镜观察,将大鼠脑组织用2.5%戊二醛固定,树脂包埋,超薄切片和染色,于透射电镜下观察脑缺血后皮质微血管超微结构的改变。
2.3.3 缺血脑组织miR-320基因表达水平及IGF-1、IGF-1R蛋白表达水平检测 治疗后各组大鼠取3只,用10%水合氯醛腹腔注射深度麻醉,快速断头冰上取脑,剪开颅骨取得脑组织。分离出脑梗死组织(正常组与假手术组取全脑组织),根据中心线位置一分为二,一半加入RNA抽提试剂进行组织匀浆,并抽提RNA,利用反转录试剂盒反转录为cDNA。采用实时荧光定量PCR仪进行定量PCR(QPCR)检测缺血脑组织miR-320、IGF-1、IGFR和GAPDH的基因表达水平。引物序列,MiR-320-F:ACACTCCAGCTGGGACTTAAACGTGGTTG TAC;MiR-320-R:TGTCGTGGAGTCGGCAATTC;IGF-1-F:ACTCGATAACTTTGCCAGAAGAG;IGF-1-R:TTCTTGTGTGTCGATAGGGGC;IGF-1R-F:TAGTGGGTGTGTTGCCACC;IGF-1R-R:TCCACCGTGTTGCAAGACTAG;内 参 基因GAPDH-F:ACTTTGGCATCGTGGAAGGG;GAPDH-R:TGCAGGGATGATGTTCTGGG。另一半脑梗死组织采用Western方法,加入组织裂解液(RIPA)进行脑组织匀浆,离心后(12000r/min,5min)用BCA试剂盒定量蛋白浓度,进行SDS-PAGE电泳,PVDF转膜,4℃孵育一抗(IGF-1、IGF-1R)过夜,室温孵育二抗1h,在化学发光成像系统下用ECL化学发光试剂盒显影检测缺血脑组织IGF-1、IGF-1R蛋白表达水平[9]。
2.4 统计学方法 实验数据使用SPSS 16.0进行分析,各实验组数据差异性均以(±s)表示,P<0.01表示存在统计学差异,不同组之间的比较采用One-ANOVA分析,组内比较用LSD方法。
3 实验结果
3.1 各组大鼠脑组织梗死体积比较 正常组织被染成红色,梗死区域为苍白色。从TTC染色图片中可见,梗死范围主要位于额叶、顶叶、部分颞叶皮质、背侧丘脑、内囊和纹状体等大脑中动脉支配区域,见图1。正常组和假手术组大鼠的脑组织无梗死灶;模型组、西药组和中药组均有明显的脑梗死病灶,其中西药组和中药组脑组织的梗死范围均小于模型组。模型组脑梗死体积(175±19)mm3,西药组脑梗死体积(148±21)mm3,中药组脑梗死体积(132±15)mm3,正常组与假手术组脑梗死体积均为0。各组脑梗死体积比较,模型组和假手术组比较有极显著性差异(P<0.01),中药组、西药组大鼠脑梗死体积明显小于模型组(P<0.01),中、西药组组间比较差异无统计学意义(P>0.05)。
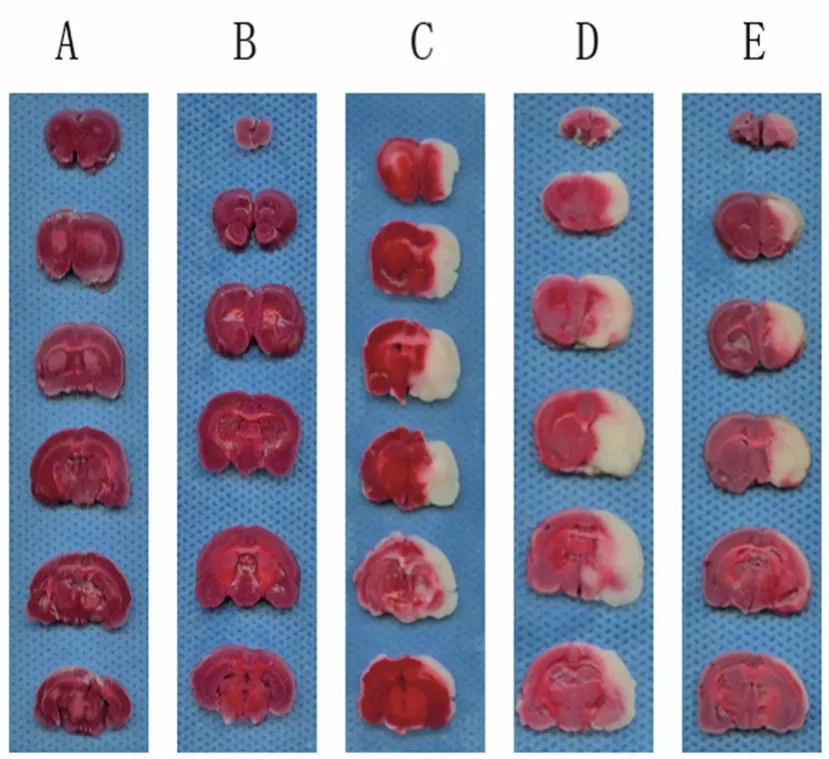
图1 各组大鼠脑组织梗死情况
3.2 各组大鼠脑组织病理形态学比较
3.2.1 HE染色 见图2。正常组细胞排列整齐,细胞核居中,染色较深,数量较多,细胞质的染色较为均一,没有出现细胞变性和坏死的现象。假手术组出现了细胞核固缩的现象,细胞质染色欠均匀,细胞有轻微损伤。模型组细胞之间的间隙增大,排列紊乱,细胞核固缩、破裂甚至消失,胞浆染色不均一,出现水肿现象,有明显的细胞变性和坏死。西药组和中药组细胞排列趋向于规则、有序,细胞核固缩和弥散现象减弱,胞浆染色较模型组均匀,细胞损伤明显得到改善。
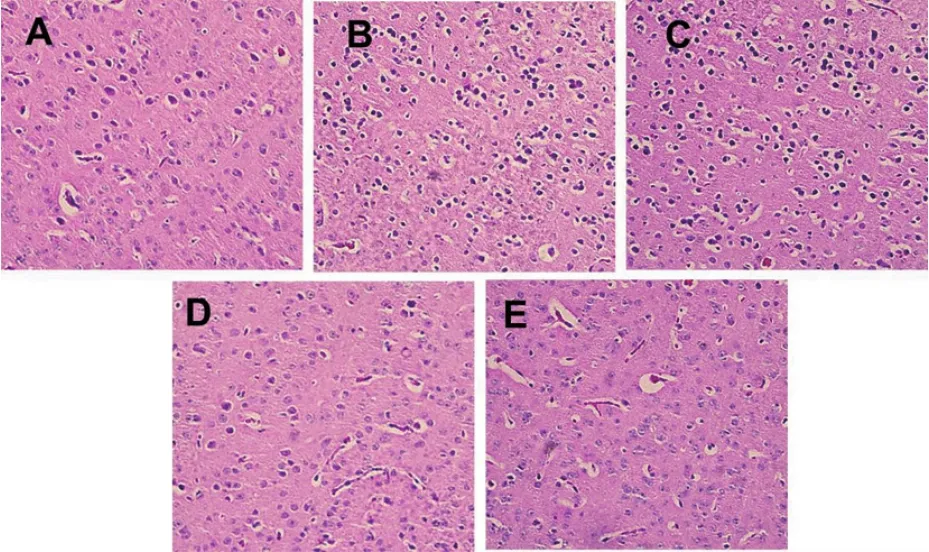
图2 各组大鼠脑组织病理改变(HE染色,400×)
3.2.2 透射电镜观察 见图3。正常组脑皮质微血管的血管壁厚,电镜下染色深,血管内皮细胞之间紧密连接,基底膜紧密连接。假手术组的血管连接比较紧密,细胞核染色较深,未出现明显的细胞器损伤。模型组的细胞连接疏松,血管细胞壁比较薄,胞核弥散。西药组、中药组与模型组相比管壁相对增粗,血管内皮细胞的胞质水肿减轻,胞核弥散减轻,紧密连接逐渐恢复规则化,基底膜疏松减弱。
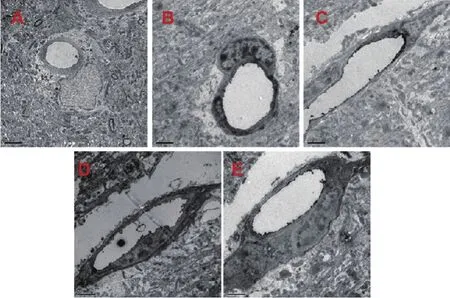
图3 各组大鼠脑皮质微血管形态(Bar值为2μm)
3.3 各组大鼠缺血脑组织miR-320、IGF-1、IGF-1R基因表达水平比较 采用实时荧光定量PCR技术检测各组大鼠缺血脑组织miR-320、IGF-1、IGF-1R基因表达水平,结果见表1。模型组与假手术组比较miR-320基因的表达水平显著升高(P<0.01),IGF-1 mRNA表达水平显著降低(P<0.01);与模型组比较,西药组和中药组miR-320基因表达水平显著降低(P<0.01),IGF-1 mRNA表达水平显著升高(P<0.01);中药组、西药组组间比较差异无统计学意义(P>0.05)。可见缺血脑组织中miR-320表达上调,IGF-1的mRNA表达下调,而复元醒脑汤和西药都能有效调节缺血脑组织中的miR-320基因和IGF-1 mRNA表达,中、西药效果相近。与假手术组比较,模型组大鼠缺血脑组织IGF-1R mRNA表达无统计学差异(P>0.05)。

表1 各组大鼠缺血脑组织miRNA-320、IGF-1、IGF-1R基因表达水平比较
3.4 各组大鼠缺血脑组织IGF-1、IGF-1R蛋白表达水平比较 采用Western blot分析方法检测各组大鼠缺血脑组织IGF-1、IGF-1R蛋白表达水平,结果见图4、表2。模型组IGF-1蛋白表达水平显著低于假手术组和正常组(P<0.01),西药组和中药组IGF-1的蛋白表达水平均显著高于模型组(P<0.01),中药组显著高于西药组(P<0.01)。可见缺血脑组织中IGF-1蛋白表达下调,经复元醒脑汤或西药治疗都能部分恢复其表达,中药的疗效显著优于西药。与假手术组比较,模型组IGF-1R的蛋白表达无统计学差异(P>0.05)。

图4 各组大鼠缺血脑组织IGF-1、IGF-1R蛋白表达

表2 各组大鼠缺血脑组织IGF-1、IGF-1R蛋白表达比较
4 讨论
现代医学认为糖尿病是脑梗死的一个独立危险因素,糖尿病患者发生脑梗死的概率是非糖尿病患者的2~4倍。脑梗死发生的主要原因是动脉粥样硬化,高血糖促进动脉粥样硬化的发展,致使糖尿病患者脑动脉粥样硬化发生率约为70%。此外,高血糖也可导致凝血系统的改变,促进血栓形成,引发并加重动脉粥样硬化。尼莫地平为二氢吡啶类钙离子拮抗剂,易透过血脑屏障,几乎不影响外周血管,但能高度特异性作用于脑血管,抑制钙离子进入血管平滑肌细胞,扩张脑血管,增加缺血脑组织的血液供应。尼莫地平可抑制钙离子进入神经元,显著降低神经元游离钙水平,减轻钙超负荷引起的神经元毒性损害,可有效地预防和治疗脑血管痉挛引起的缺血性脑神经损伤。二甲双胍具有独立于降糖外的血管保护作用,通过对患者糖脂代谢的调节,使体内游离Ca2+浓度降低,通过刺激外周组织吸收葡萄糖,舒张血管平滑肌,有效改善胰岛素抵抗,并可起到控制血压的作用。临床使用二甲双胍联合尼莫地平治疗糖尿病脑梗死具有良好的效果。
中医认为糖尿病并发脑梗死属于“消渴并发中风”的范畴,多由元气虚弱,肾元亏虚,形神俱伤,酿生痰瘀,致瘀阻脉络,痰热生风,治疗中我们坚持以扶持元气为主,联合逐瘀化痰、泄热息风通络,拟复元醒脑汤。本方可以恢复机体平衡,扶正祛邪,使局部及整体的血气调和,治疗缺血性中风,在减轻脑水肿程度,改善神经功能恢复、胰岛素抵抗以及调节血管内皮细胞生长因子VEGF的表达等方面取得显著效果。本研究发现复元醒脑汤与西药都具有良好的脑梗死治疗效果,能够显著减少脑梗死体积,促进脑梗死区域血管新生和微循环的作用。机体在高血糖的状态下,内皮细胞中miR-320的表达显著增加[10],IGF-l蛋白由于受miR-320的负调控而表达降低[11]。IGF-1是一种重要的神经保护多肽,IGF-1及其受体均广泛分布于脑组织[12],IGF-1在脑组织中的表达正常对于缺血脑组织神经的恢复有重要意义[13-14]。本研究结果表明,复元醒脑汤和西药都能显著提高梗死脑组织中IGF-1的表达量,显著降低miR-320基因表达。
综上,复元醒脑汤对糖尿病脑梗死模型大鼠脑梗死的改善作用可能与其降低miR-320的表达同时促进IGF-1的高表达有关。本研究丰富了复元醒脑汤治疗糖尿病脑梗死在血管新生方面的机制,为进一步探索糖尿病脑梗死的病理机制、制定防治策略及新药研发提供了一条全新的途径。
参考文献
[1]ROGER V L,GO A S,LLOYD-JONES D M,et al.Executive summary:heart disease and stroke statistics—2012 update:a report from the American Heart Association[J].Circulation,2012,125(1):188.
[2]VAN ROOIJ E.The art of microRNA research[J].Circ Res,2011,108(2):219.
[3]FENG B,CHAKRABARTI S.miR-320 Regulates Glucose-Induced Gene Expression in Diabetes[J].ISRN Endocrinol,2012:549875.
[4]AL-JAMAL K T,GHERARDINI L,BARDI G,et al.Functional motor recovery from brain ischemic insult by carbon nanotube-mediated siRNA silencing[J].Proc Natl Acad Sci USA,2011,108(27):10952.
[5]张丹丹,沈静,刘芳.微小RNA与糖尿病血管新生[J].国际内分泌代谢杂志,2013,33(1):40.
[6]沈俊逸,方邦江,凌丽,等.复元醒脑汤对糖尿病脑梗死大鼠脑组织SDF-1、CXCR4、VEGF基因及蛋白表达作用的研究[J].中国中医急症,2016,25(8):1457.
[7]方邦江,周爽,沈俊逸,等.复元醒脑汤对糖尿病脑梗塞大鼠胰岛素抵抗干预作用的实验研究[J].成都医学院学报,2012,7(3):374.
[8]刘恒涛.地黄饮子治疗对脑缺血大鼠行为学评分的影响[J].中西医结合心脑血管病杂志,2017,15(2):168.
[9]ZHANG L,GENG X,ZHOU J,et al.Fabrication of poly(γ-glutamic acid)-based biopolymer as the targeted drug delivery system with enhanced cytotoxicity to APN/CD13 over-expressed cells[J].J Drug Target,2015,23(5):453.
[10]YAN H,MITSCHELEN M,TOTH P,et al.Endothelin-1-induced focal cerebral ischemia in the growth hormone/IGF-1 deficient Lewis Dwarf rat[J].J Gerontol A Biol Sci Med Sci,2014,69(11):1353.
[11]SHANTIKUMAR S,CAPORALI A,EMANUELI C.Role of microRNAs in diabetes and its cardiovascular complications[J].Cardiovasc Res,2012,93(4):583.
[12]LI C,CHE L H,SHI L,et al.Suppression of Basic Fibroblast Growth Factor Expression by Antisense Oligonucleotides Inhibits Neural Stem Cell Proliferation and Differentiation in Rat models With Focal Cerebral Infarction[J]. J Cell Biochem,2017,118(11):3875.
[13]WANG X H,QIAN R Z,ZHANG W,et al.MicroRNA-320 expression in myocardial microvascular endothelial cells and its relationship with insulin-like growth factor-1 in type 2 diabetic rats[J].Clin Exp Pharmacol Physiol,2009,36(2):181.
[14]ZHANG L,WANG T,LI Q,et al.Fabrication of novel vesicles of triptolide for antirheumatoid activity with reduced toxicity in vitro and in vivo[J].Int J Nanomedicine,2016,11:2663.

