中国温带和亚热带8个树种叶和吸收根协同分解
范萍萍, 吕美蓉, 李雪莹, 石小梅, 吕 婧
山东省科学院海洋仪器仪表研究所,青岛 266061
植物是否以整体协同的方式进行分解,将极大影响其在生态系统碳循环中的物种效应[1],而这决定于地上-地下关系[2- 5]。叶和细根(<2mm)作为树木周转最快的部分,是森林生态系统的分解主体。由于根-叶分解关系研究太少,叶和细根是否在不同物种间协同分解还存在较大不确定性[2- 8]。
根据进化理论或者植物整体经济学理论(whole-plant economics theory),叶和细根的分解应该正相关[2,9- 11]。进化上,自然选择会使叶和细根协同分解[2,9- 10],比如,植物在贫瘠的土壤中,会选择低养分含量的叶和根,从而具有较慢的分解速率。近年提出的植物整体经济学理论,认为“快”植物具有快速周转的叶和根[9- 11],从而形成正相关的根-叶分解关系[3,10]。确实,正相关的根-叶分解关系在全球尺度上得到印证,然而,具体到某一生态系统,叶和细根的分解很少相关[3]。
叶和细根分解关系的不确定性可能主要来源于细根内部高度的异质性。已有研究中,直径<2mm的所有根都被定义为细根[2- 3,7]。然而,细根内部在化学性质[12- 13]和寿命[14- 15]上存在高度异质性,分解过程也不同[16- 18]。在细根中,位于末梢的1级根或者细根根枝在功能上同叶类似[19- 20],是真正的吸收根[21]。因此,首先要确定叶和吸收根的分解过程是否在不同生态系统间正相关。
理论上,根-叶分解关系部分决定于控制根、叶分解的化学性质是否相同或相关[2]。比如,已有研究报道根-叶分解正相关是因为根、叶分解速率都与相同的凋落物性质高度相关[7- 9]。按照相同的逻辑,根-叶分解不相关主要是因为影响根、叶分解的化学性质不同或者不相关[2,4]。因此,第二个目的是确定根-叶分解的相关关系是否因为控制根、叶分解的化学性质相同或相关。
为此,本研究通过埋包法,分别在我国黑龙江帽儿山(温带森林)和广东鹤山(亚热带森林)、对4个针叶树种和4个阔叶树种进行了为期2a的叶和吸收根的分解实验。本研究将主要弄清以下问题:1)根、叶分解速率及N释放格局是否正相关;2)影响根-叶分解关系的因素有哪些?
1 材料与方法
1.1 研究区概况
分别在东北林业大学帽儿山森林生态站(45°23′N, 127°32′E)和中国科学院华南植物园鹤山森林生态站(22°41′N, 112°54′E)进行叶和根的分解实验。帽儿山森林生态站的年均温为2.8℃和年均降水量为723nm,土壤是富饶的森林暗棕壤,土壤厚度大于50cm,表层(0—10cm)土壤有机质含量大于10%[22]。这里,落叶松(Larixgmelinii)、云杉(Piceakoraiensis)、黄波罗(Phellodendronamurense)、水曲柳(Juglansmandshurica)是优势树种,其单一种人工林种植于1986年。叶凋落物和根样品均分别采自这4个人工林(表1)。
鹤山森林生态站年均温21.7℃,年均降水量1801nm。土壤属于强淋溶土,质地属于砂质黏壤,表层土壤有机质含量约2.0%[23]。这里,杉木(Cunninghamialanceolata)、马尾松(Pinusmassoniana)、西南荷(Schimawallichi)、柠檬按(Eucalyptuscitriodora)是优势树种,其单一种人工林种植于1983年。叶凋落物和根样品均分别采自这4个人工纯林(表1)。
1.2 野外分解实验
使用埋包法研究凋落物分解。2007年4月底5月初,用土块法从上层矿质土壤中采集根枝。把根枝带回实验室,用低温蒸馏水洗掉泥土,然后进行分级。最末端的根尖为1级根,2个1级根交汇形成2级根,2个2级根交汇形成3级根,以此类推。根据长期实地观测,发现根的死亡同叶类似,是以根枝(模块)的形式进行的[20],因此,本研究所使用的细根根枝主要是由前3级根构成的完整根枝。叶凋落物通过凋落物回收袋于2007年10月份收集。所有的叶凋落物和根枝样品都进行风干,风干重约1.0g的样品放入10cm×10cm的尼龙袋中,网孔0.1mm。网孔0.1mm并未显著影响叶的分解速率[20]。
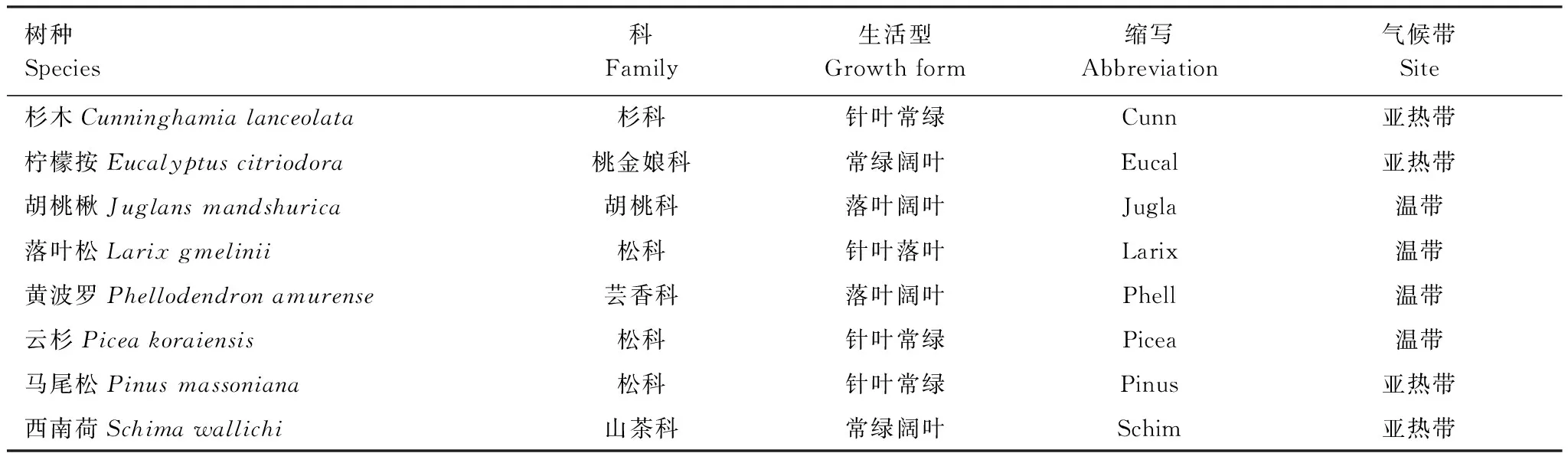
表1 本研究的8个树种
分别于2007年10月20日和2007年11月12日,在帽儿山森林生态站和鹤山森林生态站的4个树种的纯林中埋包,根、叶分别包埋。分解包埋藏在样品采集区域,并将持续2a的分解。但由于胡桃楸、荷木及柠檬按的根较难采集,所以样品量仅够维持1a的分解。根分解包埋藏在土壤5cm中,为保持相同的分解环境,叶分解包也埋在土壤5cm中;同时为模拟叶的自然分解状态,叶分解包还放在凋落物下土壤之上(土壤0cm)。分别在埋包后的203天(2008年5月10日)、274天(2008年7月20日)、357天(2008年10月11日)、566天(2009年5月8日)、725天(2009年10月14日)收集帽儿山森林生态站的分解包,分别在152天(2007年4月12日)、259天(2008年7月28日)、367天(2008年11月13日)、516天(2009年4月11日)、747天(2009年11月28日)收集鹤山森林生态站的分解包,每个样品类型收集4个分解包。尽可能剔除包内样品的土壤和杂质,65℃烘干,称重,研磨过筛,用其中少量样品测定灰分含量(550℃ 烘4h),校正分解结果。
1.3 化学分析
由于生物量组分、总N含量、C/N主要控制本研究树种的前5级根和叶凋落物的分解速率[18],因此本研究使用的凋落物性质包括生物量组分、总N含量、C/N。其中,C、N含量通过美国铂金埃尔默2400II元素分析仪测定。生物量组分包括可提取组分、酸溶组分和酸不溶组分3部分,按照Xiong等的方法[18]。300mg样品首先经过氯仿甲醇(体积比2∶1)提取2h,过滤,烘干滤渣,称重;然后,滤渣经72%的硫酸溶液溶解3h,过滤,烘干滤渣,称重;最后,测定滤渣灰分(550℃烘4h),用于校正3个组分的含量。其中,可提取组分是溶于氯仿甲醇的部分,酸溶组分是不溶于氯仿甲醇但溶于浓硫酸的部分,酸不溶组分是既不溶于氯仿甲醇也不溶于浓硫酸的部分。
1.4 数据处理
使用负指数模型y=e-kt(k是分解常数,单位a-1)描述分解过程中的生物量变化。通过Pearson相关分析比较了叶和吸收根(1级根与细根根枝)的分解速率及N剩余,及叶和吸收根的初始化学的相关关系。通过t检验比较了叶和吸收根的初始化学的差异。所有数据分析都在SPSS 13.0中进行。
2 结果与分析
2.1 分解速率
同已有研究结果相同,8个树种的叶的分解速率均高于其吸收根(表2);除黄波罗外,帽儿山(温带气候)的其他3个树种的叶的分解速率均比鹤山(亚热带气候)4个树种的低(表2)。虽然黄波罗生长在温带气候下,黄波罗的叶和吸收根均具有最高的分解速率(表2)。除了西南荷与柠檬按,其他树种的表层叶分解速率均高于土壤中叶的分解速率,虽然在个别树种中差异较小(表2)。1级根的分解速率均小于前3级根组成的细根根枝的分解速率,虽然在个别树种中差异较小(表2)。
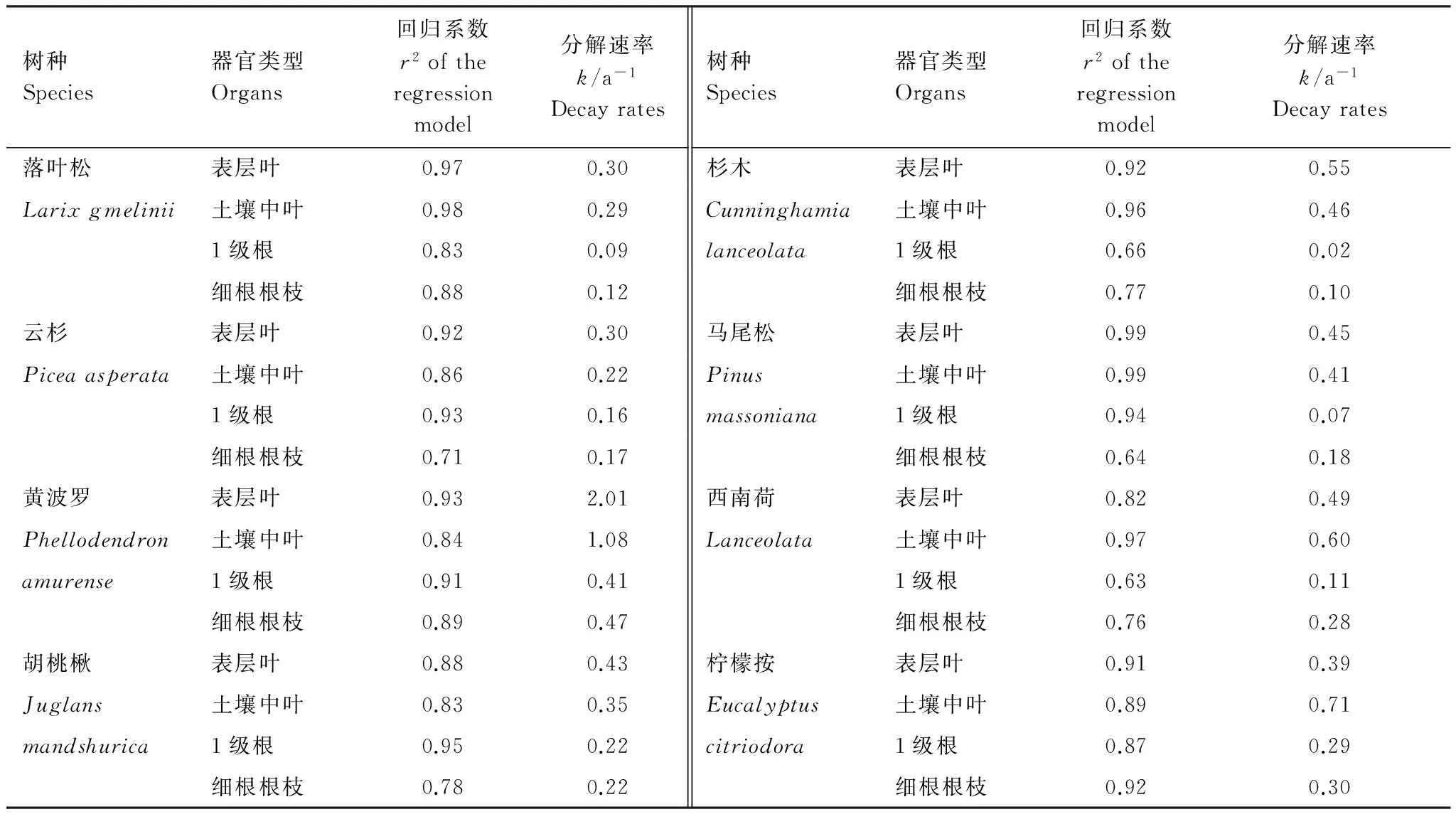
表2 本研究的8个树种的叶和吸收根的分解速率 (k, a-1)
总体上,叶分解速率高的树种,其吸收根的分解速率也相应的高,这与根叶分解速率具有正相关的关系一致(图1)。相比在表层分解的叶,在土壤中分解的叶与吸收根的相关系数大(图1);相比1级根,细根根枝与叶的分解速率相关系数更大、更显著(图1)。可见,叶的分解环境与吸收根的类型能够影响根-叶分解关系。土壤中叶与细根根枝的分解速率在多个水平上高度正相关(图1d),无论8个树种整体分析(r2=0.75,P=0.01),还是区分气候带(温带:r2=0.85,P=0.06;亚热带:r2=081,P=0.02)或植物生活型(阔叶树种:r2=0.91,P=0.02)。
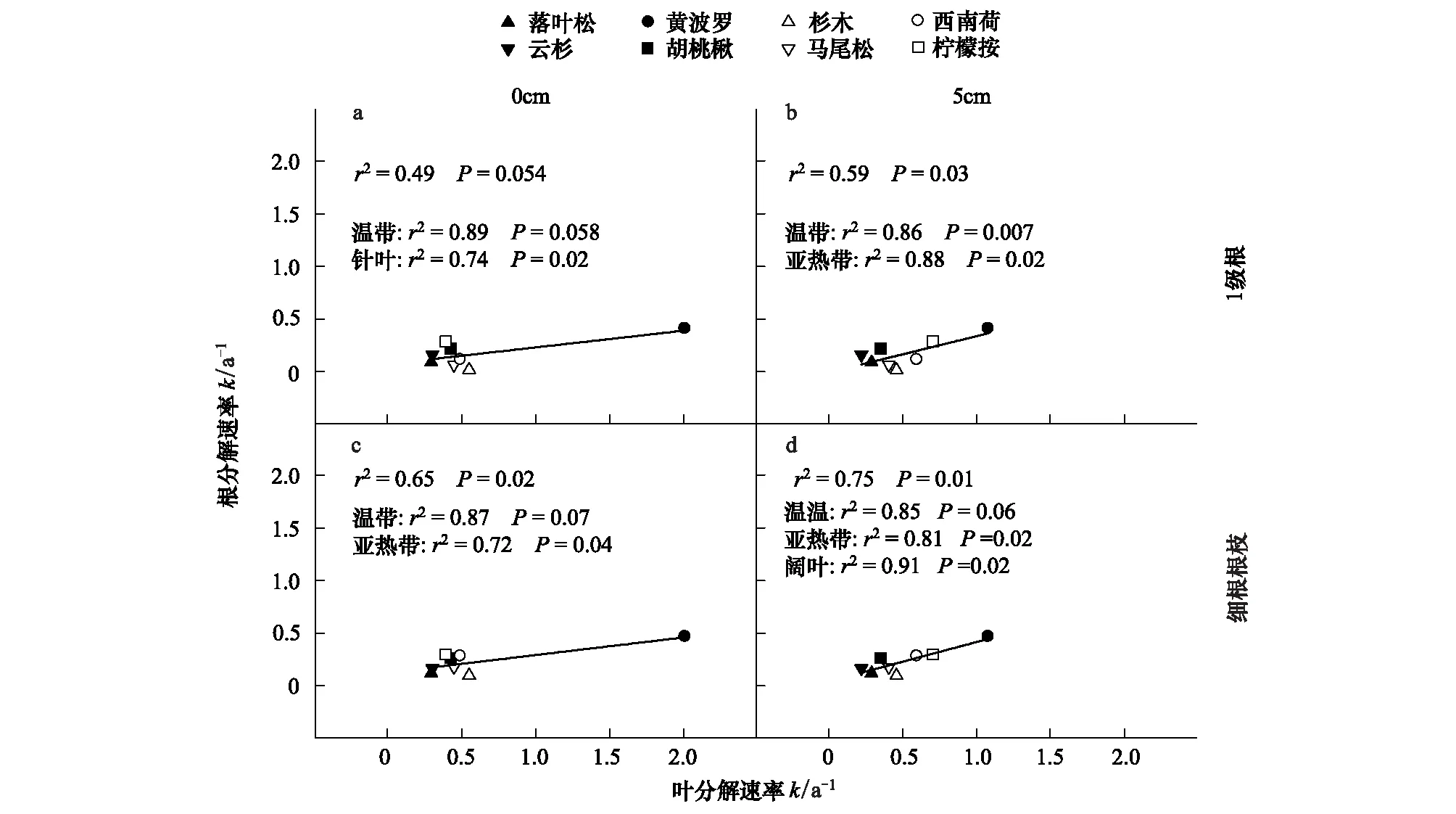
图1 根、叶分解速率关系Fig.1 Relationships of decay rates between leaf litter decomposed at different soil depth and absorptive roots
2.2 氮释放格局
根、叶的N剩余量并不相关。经过1a的分解,叶和吸收根的N剩余量在整体上无相关关系(图2),不过,亚热带(鹤山)的4个树种间,叶和细根根枝的N剩余量显著高度正相关(图2c—d)。经过2年的分解,叶N剩余量与吸收根的N剩余量在整体上也不相关(图3),但是,温带的3个树种间,表层叶与1级根的N剩余量显著高度正相关(图3)。
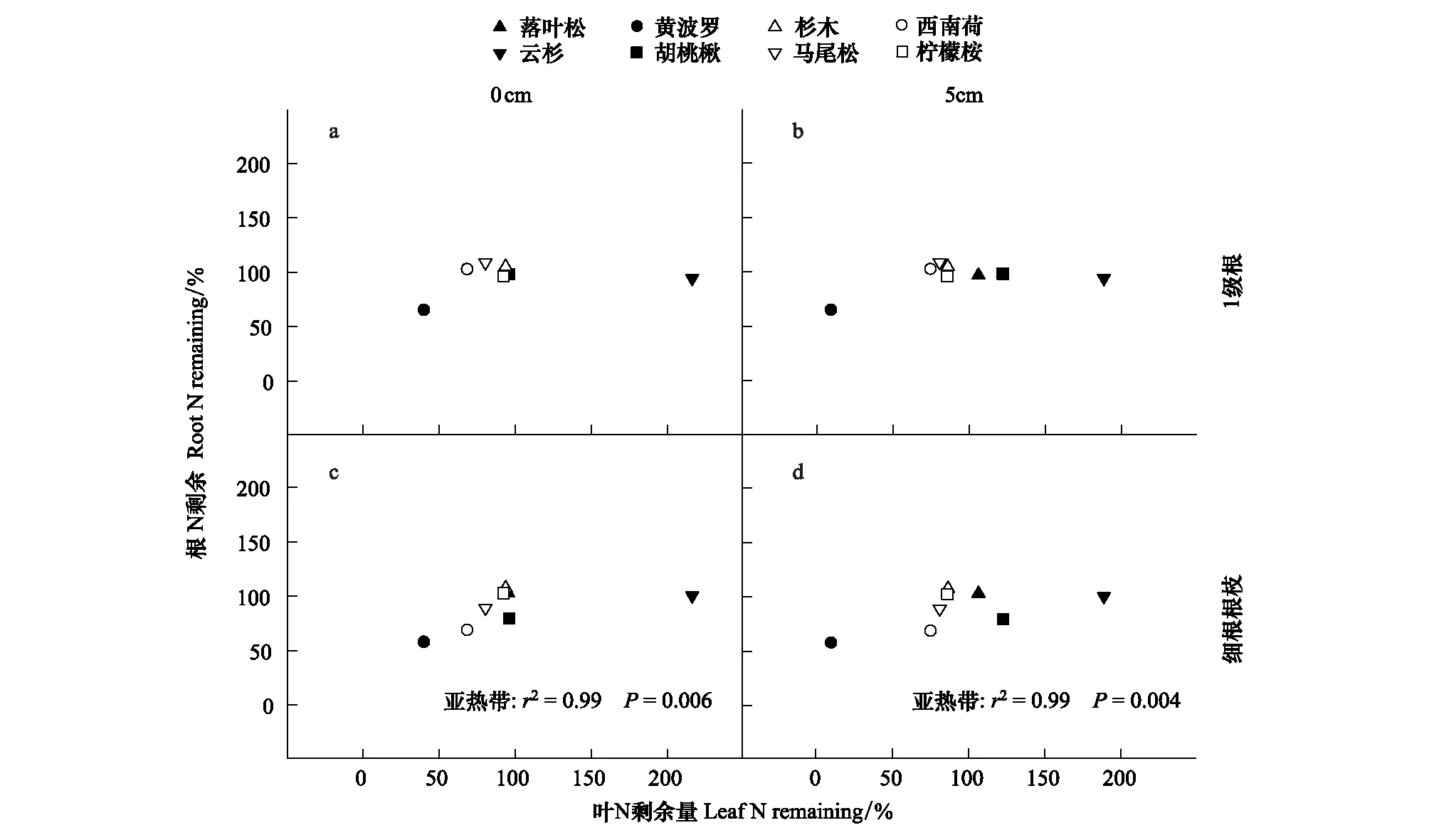
图2 根、叶分解1a后的N剩余量关系Fig.2 Relationships of N remaining after 1y between leaf litter decomposed at different soil depth and absorptive roots
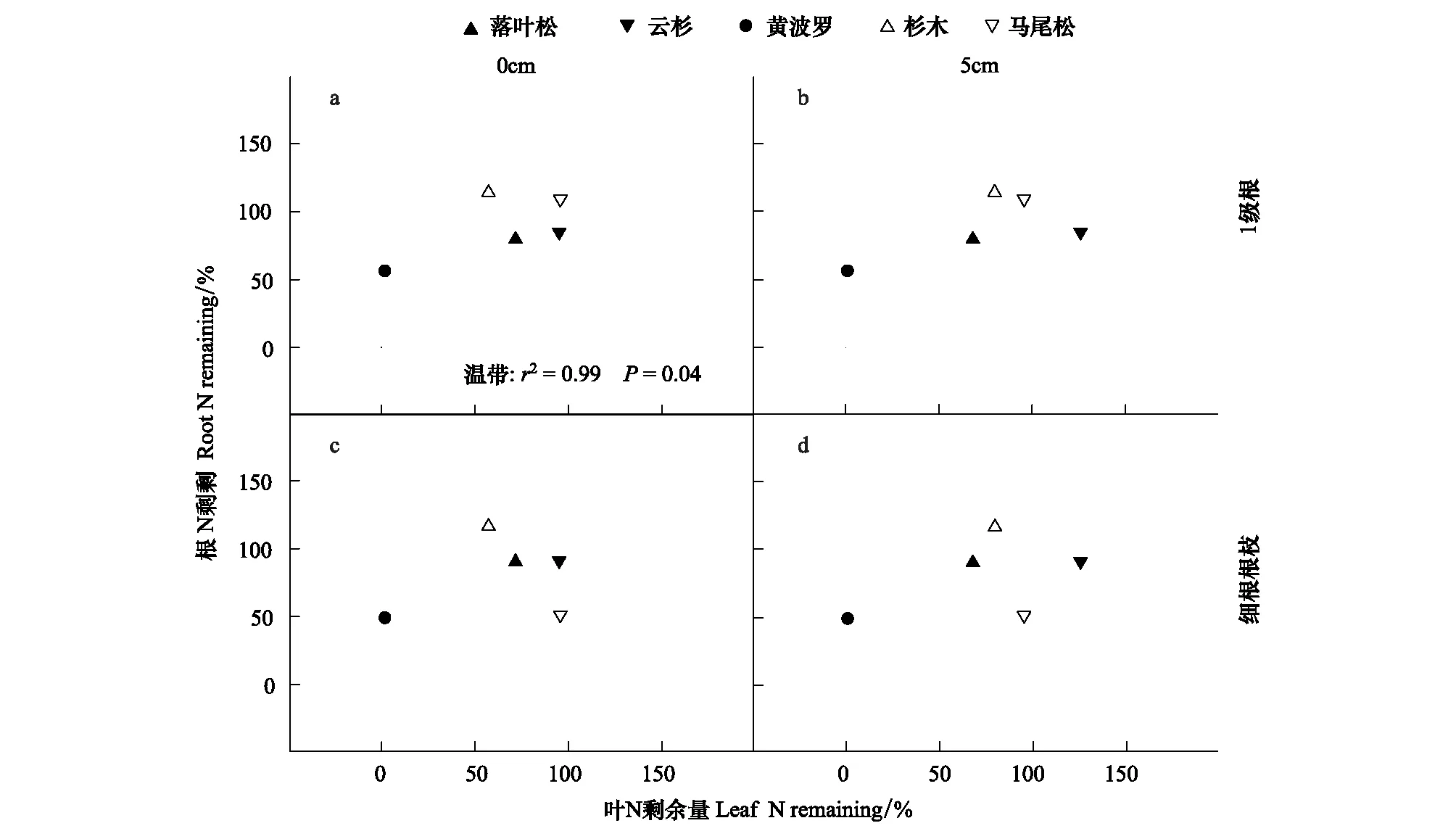
图3 根、叶分解2a后的N剩余量关系Fig.3 Relationships of N remaining after 2a between leaf litter decomposed at different soil depth and absorptive roots
2.3 影响分解过程的凋落物性质
叶凋落物比吸收根具有较高的可溶性组分、酸溶组分和C/N,具有较低的酸不溶组分和N含量(表3)。叶和吸收根的酸溶组分及N含量高度正相关(表3)。此外,叶与1级根的C/N正相关,与细根根枝的酸不溶组分正相关(表3)。
由于酸溶组分、N含量等凋落物性质与分解速率密切相关(表4),而8个树种整体分析时,根、叶的这些凋落物性质又高度正相关(表3),因此根-叶分解具有正相关关系(图1)。本研究中,根、叶分解速率在整体上与酸溶组分高度正相关、与酸不溶组分高度负相关(表4),虽然叶与这两个组分的相关关系不显著(表4)。各凋落物性质与细根根枝的相关系数大于其与1级根的相关系数(表4),这可以部分解释为什么叶与细根根枝的分解速率相关性更大(图1)。
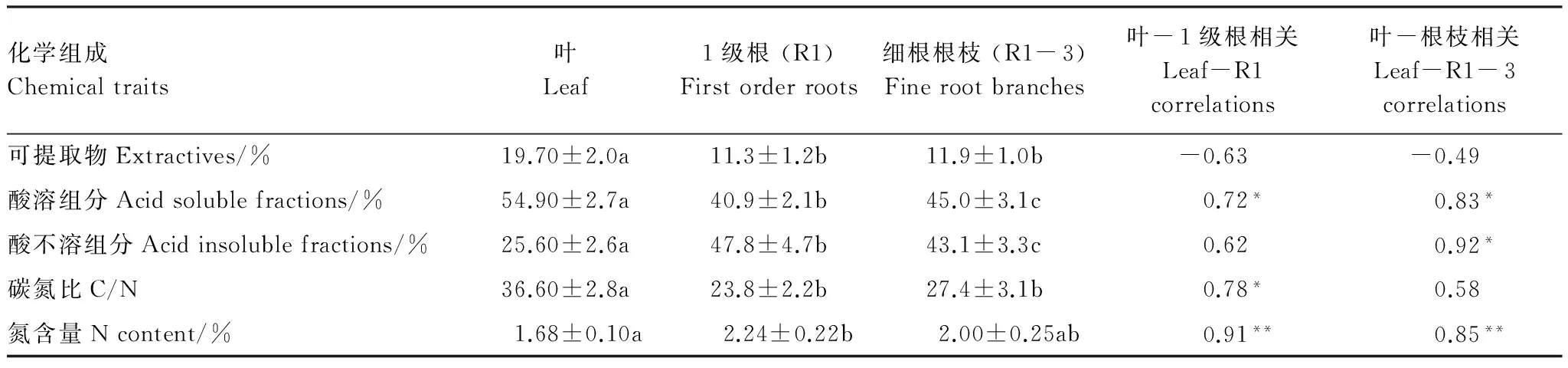
表3 叶与吸收根的初始化学组成的差异及相关关系
*P<0.05,**P<0.01;每个化学组成(行)在不同凋落物类型(叶、1级根、细根根枝)间的差异用小写字母(a、b、c)表示

表4 表层叶、土壤中叶、1级根、细根根枝的分解速率分别与其化学组成的相关关系
*P<0.05,**P<0.01
经过1年的分解,叶N剩余量与这5个凋落物性质不相关,1级根N剩余量与酸溶组分及N含量高度负相关(r>0.70,P<0.05,表5),而细根根枝与酸不溶组分高度正相关(r=0.80,P<0.05,表5)。经过2年的分解,叶N剩余量与这5个凋落物性质仍不相关,但与除可提取物之外的4个凋落物性质的相关系数变大,尤其是与N含量高度负相关(r>0.70,表6);1级根与除可提取物之外的4个凋落物性质的相关系数也变大,显著相关关系也发生变化(与C/N显著高度正相关,r=0.80,P<0.05,表6);细根根枝的N剩余量与这5个凋落物性质不再显著相关(表6)。由于整体上分别同叶N剩余量及根N剩余量高度或显著相关的凋落物性质不同,因此,根、叶的N剩余量在整体上并不相关(图2,图3)。

表5 表层叶、土壤中叶、1级根、细根根枝在分解1a后的N剩余量分别与其化学组成的相关关系
*P<0.05

表6 表层叶、土壤中叶、1级根、细根根枝在分解2a后的N剩余量分别与其化学组成的相关关系
*P<0.05
3 讨论
3.1 根-叶分解关系
本文2年的野外分解研究发现,叶和吸收根的分解速率(k,a-1,负指数模型)仅在8个温带树种和亚热带树种整体分析时,才具有正相关关系,这与Freschet等的结果一致[3]。Freschet等指出,在全球尺度上,根-叶分解速率正相关,但在较小的局地尺度上(同一生态系统内)并不相关[3]。当然,这些数据较为陈旧。在最近的研究中,也发现在较小的局地尺度上,根叶分解速率呈现正相关关系,如我国的亚热带森林[7,24- 25]、日本的暖温带森林[5]。这些正相关的根叶分解关系都发现在较温暖的生态系统内,在较寒冷的温带生态系统内,根-叶分解速率不相关[2]。但是,本研究中,由于在温带生态系统(帽儿山)中采集了黄波罗这个分解快速的树种,导致本研究的温带生态系统呈现根-叶分解速率正相关,而在亚热带系统(鹤山)中鲜见根-叶分解速率正相关的现象。这些结果表明,植物物种对于根-叶分解关系影响较大。
本研究的根-叶分解速率关系还显示,温带4个树种一起分析时,叶和吸收根的分解速率高度相关,但不显著(r2>0.85,P>0.05,图1)。温带树种根-叶的高相关关系主要来源于黄波罗,黄波罗的分解速率显著高于其他物种。黄波罗比较特殊,但不是异常点,因为黄波罗的化学组成决定了其快速分解的特征。在本研究的8个树种中,黄波罗的叶具有最高的酸溶组分和最低的酸不溶组分(表7),其吸收根的酸溶组分也是所有吸收根中最高的、酸不溶组分也是所有吸收根中最低的(表7),这些特征决定了黄波罗是8个树种中分解最快的,无论叶还是吸收根(图1)。此外,我们还发现阔叶树种间根-叶分解的正相关关系并不因为去掉或保留黄波罗而改变(图1d),也从侧面说明黄波罗并不是异常点,只是比较特殊。
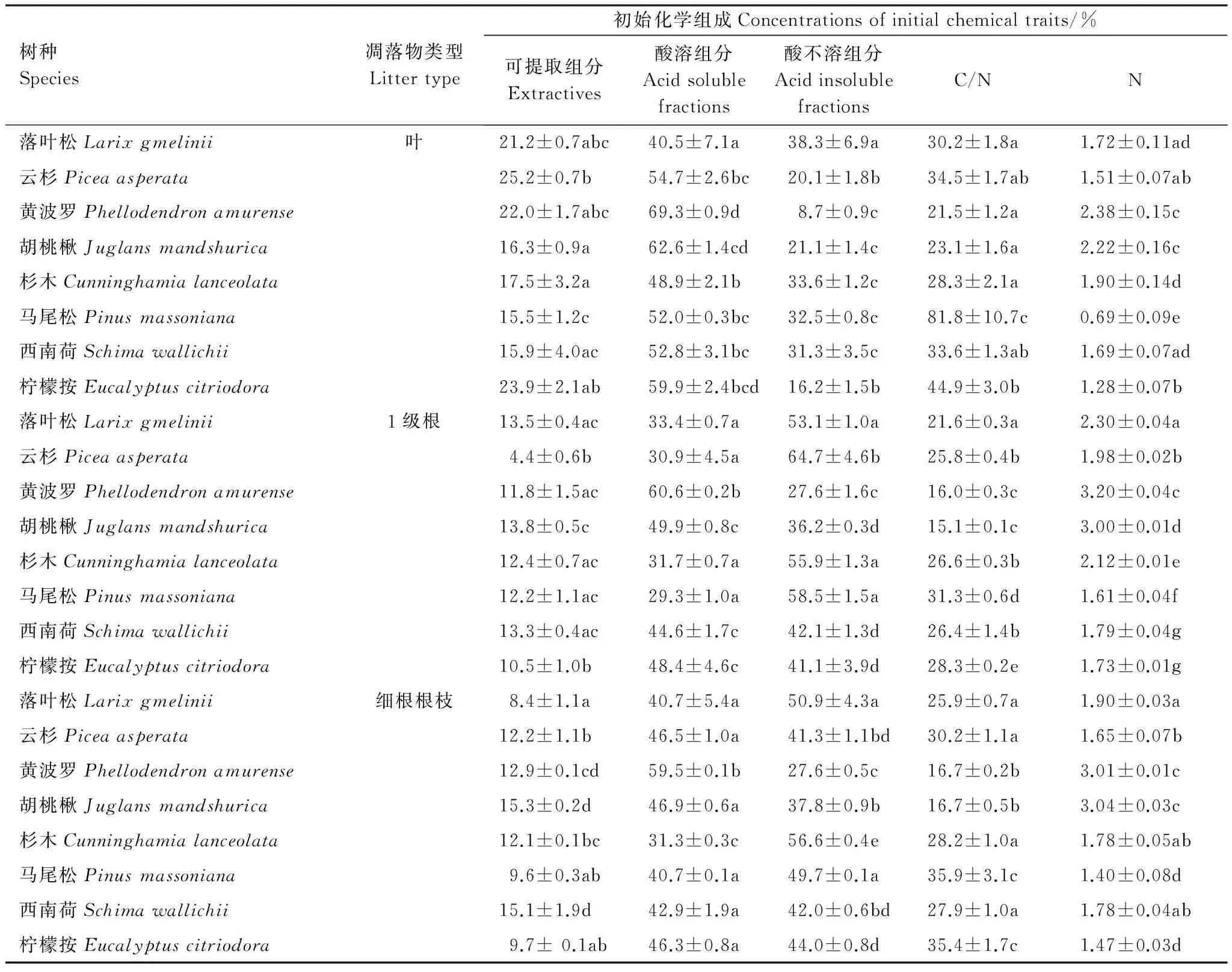
表7 本研究的 8个树种的叶和吸收根的初始化学组成(平均值±标准误差)及不同物种间的化学组成差异
针对每个凋落物类型(叶、1级根、细根根枝),其化学组成(栏)在8个物种间的差异用小写字母(a、b、c、d、e、f)表示
叶和吸收根的N剩余并不显著相关,这和已有研究相同。在所有的根-叶分解研究中,无论分解速率是否相关,其N动态都不相关[2,7]。N释放格局形成于凋落物的生物量损失过程,但并非线性关系,非常复杂,因此,根、叶的N释放格局难以同步。
3.2 凋落物性质的影响
根、叶的初始化学组成高度相关[2,4- 5],如P含量[4- 5]、K含量[2,4- 5]、Mn含量[4- 5]、C含量[4]、N含量[4]、Ca含量[2]、酸溶组分含量[4]、酸不溶组分含量[4]等。在本研究中,叶和1级根的N含量及C/N的关系更密切,而叶和细根根枝的酸溶组分及酸不溶组分的关系更密切(表3)。由于分解速率同生物量组分的关系更密切(表4),因此,叶与细根根枝的分解速率更相关,相关系数高于叶与1级根的相关系数(图1)。
根、叶的凋落物性质是否相关并不能决定根-叶分解是否相关,但决定于这些相关的凋落物性质是否正好显著影响根、叶的分解速率[2- 9,25]。本研究中,叶和吸收根的分解速率都与相同的凋落物性质(主要是酸溶组分和酸不溶组分)高度同向相关(表4)。在已有其他研究中,根、叶分解速率的相关因子不仅与本研究不同,相互之间也不一样。比如,近北极寒带森林的根、叶分解速率受控于木质素含量[26],亚热带受控于Ca含量[7],暖温带及热带受控于养分含量[5,25]。由于凋落物性质与物种密切相关[27],因此,这些结果再次印证了植物物种在根-叶分解关系中的重要影响。
3.3 细根异质性的影响
本研究从最初就假设细根异质性会影响根-叶分解关系。至此,我们发现,细根异质性通过影响凋落物性质而间接影响根-叶分解关系。同1级根相比,前3级根组成的细根根枝在化学组成上不同(表7),而且分解速率也有区别(虽然有些树种不显著表2),显示了较高级根(2级根和3级根)的影响。因此,研究根-叶分解关系必须考虑细根异质性的影响。
1级根和细根根枝两者在化学组成上的差异,也可能因为其功能上有细微差异。比如,1级根的N含量在根系中最高[12,19- 20](表3),可能意味着具有强大的吸收功能[21];而细根根枝的酸溶组分高而酸不溶组分低(表3),可能意味着具有快速周转能力,是物质循环的基本单位[19- 20]。因此,同叶功能上类似,对于研究根-叶分解关系非常重要。
3.4 根、叶分解环境的影响
自然状态下,叶在凋落物层分解,而根主要在土壤中分解。凋落物层和土壤的环境并不一致,本文特意设置了叶在土壤中的分解的对照。结果显示,第一,叶在两个环境下的分解速率不同(表2);第二,当叶在土壤中分解时,和根保持相同的分解环境时,根-叶分解关系更密切(图1)。这些结果表明,分解环境对根-叶分解关系具有一定的影响。
4 结论
本研究通过埋包法,对8个温带和亚热带针阔叶树种的叶和吸收根进行了2年多的野外分解实验,发现叶和吸收根的分解速率在8个树种整体分析时才具有高度正相关关系;在相同气候带或植物生活型水平上是否相关,受叶的分解环境及吸收根的类型的影响。同已有研究不同,亚热带的4个树种的根-叶分解速率不相关,而温带的4个树种的根-叶分解速率正相关。这些研究结果表明,植物物种对于根-叶分解关系具有根本的影响。因此,气候变化导致物种组成的改变将极大影响地上-地下关系,也因此影响生态系统物质循环及植物-土壤关系。
参考文献(References):
[1] Wardle D A, Bardgett R D, Klironomos J N, Setälä H, van der Putten W H, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[2] Hobbie S E, Oleksyn J, Eissenstat D M, Reich P B. Fine root decomposition rates do not mirror those of leaf litter among temperate tree species. Oecologia, 2010, 162(2): 505- 513.
[3] Freschet G T, Cornwell W K, Wardle D A, Elumeeva T G, Liu W D, Jackson B G, Onipchenko V G, Soudzilovskaia N A, Tao J P, Cornelissen J H C. Linking litter decomposition of above-and below-ground organs to plant-soil feedbacks worldwide. Journal of Ecology, 2013, 101(4): 943- 952.
[4] Ma C G, Xiong Y M, Li L, Guo D L. Root and leaf decomposition become decoupled over time: implications for below-and above-ground relationships. Functional Ecology, 2016, 30(7): 1239- 1246.
[5] Fujii S, Makita N, Mori A S, Takeda H. A stronger coordination of litter decomposability between leaves and fine roots for woody species in a warmer region. Trees, 2016, 30(2): 395- 404.
[6] Vivanco L, Austin A T. Tree species identity alters forest litter decomposition through long-term plant and soil interactions in Patagonia, Argentina. Journal of Ecology, 2008, 96(4): 727- 736.
[7] Wang H, Liu S R, Mo J M. Correlation between leaf litter and fine root decomposition among subtropical tree species. Plant and Soil, 2010, 335(1/2): 289- 298.
[8] Birouste M, Kazakou E, Blanchard A, Roumet C. Plant traits and decomposition: are the relationships for roots comparable to those for leaves? Annals of Botany, 2012, 109(2): 463- 472.
[9] Freschet G T, Aerts R, Cornelissen J H C. A plant economics spectrum of litter decomposability. Functional Ecology, 2012, 26(1): 56- 65.
[10] Reich P B. The world-wide ‘fast-slow’ plant economics spectrum: a traits manifesto. Journal of Ecology, 2014, 102(2): 275- 301.
[11] Roumet C, Birouste M, Picon-Cochard C, Ghestem M, Osman N, Vrignon-Brenas S, Cao K F, Stokes A. Root structure-function relationships in 74 species: evidence of a root economics spectrum related to carbon economy. New Phytologist, 2016, 210(3): 815- 826.
[12] Pregitzer K S, Deforest J L, Burton A J, Allen M F, Ruess R W, Hendrick R L. Fine root architecture of nine North American trees. Ecological Monographs, 2002, 72(2): 293- 309.
[13] Guo D L, Li H, Mitchell R J, Han W X, Hendricks J J, Fahey T J, Hendrick R L. Fine root heterogeneity by branch order: exploring the discrepancy in root turnover estimates between minirhizotron and carbon isotopic methods. New Phytologist, 2008, 177(2): 443- 456.
[14] Guo D L, Mitchell R J, Withington J M, Fan P P, Hendricks J J. Endogenous and exogenous controls of root life span, mortality and nitrogen flux in a longleaf pine forest: root branch order predominates. Journal of Ecology, 2008, 96(4): 737- 745.
[15] Wells C E, Eissenstat D M. Marked differences in survivorship among apple roots of different diameters. Ecology, 2001, 82(3): 882- 892.
[16] Fan P P, Guo D L. Slow decomposition of lower order roots: a key mechanism of root carbon and nutrient retention in the soil. Oecologia, 2010, 163(2): 509- 515.
[17] Goebel M, Hobbie S E, Bulaj B, Zadworny M, Archibald D D, Oleksyn J, Reich P B, Eissenstat D M. Decomposition of the finest root branching orders: linking belowground dynamics to fine-root function and structure. Ecological Monographs, 2011, 81(1): 89- 102.
[18] Xiong Y M, Fan P P, Fu S L, Zeng H, Guo D L. Slow decomposition and limited nitrogen release by lower order roots in eight Chinese temperate and subtropical trees. Plant and Soil, 2013, 363(1/2): 19- 31.
[19] Guo D L, Xia M X, Wei X, Chang W J, Liu J, Wang Z Q. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species. New Phytologist, 2008, 180(3): 673- 683.
[20] Xia M X, Guo D L, Pregitzer K S. Ephemeral root modules inFraxinusmandshurica. New Phytologist, 2010, 188(4): 1065- 1074.
[21] McCormack M L, Dickie I A, Eissenstat D M, Fahey T J, Fernandez C W, Guo D L, Helmisaari H S, Hobbie E A, Iversen C M, Jackson R B, Leppälammi-Kujansuu J, Norby R J, Phillips R P, Pregitzer K S, Pritchard S G, Rewald B, Zadworny M. Redefining fine roots improves understanding of below-ground contributions to terrestrial biosphere processes. New Phytologist, 2015, 207(3): 505- 518.
[22] Wang Z Q, Guo D L, Wang X R, Gu J C, Mei L. Fine root architecture, morphology, and biomass of different branch orders of two Chinese temperate tree species. Plant and Soil, 2006, 288(1/2): 155- 171.
[23] Li Z A, Peng S L, Rae D J, Zhou G Y. Litter decomposition and nitrogen mineralization of soils in subtropical plantation forests of southern China, with special attention to comparisons between legumes and non-legumes. Plant and Soil, 2001, 229(1): 105- 116.
[24] 刘文丹, 陶建平, 张腾达, 钱凤, 柴捷, 刘宏伟. 中亚热带木本植物各器官凋落物分解特性. 生态学报, 2014, 34(17): 4850- 4858.
[25] 王卫霞, 史作民, 罗达, 刘世荣. 南亚热带格木和红椎凋落叶及细根分解特征. 生态学报, 2016, 36(12): 3479- 3487.
[26] Devi N B, Yadava P S. Influence of climate and litter quality on litter decomposition and nutrient release in sub-tropical forest of Northeast India. Journal of Forestry Research, 2010, 21(2): 143- 150.
[27] Cornwell W K, Cornelissen J H C, Amatangelo K, Dorrepaal E, Eviner V T, Godoy O, Hobbie S E, Hoorens B, Kurokawa H, Pérez-Harguindeguy N, Quested H M, Santiago L S, Wardle D A, Wright I J, Aerts R, Allison S D, van Bodegom P, Brovkin V, Chatain A, Callaghan T V, Díaz S, Garnier E, Gurvich D E, Kazakou E, Klein J A, Read J, Reich P B, Soudzilovskaia N A, Vaieretti M V, Westoby M. Plant species traits are the predominant control on litter decomposition rates within biomes worldwide. Ecology Letters, 2008, 11(10): 1065- 1071.

