岷江干旱河谷区典型灌木对干旱胁迫的生理生化响应
何建社,张 利,刘千里,朱欣伟,刘兴良,冯秋红,罗 达,史作民, 4,*
1 阿坝藏族羌族自治州林业科学技术研究所,汶川 623000 2 四川省林业科学研究院,成都 610081 3 中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京 100091 4 南京林业大学南方现代林业协同创新中心,南京 210037
面对干旱胁迫,植物不仅从形态结构上发生改变,而且从生理生化特性等层次上表现出相应的响应。活性氧代谢是植物对逆境胁迫的原初反应,干旱胁迫会导致植物体内活性氧产生和清除的平衡遭到破坏而出现活性氧的积累,并由此引发氧化胁迫[1- 2]。在此过程中,植物进化出有效的抗氧化系统以清除活性氧,如抗氧化保护酶和非酶抗氧化物质以及渗透调节物质等[3]。研究表明,适度干早胁迫能促进金露梅(Potentillafruticosa)[4]、樟树(Cinnamomumcamphora)[5]、柠檬薄荷(Menthacitrate)[6]、瓦泰豆木(Vataireamacrocarpa(Benth.) Ducke)[7]等植物体内超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等保护酶的产生,这是植物细胞对外界环境胁迫条件的一种适应性反应,但干旱胁迫程度过大,活性氧的产生与清除平衡失调时,植物抗性下降,保护酶系统活性也会随之降低[8]。然而也有研究发现,相关抗氧化保护酶活性会随着干旱胁迫程度的增强呈持续升高[4]或持续下降[9]。丙二醛(MDA)作为膜脂过氧化的最终产物,对植物的细胞膜有毒害作用,其高低受SOD酶活性大小所调节[10]。由此可见,不同植物的不同保护酶及MDA应对干旱胁迫及随之而来的氧化胁迫的响应可能存在一定差异,植物细胞内一些酶可能只在很窄的干旱胁迫范围内才具有活性,不同胁迫时期植物体内起主导作用的保护酶也可能不同。干旱胁迫下,植物通过主动积累一些渗透调节物质(如脯氨酸、可溶性糖、可溶性蛋白)来降低体内的渗透势,使其在逆境下仍可获得维持正常生长所需的水分,从而提高抗逆适应性[11]。尽管如此,也有研究发现植物体内的这些渗透调节物质随干旱胁迫程度的增强呈先增后减[12]或持续下降的势态[13]。因此,有关渗透调节物质在植物生理调节机制及抗逆中的作用还存在一定争议,有待进一步的研究验证。
目前,有关干旱胁迫对植物生理生态影响及抗逆适应机理的研究已广泛开展。然而,以往的研究大多是基于盆栽模拟水分胁迫,通过人工控水研究少数特定几个胁迫梯度(如轻度、中度和重度胁迫)下的试验结果[14- 16],对土壤干旱逐渐加剧过程中的多水分胁迫梯度下的连续观测研究仍相对缺乏,研究土壤自然干旱胁迫对植物生理生态特性的影响同时更能客观反应植物对田间干旱胁迫的响应特征。四川西部的岷江干旱河谷是我国西南林区中一类较特殊的山地生态系统,该区地被物主要以矮灌和草本为主[17]。以往对干旱河谷具代表性乔灌草等植物对干旱胁迫的生长与生理生化响应的研究曾有所涉及。如Fang等[18]和蔡海霞等[19]在研究干旱胁迫对干旱河谷高山柳(Salixparaqplesia)和沙棘(Hippophaerhamnoides)幼苗生长、资源利用效率、光合生理特征的影响时发现,干旱胁迫降低了两种植物的株高、基径、叶片数、生物量生产以及C、N、P的积累,但提高了N和P利用效率;沙棘在干旱胁迫条件下表现出相对较高的生长量、Pn、gs、WUEi以及P利用效率,具有相对较强的干旱环境适应能力,而高山柳具有相对较高的N利用效率,对干旱胁迫更为敏感。王红梅等[20]研究白刺花(Sorphoradavidii)幼苗叶片生理生化特性响应不同干旱胁迫强度时得出60%的土壤田间持水量是其叶片生理生化代谢受干旱胁迫伤害的阈值。这些研究多是基于干旱胁迫对少数几种植物的生长与生理生化影响,针对干旱河谷区植被恢复重建中适应性强的多种典型生态造林灌木,开展其抗旱能力的综合评价及生理生态抗旱机制的研究仍不足。鉴于此,本文以岷江干旱河谷区的6种典型灌木:沙棘、羊蹄甲(Bauhiniafaberi)、白刺花、锦鸡儿(Caraganaarborescens)、三颗针(Berberissargentiana)、黄栌(Cotinusszechuanensis)为对象,研究苗木的抗氧化保护酶系统、细胞膜伤害程度以及渗透调节物质对土壤自然干旱胁迫的响应特征及适应机理,同时对各苗木的抗旱能力进行定量与综合评价,以期深入了解土壤干旱胁迫下该区典型造林灌木的生理生态抗旱机理,为该区退化生态环境的恢复重建提供树种参考。
1 材料与方法
1.1 试验区概况
试验地点位于四川省阿坝藏族羌族自治州理县桃坪镇佳山苗圃(地理坐标105°54′ E、34°28′ N),该区属于四川省西部内陆高山峡谷腹心地带,属典型的干旱河谷区,海拔1700 m左右,温带季风气候,年平均气温11.8℃,年均降雨量592.3 mm,年均蒸发量1413.9 mm。土壤以旱生灌木草丛植被下发育的山地燥褐土为主。地被物主要以矮灌和草本为主,除研究对象中提到的几种典型灌木外,其他地被物如川甘亚菊(Ajaniapotaninii)、黄花亚菊(A.nubigena)、金花蚤草(Pulicariachrysantha(Diels) Ling)、蔷薇(Rosasp.)、蕨类、禾本科类等也比较常见。
1.2 试验材料与干旱胁迫
选择沙棘、羊蹄甲、白刺花、锦鸡儿、三颗针、黄栌6种灌木的2年生播种苗为供试材料,育苗所用的种子均采自岷江流域的干旱河谷区,苗木基本生长情况见表1。2015年6月,选择生长健壮、无病虫害、长势基本一致的沙棘、羊蹄甲、白刺花、锦鸡儿、三颗针、黄栌幼苗进行盆栽培育,每种灌木培育30盆,每盆1株,花盆口径35 cm,高42 cm。采用当地干旱河谷区旱生灌木草丛植被下发育的山地燥褐土作为基质,其容重为(1.12±0.08) g/cm3,田间持水量44.02%±3.06%,pH值7.67±0.37,有机质(52.07±4.12) g/kg,全氮(2.91±0.69) g/kg,全磷(0.47±0.06) g/kg,全钾(2.94±0.21) g/kg。幼苗栽植后,对苗木进行日常浇水管理,待苗木恢复生长1个月后进行土壤自然干旱胁迫试验。试验期间为防止降雨对土壤干旱胁迫的干扰,采用搭建遮雨棚的方法,防止雨水进入土壤干旱胁迫控制区。
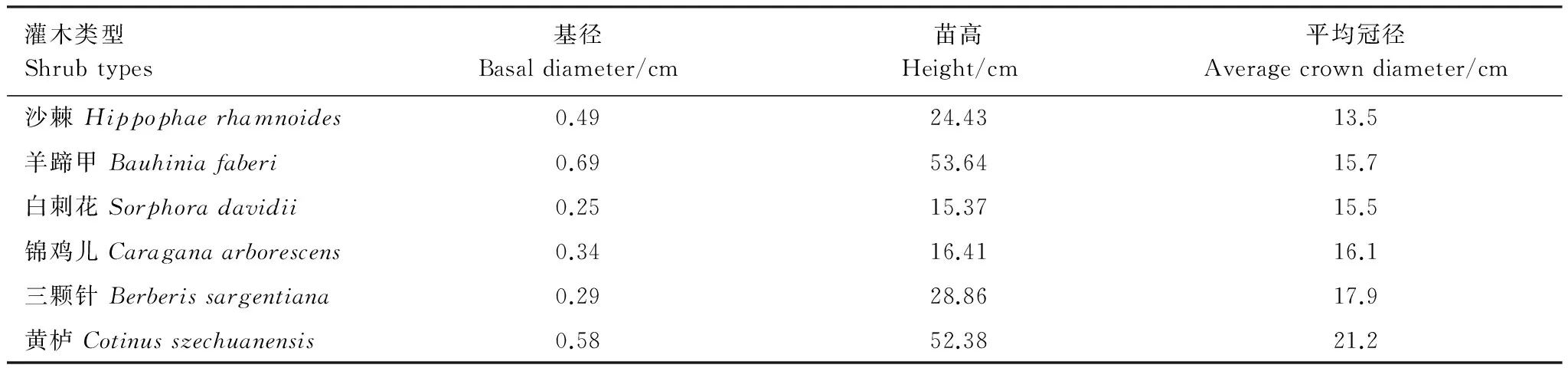
表1 试验苗木基本情况
2015年7月,在田间环境条件下(盆长期埋于土壤中,使盆内土壤与田间土壤同温),通过停止人工供水令其自然干旱的方法获取盆栽土壤水分胁迫梯度。对所有供试苗木进行最后一次供水的当天取样,作为供试苗木正常水分条件下的对照,之后令其自然干旱,并在自然干旱后的第2、4、8、12、20、28天取样,共取样7次,同时采用烘干法测定土壤含水量并计算其占田间持水量的比例(表2)。本研究设定干旱胁迫的2—4 d为胁迫初期,8—12 d为中期,20—28 d为后期。
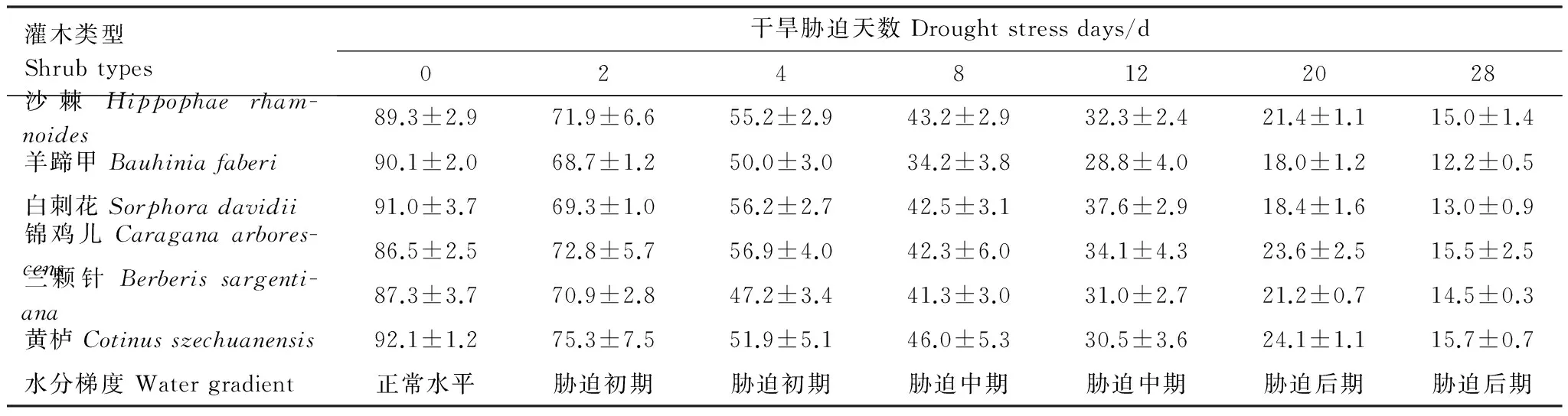
表2 不同干旱胁迫时期苗木土壤含水量占田间持水量的比/%
1.3 测定内容与方法
取样时,每次取样部位保持一致。于各胁迫时期选取各灌木幼苗枝上部健康完整的叶片(枝顶端往下3—5片),装入自封袋后冰盒保存迅速带回实验室,将其剪碎,从中取出适量的样品进行相关生理生化指标的测定,每种灌木幼苗的每个指标重复3次。
所有生理生化指标的测定方法均参照高俊凤[21]。采用氮蓝四唑光化还原法测定SOD酶活性;愈创木酚显色法测定POD酶活性;紫外分光光度法测定CAT酶活性;MDA含量的测定采用硫代巴比妥酸法;质膜相对透性采用电解质外渗法测定;脯氨酸含量采用酸性茚三酮法测定。
1.4 数据处理
所有数据处理和统计分析均基于Excel 2003和SPSS 19.0软件进行。采用单因素方差分析(One-way ANOVA)和Duncan多重比较检验不同灌木植物之间生理生化指标的差异性,显著水平设为α=0.05。
为了更加全面、系统地评价6种苗木植物的综合抗旱性能,对本试验中各个胁迫时期的6个相关生理生化指标的平均值进行主成分分析。根据主成分分析得到的各主成分的得分,再以各主成分的方差贡献率为权数,对所提取的得分进行加权求和,得到各苗木反映抗旱性能的综合得分,得分越高,植物的抗旱性越强。
2 结果与分析
2.1 干旱胁迫对苗木叶片抗氧化保护酶系统的影响
从表3可以看出,不同干旱胁迫时期各苗木叶片的SOD酶活性之间存在显著差异(P<0.05)。正常水分条件下沙棘、羊蹄甲和白刺花叶片的SOD酶活性最高,平均为202.70 U/g FW(FW: 鲜重),三颗针叶片的SOD酶活性最低,仅为116.87 U/g FW。当苗木遭受干旱胁迫时,各苗木的SOD酶活性随着胁迫程度的增强均呈现先升高后降低的特点,并在胁迫的8 d时达到峰值,随后开始下降。其中,锦鸡儿叶片的SOD酶活性在试验的0—2 d低于沙棘和羊蹄甲,在胁迫的4—28 d则高于其他5种苗木;三颗针叶片的SOD酶活性在各胁迫时期则始终明显低于其他苗木(P<0.05)。与对照相比,胁迫末期各苗木叶片的SOD酶活性增幅差异较大,从大到小依次为锦鸡儿、黄栌、白刺花、三颗针、羊蹄甲、沙棘。
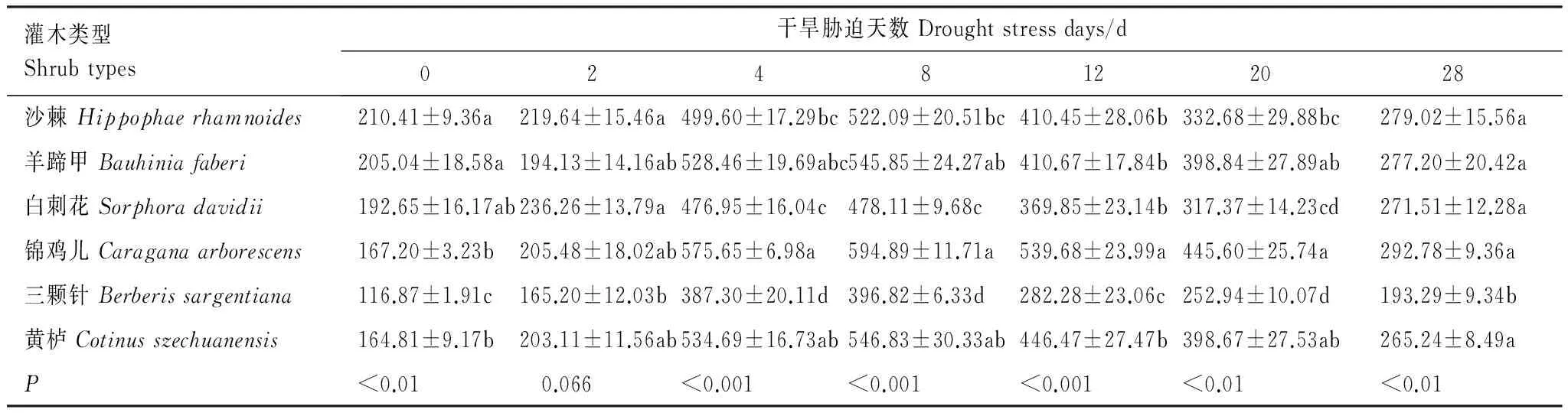
表3 不同干旱胁迫时期苗木叶片超氧化物歧化酶活性变化/(U/g FW)
同一列不同小写字母表示在0.05水平上存在显著性差异(Duncan′s多重比较法);FW: 鲜重
分析结果表明(表4),不同干旱胁迫时期各苗木叶片的POD酶活性之间存在显著差异(P<0.05)。正常水分条件下,沙棘叶片的POD酶活性最高,为5.41 U g-1FW min-1,显著高于其他5种苗木(P<0.05);白刺花和锦鸡儿次之,分别为3.52 U g-1FW min-1和2.55 U g-1FW min-1;羊蹄甲、三颗针和黄栌3种苗木叶片的POD酶活性最低,且相互之间无显著差异(P>0.05),平均为1.23 U g-1FW min-1。当苗木遭受干旱胁迫时,各苗木叶片的POD酶活性随着胁迫程度的增强均呈现持续缓慢增加的趋势,除白刺花外的其他5种苗木均在胁迫的20 d时达到峰值,随后仍维持在较高水平,白刺花则在胁迫的28 d达到峰值。整个干旱胁迫期间,沙棘叶片的POD酶活性始终高于其他5种苗木(P<0.05),与之相反,三颗针则始终低于其他苗木(P<0.05)。尽管如此,至胁迫末期,沙棘叶片的POD酶活性较对照仅增加了25.64%,明显低于其他5种苗木平均增幅的129.41%(P>0.05)。
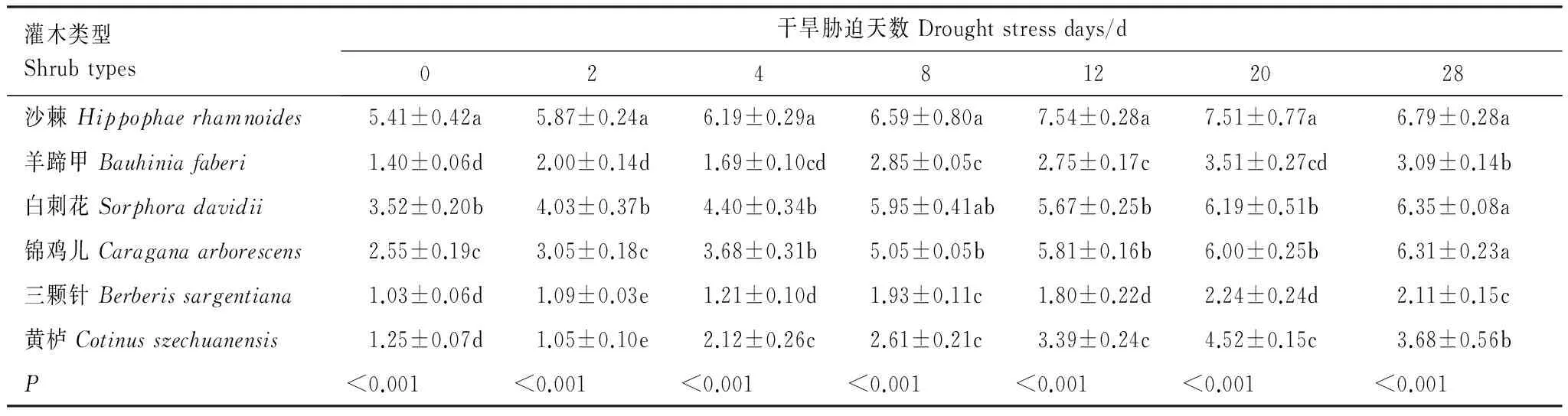
表4 不同干旱胁迫时期苗木叶片过氧化物酶活性变化/(U g-1 FW min-1)
表5显示,正常水分条件下,羊蹄甲、三颗针和黄栌叶片的CAT酶活性最高,平均为34.85 U g-1FW min-1,显著高于其他3种苗木(P<0.05),白刺花叶片的CAT酶活性最低(14.67 U g-1FW min-1)。从整个干旱胁迫过程来看,各苗木叶片的CAT酶活性在胁迫的0—4 d期间基本保持平稳,从胁迫的8 d开始急剧增加,并在胁迫的20 d和28 d达到峰值。沙棘叶片的SOD酶活性在各胁迫时期整体高于其他苗木,白刺花则整体低于其他苗木。至胁迫末期,黄栌叶片的CAT酶活性最高,为269.24 U g-1FW min-1,沙棘、锦鸡儿和三颗针次之,平均为211.56 U g-1FW min-1,羊蹄甲和白刺花最低,平均为116.23 U g-1FW min-1。胁迫末期,沙棘、羊蹄甲、白刺花、锦鸡儿、三颗针和黄栌叶片的CAT酶活性较对照分别提高了9.71倍、2.34倍、6.78倍、8.76倍、5.18倍和7.03倍。
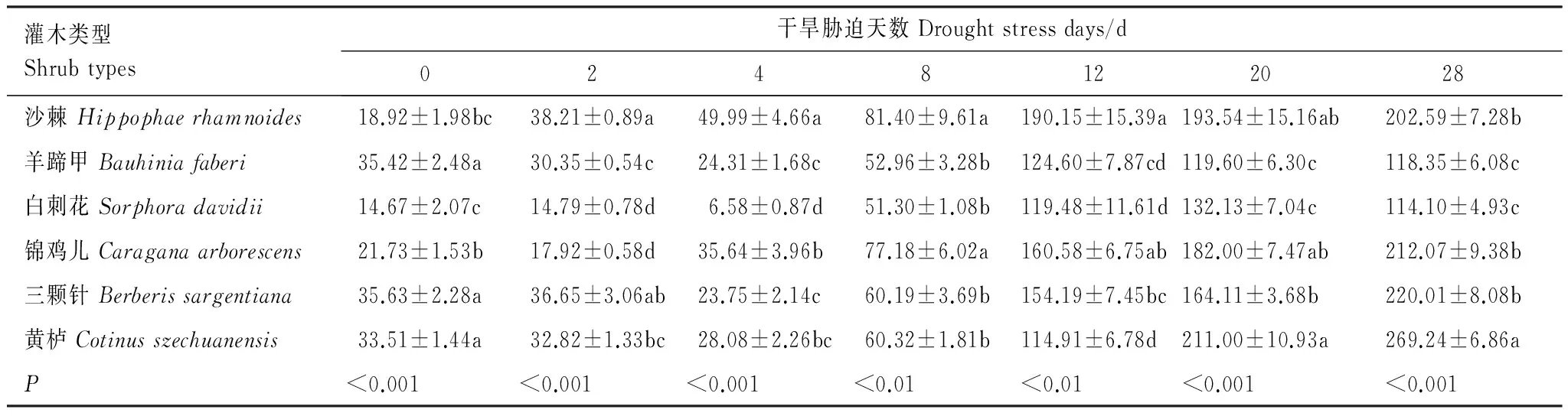
表5 不同干旱胁迫时期苗木叶片过氧化氢酶活性变化/(U g-1 FW min-1)
2.2 干旱胁迫对苗木叶片膜伤害程度的影响
表6显示,正常水分条件下,羊蹄甲、白刺花、锦鸡儿和三颗针叶片之间的MDA含量差异不显著(P>0.05),平均为3.03 mmol/g FW,但显著高于沙棘的1.50 mmol/g FW (P<0.05)。随着干旱胁迫程度的增强,各苗木叶片的MDA含量呈缓慢增加的趋势,并在胁迫的末期达到各自的峰值。各胁迫时期,沙棘叶片的MDA含量始终低于其他5种苗木(P<0.05)。黄栌叶片的MDA含量在胁迫的0—4 d期间低于羊蹄甲、白刺花和锦鸡儿,在胁迫的8—28 d期间则高于羊蹄甲、白刺花和锦鸡儿。与对照相比,胁迫末期各苗木叶片的MDA含量增幅有所差异,从小到大依次为沙棘、白刺花、三颗针、锦鸡儿、羊蹄甲、黄栌。
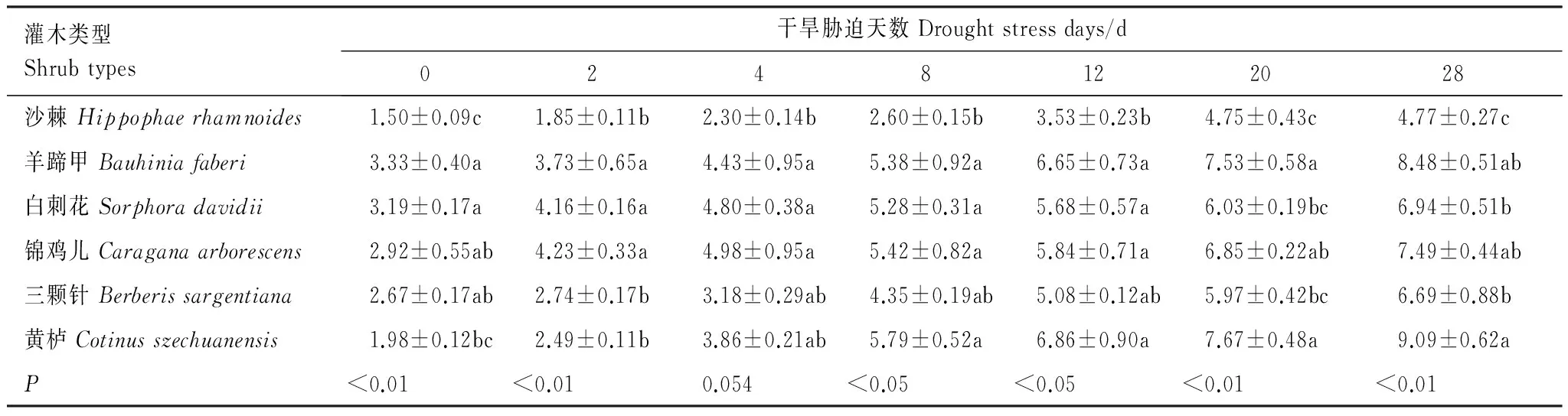
表6 不同干旱胁迫时期苗木叶片丙二醛含量变化/(mmol/g FW)
表7显示,正常水分条件下,沙棘、羊蹄甲、白刺花和锦鸡儿4种苗木叶片的质膜相对透性最高(平均为12.27%),其次为三颗针(8.74%),黄栌最低(4.99%)(P<0.05)。当苗木遭受干旱胁迫时,不同苗木叶片的质膜相对透性呈现出不同的变化规律。白刺花和黄栌叶片的质膜相对透性在胁迫的0—4 d期间基本不变,从胁迫的8 d开始急剧升高并一直维持在较高水平。随着胁迫时间的延长,锦鸡儿和三颗针叶片的质膜相对透性呈现先降低,之后急剧升高的特点。整个胁迫期间,沙棘和羊蹄甲叶片的质膜相对透性呈现先升高后降低最终又基本维持在初始水平。胁迫末期,白刺花、锦鸡儿、三颗针和黄栌4种苗木叶片的质膜相对透性差异不大(P>0.05),但明显高于沙棘和羊蹄甲(P<0.05)。与对照相比,胁迫末期沙棘、羊蹄甲、白刺花、锦鸡儿、三颗针和黄栌叶片的质膜相对透性增幅分别为2.21%、1.75%、15.85%、13.32%、14.11%和21.00%。
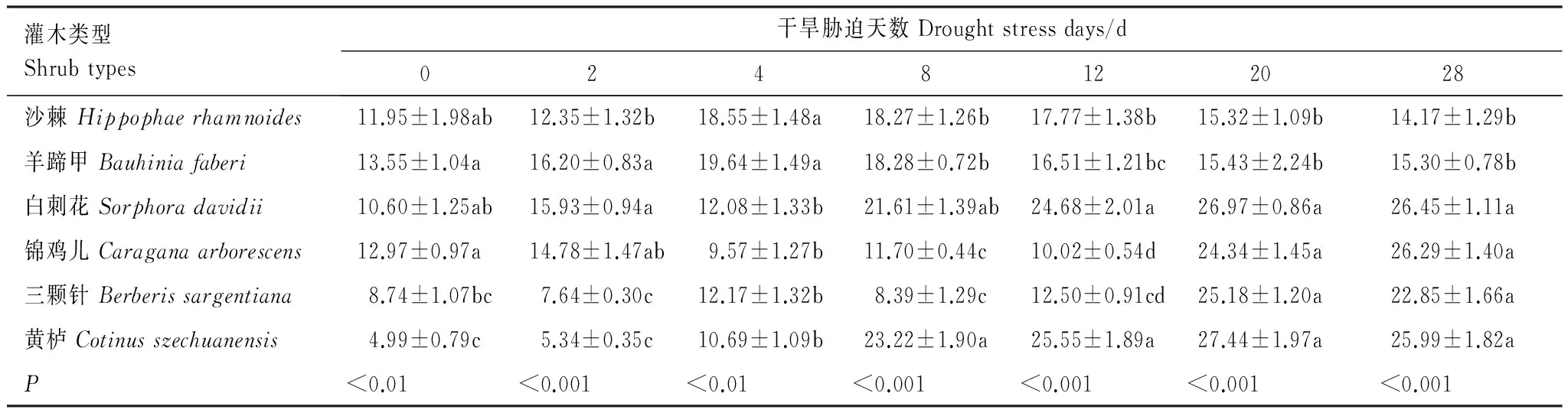
表7 不同干旱胁迫时期苗木叶片质膜相对透性变化/%
2.3 干旱胁迫对苗木叶片渗透调节物质的影响
从表8可以看出,各胁迫时期6种苗木叶片的脯氨酸含量差异较大。正常水分条件下,羊蹄甲叶片的脯氨酸含量最高,达到376.57 mg g-1FW,明显高于沙棘、黄栌和白刺花3种苗木(平均为212.44 mg g-1FW)(P<0.05),分别是锦鸡儿和三颗针的11.10倍和5.14倍(P<0.05)。当苗木遭受干旱胁迫时,6种苗木叶片的脯氨酸含量总体均呈增加趋势。各胁迫时期羊蹄甲叶片的脯氨酸含量始终处于最高水平;三颗针叶片的脯氨酸含量在胁迫的0—2 d期间高于锦鸡儿(P>0.05),但在胁迫的4—28 d期间明显低于其他5种苗木(P<0.05)。不同苗木叶片的脯氨酸含量达到峰值的胁迫时期不同,其中,白刺花为胁迫的12 d,沙棘、三颗针和黄栌为胁迫的20 d,羊蹄甲和锦鸡儿为胁迫的28 d。与对照相比,胁迫末期各苗木叶片的脯氨酸含量增幅差异较大,其中,羊蹄甲和锦鸡儿最大,三颗针最小。
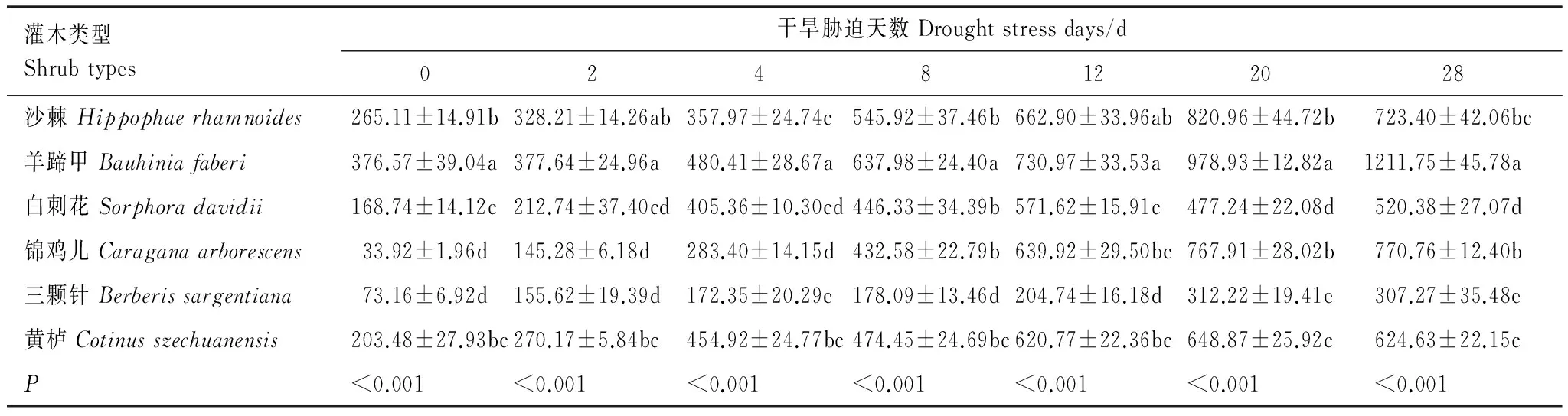
表8 不同干旱胁迫时期苗木叶片脯氨酸含量变化/(mg/g FW)
2.4 苗木抗旱性综合评价
由表9可以看出,第1主成分的方差贡献率为43.805%,对苗木的抗旱性起主导作用,第1、2主成分累计方差贡献率达到了76.444%,基本能够反映出几种苗木植物生理生化指标的相对重要性及其之间的相互关系。对6个生理生化指标在各主成分上的因子载荷分析(表9)表明,质膜相对透性对第1主成分的贡献最大,POD酶活性次之;第2主成分中,MDA含量的贡献较高。因此,质膜相对透性可视为反映试验苗木抗旱性能的最重要生理生化指标,其次是POD酶活性和MDA含量。此外,各苗木抗旱性综合得分结果显示(表10),干旱胁迫下6种苗木中,羊蹄甲和沙棘的抗旱性最强,锦鸡儿和黄栌居中,白刺花和三颗针最弱。
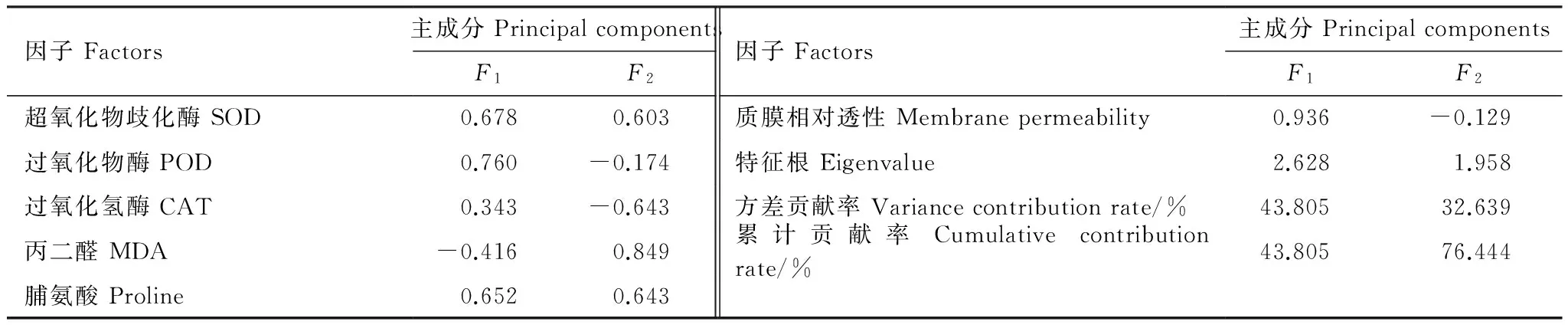
表9 主成分因子载荷矩阵及主成分特征根
SOD:superoxide dismutase;POD:peroxidase;CAT:catalase;MDA:malondialdehyde
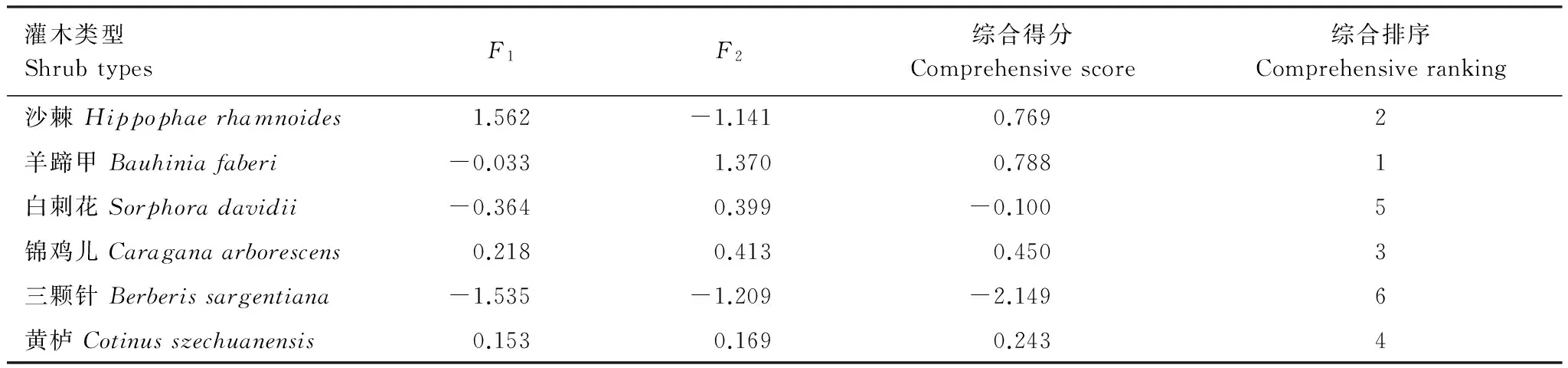
表10 主成分因子得分及苗木抗旱性综合得分
3 讨论
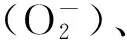
逆境胁迫引发活性氧的大量积累,攻击膜脂不饱和脂肪酸,启动膜脂过氧化的自由基链式反应,损伤蛋白质的结构和功能,如H+-ATPase和H+-Pase活性降低,最终破坏膜结构,导致膜系统代谢紊乱[33]。MDA是膜脂过氧化作用的最终产物,它的水平表征了膜脂过氧化的程度[34]。质膜透性可反映膜系统的完整性,植物在逆境下的细胞膜的结构和功能受到伤害,质膜透性增加,膜稳定性降低,细胞内的离子和大分子物质被动外渗,影响植物的正常代谢[35- 36]。干旱胁迫下,植物MDA含量增幅越大,抗旱性越弱,反之,抗旱性越强。本试验中,随着干旱胁迫程度的增强,各苗木叶片的MDA含量呈缓慢增加趋势(表6),表明细胞的膜脂过氧化作用逐渐加强,植物开始遭受一定程度的毒害。而迟琳琳[37]在研究科尔沁沙地4种灌木对干旱胁迫的生理响应时发现,由于叶底珠(Securinegasuffruticosa)体内正常的能量转化和物质合成受到抑制,叶片MDA在胁迫中期即达到峰值。
面对逆境胁迫,植物体内会主动积累或降低一些渗透调节物质来提高细胞的保水和持水能力[38]。脯氨酸是植物对逆境反应敏感的一种重要渗透调节物质,这种物质有着较强的亲水性,能稳定胶质体组织内的代谢过程,同时又可以作为氧化还原的活化剂,消除或抵御植物体内氨积累所造成的毒害[12]。一般情况下,植物体内的脯氨酸随干旱胁迫程度增强大量积累,许多研究也证实脯氨酸与植物的抗旱能力成正比[28,39],脯氨酸也因此被认为是反映植物抗旱性强弱的重要参考生理指标。本试验表明,随着干旱胁迫时间的延长,6种灌木叶片的脯氨酸含量总体呈增加趋势(表8),表明植物通过积累脯氨酸提高了细胞的渗透调节能力。这与其他许多同类研究结果一致[20,38,40]。尽管如此,李燕等[12]在研究干旱胁迫对皂角(Gleditsiasinensis)苗木生理生化特性的影响时却发现脯氨酸随胁迫时间的延长呈先增后减的势态,并认为造成这种现象的原因可能与干旱后期植物生理机能紊乱而导致脯氨酸的降解有关。此外,也有研究表明脯氨酸与抗旱性之间呈负相关[13]。由此可见,有关脯氨酸适应干旱胁迫的调控机理仍有待进一步研究。
植物的抗旱性能是一个复杂的综合性状,受众多生理因素的共同影响,而各生理因素之间又存在着一定的关联,其重要性也不甚相同。对植物的抗旱性进行综合评价,当涉及到多种植物、多个评价指标时,由于各评价指标所表征的植物抗旱性的顺序往往不一致,利用一般的简单方法很难得出确切结果。如本研究中,从酶活性的角度反映出沙棘和锦鸡儿对干旱环境有着较强的酶系统自我调节能力与适应性,三颗针的活性氧清除能力及抗旱能力则相对较弱。从细胞膜稳定性来看,白刺花和黄栌细胞膜受损严重,电解质外渗较多,抗旱性弱。面对干旱胁迫羊蹄甲和三颗针分别表现出较强和较弱的脯氨酸渗透调节能力。本研究利用主成分分析法得出,6种灌木的抗旱性强弱由高到低的顺序依次为:羊蹄甲、沙棘、锦鸡儿、黄栌、白刺花、三颗针。综合分析表明,6种干旱河谷区灌木可通过提高抗氧化酶活性并积累渗透调节物质对干旱胁迫进行积极的反馈,以减弱逆境胁迫下活性氧对植物的危害,提高细胞的渗透调节能力,减轻细胞遭受的损伤。
参考文献(References):
[1] Moran J F, Becana M, Iturbe-Ormaetxe I, Frechilla S, Klucas R V, Aparicio-Tejo P. Drought induces oxidative stress in pea plants. Planta, 1994, 194(3): 346- 352.
[2] Souza R P, Machado E C, Silva J A B, Laga A M M A, Silveira J A G. Photosynthetic gas exchange, chlorophyll fluorescence and some associated metabolic changes in cowpea (Vignaunguiculata) during water stress and recovery. Environmental and Experimental Botany, 2004, 51(1): 45- 56.
[3] Flexas J, Medrano H. Drought-inhibition of photosynthesis in C3plants: stomatal and non-stomatal limitations revisited. Annals of Botany, 2002, 89(2): 183- 189.
[4] 丁龙, 赵慧敏, 曾文静, 李晴, 汪洋, 王四清. 五种西北旱区植物对干旱胁迫的生理响应. 应用生态学报, 2017, 28(5): 1455- 1463.
[5] 王卓敏, 郑欣颖, 薛立. 樟树幼苗对干旱胁迫和种植密度的生理响应. 生态学杂志, 2017, 36(6): 1495- 1502.
[6] 任瑞芬, 郭芳, 尹大芳, 赵凯, 杨秀云. 柠檬薄荷对干旱胁迫的形态和生理响应. 西北农业学报, 2016, 25(8): 1201- 1210.
[7] Vieira E A, das Graças Silva M, Moro C F, Laura V A. Physiological and biochemical changes attenuate the effects of drought on the Cerrado speciesVataireamacrocarpa(Benth.) Ducke. Plant Physiology and Biochemistry, 2017, 115: 472- 483.
[8] 裴斌, 张光灿, 张淑勇, 吴芹, 徐志强, 徐萍. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响. 生态学报, 2013, 33(5): 1386- 1396.
[9] 黄威龙, 李洁, 薛立, 列志旸. 4种绿化幼苗对干旱胁迫的生理响应. 中南林业科技大学学报, 2016, 36(7): 36- 40.
[10] 冯慧芳, 薛立, 任向荣, 傅静丹, 郑卫国, 史小玲. 4种阔叶幼苗对PEG模拟干旱的生理响应. 生态学报, 2011, 31(2): 371- 382.
[11] Michael B L, Elmore C D. Proline accumulation in water stressed cotton leaves. Crop Science, 1997, 17(6): 905- 908.
[12] 李燕, 孙明高, 孔艳菊, 薛立. 皂角苗木对干旱胁迫的生理生化反应. 华南农业大学学报, 2006, 27(3): 66- 69.
[13] 卢少云, 陈斯平, 陈斯曼, 梁潇, 郭振飞. 三种暖季型草坪草在干旱条件下脯氨酸含量和抗氧化酶活性的变化. 园艺学报, 2003, 30(3): 303- 306.
[14] Wang J Y, Turner N C, Liu Y X, Siddique K H M, Xiong Y C. Effects of drought stress on morphological, physiological and biochemical characteristics of wheat species differing in ploidy level. Functional Plant Biology, 2017, 44(2): 219- 234.
[16] 井大炜, 邢尚军, 杜振宇, 刘方春. 干旱胁迫对杨树幼苗生长、光合特性及活性氧代谢的影响. 应用生态学报, 2013, 24(7): 1809- 1816.
[17] 罗达, 冯秋红, 史作民, 李东胜, 杨昌旭, 刘千里, 何建社. 岷江干旱河谷区岷江柏人工林碳氮储量随林龄的动态. 应用生态学报, 2015, 26(4): 1099- 1105.
[18] Fang J M, Wu F Z, Yang W Q, Zhang J, Cai H X. Effects of drought on the growth and resource use efficiency of two endemic species in an arid ecotone. Acta Ecologica Sinica, 2012, 32(4): 195- 201.
[19] 蔡海霞, 吴福忠, 杨万勤. 干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响. 生态学报, 2011, 31(9): 2430- 2436.
[20] 王红梅, 包维楷, 李芳兰. 不同干旱胁迫强度下白刺花幼苗叶片的生理生化反应. 应用与环境生物学报, 2008, 14(6): 757- 762.
[21] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006.
[22] 余叔文, 汤章城. 植物生理与分子生物学. 北京: 科学出版社, 1998: 366- 389.
[23] 王瑞刚, 陈少良, 刘力源, 郝志勇, 翁海娇, 李鹤, 杨爽, 段杉. 盐胁迫下3种杨树的抗氧化能力与耐盐性研究. 北京林业大学学报, 2005, 27(3): 46- 52.
[24] 陈少裕. 膜脂过氧化对植物细胞的伤害. 植物生理学通讯, 1991, 27(2): 84- 90.
[25] 夏新莉, 郑彩霞, 尹伟伦. 土壤干旱胁迫对樟子松针叶膜脂过氧化、膜脂成分和乙烯释放的影响. 林业科学, 2000, 36(3): 8- 12.
[26] 舒卫国, 陈受宜. 植物在渗透胁迫下的基因表达及信号传递. 生物工程进展, 2000, 20(3): 3- 7.
[27] Chaitanya K V, Sundar D, Masilamani S, Reddy A R. Variation in heat stress-induced antioxidant enzyme activities among three mulberry cultivars. Plant Growth Regulation, 2002, 36(2): 175- 180.
[28] 范苏鲁, 苑兆和, 冯立娟, 王晓慧, 丁雪梅, 甄红丽. 干旱胁迫对大丽花生理生化指标的影响. 应用生态学报, 2011, 22(3): 651- 657.
[29] 张文辉, 段宝利, 周建云, 刘祥君. 不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应. 植物生态学报, 2004, 28(4): 483- 490.
[30] Kusvuran S, Dasgan H Y. Effects of drought stress on physiological and biochemical changes inPhaseolusvulgarisL. Legume Research, 2017, 40(1): 55- 62.
[31] 崔秀妹, 刘信宝, 李志华, 孙凯燕, 李卉, 张婷婷. 不同水分胁迫下水杨酸对分枝期扁蓿豆生长及光合生理的影响. 草业学报, 2012, 21(6): 82- 93.
[32] 罗达, 潘存德, 周俊, 罗明, 季华, 李硕. 干旱及盐双胁迫下内生固氮菌接种对多枝柽柳实生苗生理特性的影响. 干旱区地理, 2012, 35(1): 154- 161.
[33] 朱会娟, 王瑞刚, 陈少良, 张云霞, 李妮亚, 邵杰. NaCl胁迫下胡杨(Populuseuphratica)和群众杨(P.popularis)抗氧化能力及耐盐性. 生态学报, 2007, 27(10): 4113- 412l.
[34] 张建锋, 李吉跃, 宋玉民, 邢尚军, 郗金标, 马丙尧. 植物耐盐机理与耐盐植物选育研究进展. 世界林业研究, 2003, 16(2): 16- 22.
[35] 马丽清, 韩振海, 周二峰, 许雪峰. 盐胁迫对珠美海棠和山定子膜保护酶系统的影响. 果树学报, 2006, 23(4): 495- 499.
[36] 周国贤, 郭世荣, 王素平. 外源多胺对低氧胁迫下黄瓜幼苗光合特性和膜脂过氧化的影响. 植物学通报, 2006, 23(4): 341- 347.
[37] 迟琳琳. 科尔沁沙地4种灌木对干旱胁迫的生理响应. 干旱区资源与环境, 2017, 31(5): 158- 162.
[38] 李秀玲, 刘开强, 杨志民, 李立志, 卜朝阳, 邓俭英, 刘君. 干旱胁迫对4种观赏草枯叶率及生理指标的影响. 草地学报, 2012, 20(1): 76- 82.
[39] 潘昕, 李吉跃, 王军辉, 何茜, 苏艳, 马建伟, 杜坤. 干旱胁迫对青藏高原4种灌木生理指标的影响. 林业科学研究, 2013, 26(3): 352- 358.
[40] 潘昕, 邱权, 李吉跃, 王军辉, 何茜, 苏艳, 马建伟, 杜坤. 干旱胁迫对青藏高原6种植物生理指标的影响. 生态学报, 2014, 34(13): 3558- 3567.

