鄂尔多斯高原不同年限弃耕农田土壤养分特征
杨 柳,蔡文涛,来利明,周继华,姜联合,郑元润†
(1.中国科学院植物研究所北方资源重点实验室,100093,北京;2.中国科学院大学,100049,北京)
在干旱与半干旱草地生态系统,本土灌木或木本植物密度、盖度和生物量增加的全球普遍发生的现象称为草地灌丛化[1]。灌丛化是干旱与半干旱区植被退化的主要表现形式[2],是全球干旱与半干旱区面临的重要生态问题[3]。草原生态系统中,灌木激增被看作是草原退化和沙漠化的一个重要标志[4],这种由以草本植物为优势向以灌木植物为优势的植被变化,通常是不可逆的[5]。在美洲[6]、非洲[7]、澳大利亚[8]、地中海地区[9]和内蒙古地区[10]均有灌丛化发生的报道。气候变化[11]、CO2浓度升高[12]、火烧[13]、放牧[14]和土地利用方式的改变[15]等因素,都会造成灌丛化,灌丛化通常会影响草地生物量与生物多样性,造成生态系统功能下降[16]。
尽管草地灌丛化发生的时间仍存在争议,但基本上是在19世纪中后期开始明显增加,20世纪呈现加速发展的趋势[17],受到国内外学者的广泛关注。研究表明,大约10%~20%的干旱与半干旱区正在经历草地灌丛化[18]。国内外学者对于草地灌丛化的研究,多集中于受自然因素和人为因素干扰的灌丛化区域,如灌丛化导致北美草原和奇奇瓦沙漠群落物种丰富度显著下降[6,15];人为干扰使内蒙古高原草本植物的水分获取能力降低,导致灌木生物量增加,加剧灌丛化的发生[19]。但关于草地灌丛化区域弃耕农田植被与土壤变化的报道较少,如弃耕地植被演替过程中土样养分质量分数的变化[20],弃耕地植物群落物种多样性特征[21]的研究等。农田弃耕主要是由于土壤肥力下降所致,农田弃耕后土壤理化性质,植物群落组成和生物多样性等均会发生变化。
鄂尔多斯高原为我国典型的生态过渡带,属于农牧交错带,由于过度放牧、土地开垦和气候变化等因素影响,地带性植被本氏针茅(Stipabungeana)草原已发生严重灌丛化,成为以半灌木油蒿(Artemisiaordosica)为主的草地。由于鄂尔多斯高原土地开垦历史较长,存在不同年限的弃耕农田,在经历时间不等的弃耕后,植物群落组成和土壤理化性质均发生不同程度的变化,且存在由以油蒿为主的灌丛化草地向地带性本氏针茅草原演替的趋势;因此,鄂尔多斯高原是研究土地开垦对草地灌丛化发生过程及其可恢复性的理想场所。笔者通过对鄂尔多斯高原不同年限弃耕农田土壤养分变化的研究,揭示随弃耕年限增加,弃耕农田土壤养分变化特征及其与地上植物群落的关系,为鄂尔多斯高原弃耕农田的植被恢复提供科学依据。
1 研究区概况
鄂尔多斯高原位于温带季风区西缘,冬季寒冷,夏季凉爽,年平均气温为6~8 ℃,年均降水量为150~500 mm,集中于7—9月。鄂尔多斯高原的景观类型大致可分为软梁、硬梁和滩地3种类型,其中,软梁和硬梁占90%左右,土壤主要为栗钙土或淡栗钙土。鄂尔多斯高原地带性植被为暖温带本氏针茅草原,半灌木油蒿群落是风沙土上最普遍的植被类型,软梁和硬梁弃耕农田为鄂尔多斯高原弃耕农田的主体部分。研究地点位于鄂尔多斯市伊金霍洛旗中部伊金霍洛镇,介于E 109°50′~109°52′,N 39°24~39°26′的弃耕农田上。
2 材料与方法
2.1 试验设置
野外试验于2015年5—10月植物生长季进行。分别在软梁和硬梁选择具有代表性的弃耕农田,并设置样地,软梁农田的弃耕年限为1、6、10、15和20年,硬梁农田的弃耕年限为3、6、10、15和20年,以自然植被作为对照(CK),但由于放牧的影响,仅作为未开垦样地的参考。每个样地设置3个重复,灌木植物群落样方为5 m×5 m,草本植物群落样方为1 m×1 m,共计36个样方。记录样地的物种组成、群落盖度、高度和密度等指标。为保证各样地的可比性和环境条件的一致性,软梁和硬梁不同年限弃耕样地及对照样地尽量集中在2 km的范围内。
采用环刀法采取土壤样品,取样时间为5—10月每月中旬。软梁取样深度为0~50 cm,在0~10 cm土层每隔5 cm取样,取2层土样;在10~50 cm土层每隔10 cm分层取样,取4层土样。土壤样品取样个数为6,3次重复。硬梁取样深度为0~40 cm,在0~10 cm土层每隔5 cm取样,取2层土样;在10~40 cm土层每隔10 cm分层取样,取3层土样。土壤样品取样个数为5,3次重复。样品带回实验室于105 ℃烘干至恒质量。
2.2 测定方法
土壤全碳、全氮采用元素分析仪法(电感耦合等离子体发射光谱仪(iCAP 6300 ICP-OES Spectrpmeter,Thermo Scientific,USA))测定;土壤全磷、全钾采用HF-HClO4-HNO3消解- ICP法(vario EL III CHNOS Elemental Analyzer,Elementar Analysensysteme GmbH,Germany)测定。
2.3 数据处理与分析
采用SPSS 17.0软件进行数据统计,全碳、全氮、全磷、全钾和C/N采用双因素方差分析(two-way ANOVA)和新复极差法(Duncan)进行多重比较。
3 结果与分析
对于软梁弃耕农田,不同弃耕年限对土壤全碳、全氮、全磷、全钾和C/N影响极显著(P<0.01);土层深度对全钾影响不显著(P>0.05),对全碳、全氮、全磷、C/N影响极显著(P<0.01);弃耕年限与土层深度的交互作用对全钾影响不显著(P>0.05),对全氮、全磷、C/N影响极显著(P<0.01),对全碳影响显著(P<0.05)。对于硬梁弃耕农田,不同弃耕年限对土壤全碳、全氮、全钾和C/N影响极显著(P<0.01),对全磷影响显著(P<0.05);土层深度对全钾影响不显著(P>0.05),对全氮、C/N影响极显著(P<0.01),对全碳、全磷影响显著(P<0.05);弃耕年限与土层深度的交互作用对全碳、全磷、全钾影响不显著(P>0.05),对全氮、C/N影响极显著(P<0.01)。
3.1 弃耕农田土壤养分质量分数变化
对于软梁弃耕农田,同一土层不同弃耕年限土壤全碳质量分数变化差异显著。随弃耕年限增加,0~10 cm土层全碳质量分数呈先减小后增加趋势;10~50 cm土层全碳质量分数呈先减小后增加再减小趋势。同一弃耕年限不同土层土壤全碳质量分数有所不同。随土层深度增加,弃耕1年全碳质量分数呈上升趋势;弃耕6、10、15和20年、自然植被(CK)全碳质量分数呈降低趋势(表1)。
同一土层不同弃耕年限土壤全氮质量分数变化差异显著。随弃耕年限增加,全氮质量分数总体呈增加趋势。同一弃耕年限,土壤全氮质量分数随土层深度增加呈降低趋势(表1)。
除40~50 cm土层外,同一土层不同弃耕年限土壤全磷质量分数变化差异显著。随弃耕年限增加,全磷质量分数总体呈增加趋势。同一弃耕年限,土壤全磷质量分数随土层深度增加呈减小趋势(表1)。
除0~5 cm土层外,同一土层不同弃耕年限土壤全钾质量分数变化差异显著。土壤全钾质量分数在弃耕过程中变化幅度较小,在20.63~25.17 g/kg范围内波动(表1)。
对于硬梁弃耕农田,同一土层不同弃耕年限土壤全碳质量分数变化差异显著。随弃耕年限增加,0~20 cm土层全碳质量分数呈先减小后增加再减小趋势;20~40 cm土层全碳质量分数呈先增加后减小趋势。同一弃耕年限不同土层土壤全碳质量分数有所不同。随土层深度增加,弃耕3、6、10、15年全碳质量分数呈增加趋势,弃耕20年、自然植被(CK)全碳质量分数呈减小趋势(表2)。
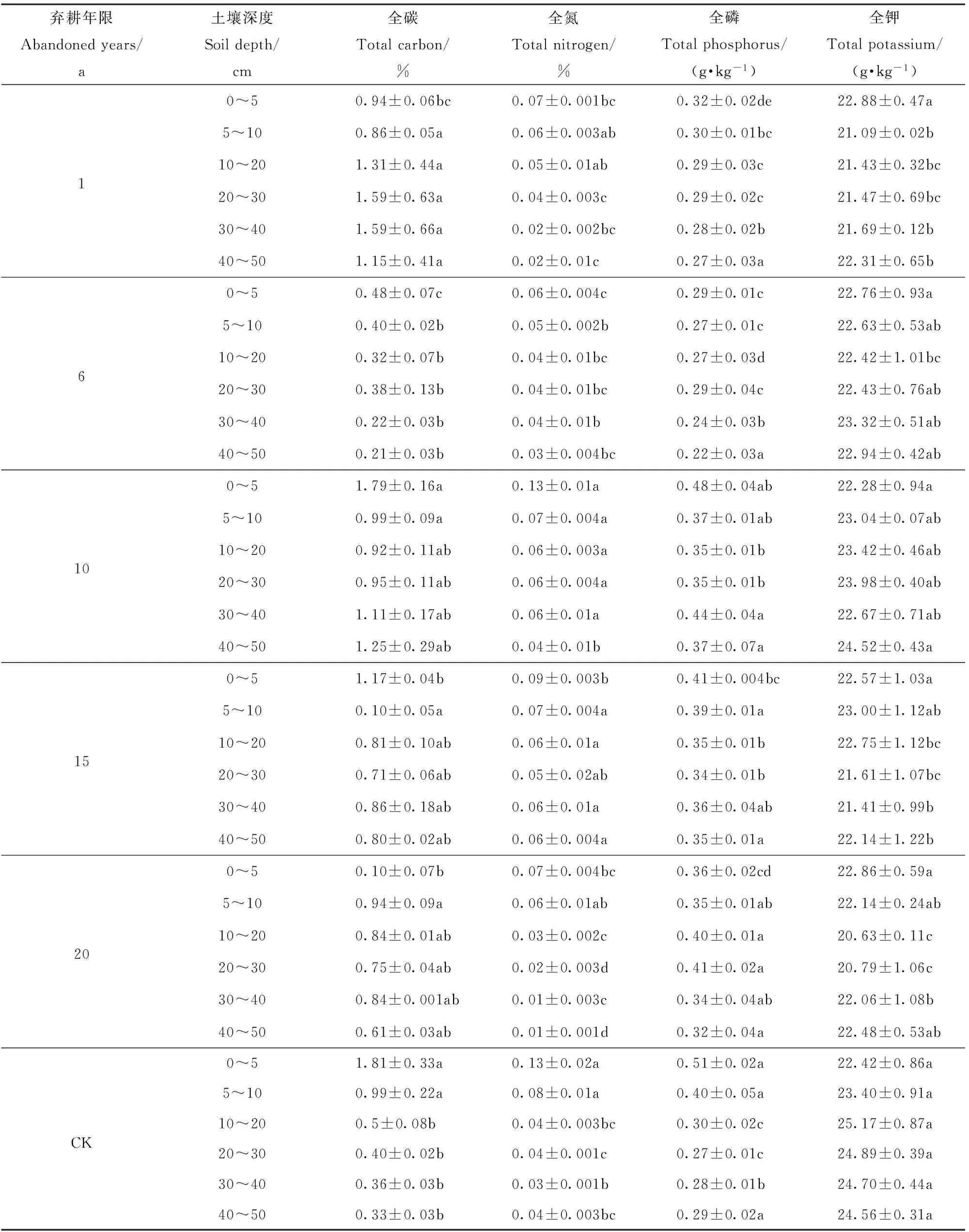
表1 软梁弃耕农田土壤养分质量分数(平均值±标准误)Tab.1 Content of soil nutrients in abandoned croplands of Ruanliang (Mean±SE)
注:表中不同小写字母表示同一土层不同弃耕年限间差异显著(P<0.05)。样本数为108。Notes: Different normal letters for the same layer indicate significant difference among different abandoned years at 0.05 levels. Samples’ number is 108.
除0~5 cm土层外,同一土层不同弃耕年限土壤全氮质量分数变化差异显著。随弃耕年限增加,0~10 cm土层全氮质量分数呈先减小后增加趋势;10~40 cm土层全氮质量分数呈先增加后减小趋势。同一弃耕年限随土层深度增加,弃耕6年全氮质量分数呈波动变化;其他年限土壤全氮质量分数呈下降趋势(表2)。

表2 硬梁弃耕农田土壤养分质量分数(平均值±标准误)Tab.2 Content of soil nutrients in abandoned croplands of Yingliang (Mean±SE)
注:表中不同小写字母表示同一土层不同弃耕年限间差异显著(P<0.05)。样本数为90。 Notes: Different normal letters for the same layer indicate significant difference among different abandoned years at 0.05 levels. Sample’s number is 90.
除10~20和30~40 cm土层外,同一土层不同弃耕年限土壤全磷质量分数变化差异显著。随弃耕年限增加,0~10和30~40 cm土层全磷质量分数呈先减小后增加趋势;10~30 cm土层全磷质量分数呈先增加后减小趋势。随土层深度增加,弃耕3、6、15和20年全磷质量分数呈下降趋势;弃耕10年、自然植被(CK)全磷质量分数呈先减小后上升趋势(表2)。
同一土层不同弃耕年限土壤全钾质量分数变化差异显著。随弃耕年限增加,0~10 cm土层全磷质量分数呈先增加后减小趋势;10~40 cm土层全磷质量分数呈减小趋势。随土层深度增加,弃耕3、20年全钾质量分数呈上升趋势;弃耕6、10年全钾质量分数呈下降趋势;弃耕15年、自然植被(CK)全钾质量分数变化趋势不明显(表2)。
3.2 弃耕农田土壤C/N变化特征
对于软梁弃耕农田,随弃耕年限增加,0~10 cm土层土壤C/N呈先减小后增加趋势;10~40 cm土层土壤C/N呈先减小后增加再减小趋势;40~50 cm土层土壤C/N变化趋势不明显。同一弃耕年限不同土层土壤C/N变化有所不同,随土层深度增加,弃耕1、6、10、15和20年土壤C/N呈上升趋势,自然植被(CK)土壤C/N呈下降趋势(图1a)。
对于硬梁弃耕农田,随弃耕年限增加,各土层土壤C/N呈先减小后增加再减小趋势。同一弃耕年限不同土层土壤C/N变化有所不同。随着土层深度的增加,土壤C/N呈增加的趋势(图1b)。
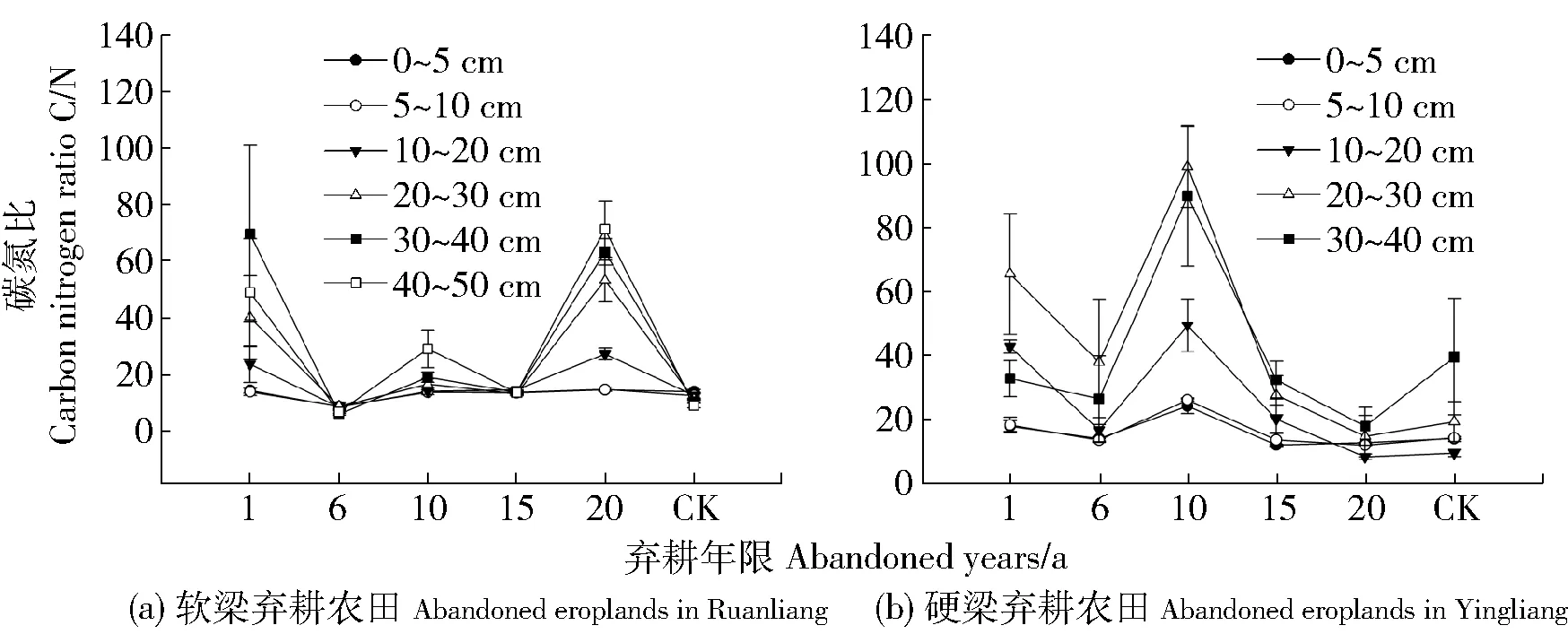
(a)样本数为108;(b)样本数为90。Samples’ number in (a) is 108, and samples’ number in (b) is 90.图1 不同弃耕农田土壤C/N (平均值±标准误)Fig.1 C/N in different abandoned croplands (mean±SE)
4 讨论
研究表明,随着土壤深度的增加,土壤养分质量分数总体呈下降趋势,随着弃耕年限增加,土壤养分质量分数总体呈逐步增加或先增加后减小趋势[22]。
蔡文涛[23]研究表明,鄂尔多斯高原软梁弃耕农田群落演替可分为3个阶段:1、2年生杂草群落阶段(狗尾草(Setariaviridis)+沙蓬(Agriophyllumsquarrosum));油蒿(Artemisiaordosica)灌丛化草地阶段;多年生草本植物群落阶段。硬梁弃耕农田演替过程经历了杂草和本氏针茅草地2个阶段。与上述演替过程相适应,土壤养分也会发生规律性变化。在软梁和硬梁2种不同景观类型中,弃耕农田植被恢复过程中的土壤养分变化规律不同。随弃耕年限增加,软梁弃耕农田土壤养分总体呈逐步增加的趋势,这可能由于在植被恢复过程中,枯落物大量积累,经过微生物的分解,使得土壤有机质质量分数增加,加之根际微生物的作用,使土壤养分质量分数呈增加的趋势[24];土壤全碳在弃耕6年时出现降低,这可能由于弃耕恢复初期,植被迅速生长消耗了土壤中的大量养分,使土壤全碳质量分数出现暂时回落[25];另一个重要原因是,此时半灌木植物油蒿开始出现,半灌木快速生长,导致有机质质量分数降低。随着土层深度的增加,土壤养分呈减小的趋势,表层土壤养分质量分数要高于深层土壤养分质量分数,具有表聚性[26]。土壤全钾质量分数呈波动变化,这可能是弃耕农田植被恢复过程中产生的土壤养分效应[24]。在硬梁弃耕农田,不同土层深度和不同弃耕年限的土壤养分质量分数变化趋势不同,这可能是由于硬梁农田植被恢复过程中,土壤养分消耗和积累动态平衡所导致的趋势差异,也可能由于硬梁和软梁本身土壤组成的差异,以及硬梁植被演替并未经过半灌木油蒿,而由杂草群落阶段逐步过渡到本氏针茅阶段有关。
土地利用方式改变会影响植被生产力与土壤养分质量分数,土壤C/N也会发生变化,全球平均土壤C/N约为13.33[27]。研究表明,随着土壤深度与弃耕年限增加,土壤C/N呈减小的趋势[28]。笔者研究中,软梁和硬梁弃耕农田土壤C/N变化趋势不同,这可能是由于植被恢复过程中,植被的枯落物对土壤不同养分的回归作用不同,导致土壤中碳和氮的积累量存在差异[29],而出现土壤C/N变化不同。其次,对于软梁弃耕农田,C/N分别在半灌木入侵的主要阶段(弃耕10年)和多年生草本植物出现阶段(弃耕20年)出现2个高峰,由于油蒿为鄂尔多斯高原的偏途顶级群落,多年生草本植物为鄂尔多斯高原相对稳定的植物群落,表明稳定植物群落的存在会相对提高土壤的C/N比。而硬梁则由杂草阶段逐渐过渡到地带性本氏草茅群落,因而在植被恢复过程中,仅在第10年出现较为明显的C/N高峰。
尽管鄂尔多斯高原已实行禁牧政策,在具体执行过程中,仍存在一定程度的放牧,但放牧强度与过去相比大幅度降低。笔者研究中,无论是不同时限的弃耕农田样地,还是对照样地,均存在一定放牧干扰现象;因而,不同弃耕年限弃耕农田土壤养分的变化与不存在人为干扰的样地会存在较大差别,变化规律可能不及弃耕后围封去除人为干扰的样地明显,但提供了农田弃耕后,自然恢复与放牧综合影响下,土壤养分变化规律的基础数据,与目前我国弃耕农田的实际更为吻合。其次,由于在进行农业耕作时,会施加有机肥及化肥;因此,在弃耕一定时期内,由于不再施加肥料,弃耕农田土壤养分发生一定程度下降的趋势是较为普遍的现象。
[1] VAN AUKEN O W. Shrub invasions of North American semiarid grasslands[J]. Annual Review of Ecology and Systematics, 2000, 31: 197.
[2] ELDRIDGE D J, BOWKER M A, MAESTRE F T, et al. Impacts of shrub encroachment on ecosystem structure and functioning: towards a global synthesis[J]. Ecology Letters, 2011, 14(7): 709.
[3] 彭海英, 李小雁, 童绍玉. 内蒙古典型草原灌丛化对生物量和生物多样性的影响[J]. 生态学报, 2013, 33(22): 7221.
PENG Haiying, LI Xiaoyan, TONG Shaoyu. Effects of shrub encroachment on biomass and biodiversity in the typical steppe of Inner Mongolia[J]. Acta Ecologica Sinica, 2013, 3(22): 7221.
[4] ZHANG Yong, GAO Qiong, XU Li, et al. Shrubs proliferated within a six-year enclosure in a temperate grassland-spatiotemporal relationships between vegetation and soil variables[J]. Science in Cold and Arid Regions, 2014, 36(2): 139.
[5] SILVA F H B D, ARIEIRA J, PAROLIN P, et al. Shrub encroachment influences herbaceous communities in flooded grasslands of a neotropical savanna wetland[J]. Applied Vegetation Science, 2016, 19(3): 391.
[6] RATAJCZAK Z, NIPPERT J B, COLLINS S L. Woody encroachment decreases diversity across North American grasslands and savannas[J]. Ecology, 2012, 93(4): 697.
[7] WARD D, HOFFMAN M T, COLLOCOTT S J. A century of woody plant encroachment in the dry Kimberley savanna of South Africa[J]. African Journal of Range and Forage Science, 2014, 31(2): 107.
[8] HOWARD K S C, ELDRIDGE D J, SOLIVERES S. Positive effects of shrubs on plant species diversity do not change along a gradient in grazing pressure in an arid shrubland[J]. Basic and Applied Ecology, 2012, 13(2): 159.
[9] QUERO J L, MAESTRE F T, OCHOA V, et al. On the importance of shrub encroachment by sprouters, climate, species richness and anthropic factors for ecosystem multifunctionality in semi-arid Mediterranean ecosystems[J]. Ecosystems, 2013, 16(7):1248.
[10] HU Xia, LI Zongchao, LI Xiaoyan, et al. Influence of shrub encroachment on CT-measured soil macropore characteristics in the Inner Mongolia grassland of northern China[J]. Soil and Tillage Research, 2015, 150: 1.
[11] DEVINE A P, MCDONALD R A, QUAIFE T, et al. Determinants of woody encroachment and cover in African savannas[J]. Oecologia, 2017, 183: 939.
[12] D′ODORICO P, OKIN G S, BESTELMEYER B T. A synthetic review of feedbacks and drivers of shrub encroachment in arid grasslands[J]. Ecohydrology, 2012, 5(5): 520.
[13] CARACCIOLO D, ISTANBULLUOGLU E, NOTO L V, et al. Mechanisms of shrub encroachment into Northern Chihuahuan Desert grasslands and impacts of climate change investigated using a cellular automata model[J]. Advances in Water Resources, 2016, 91: 46.
[14] ELDRIDGE D J, SANTIAGO S, BOWKER M A, et al. Grazing dampens the positive effects of shrub encroachment on ecosystem functions in a semi-arid woodland[J]. Journal of Applied Ecology, 2013, 50(4): 1028.
[15] HE Yufei, D′ODORICO P, DE WEKKER S F J. The role of vegetation-microclimate feedback in promoting shrub encroachment in the northern Chihuahuan desert[J]. Global Change Biology, 2015, 21(6): 2141.
[16] ELDRIDGE D J, SOLIVERES S. Are shrubs really a sign of declining ecosystem function? Disentangling the myths and truths of woody encroachment in Australia[J]. Australian Journal of Botany, 2014, 62(7): 594.
[17] MILLER R F, TAUSCH R J, MCARTHUR E D, et al. Age structure and expansion of Pinon-juniper woodlands: a regional perspective in the intermountain west[R]. Research Paper RMRS-RP-69. USDA, Forrest Service, Rocky Mountain Research Station, Fort Collins, Colorado, 2008:1.
[18] REYNOLDS J F, SMITH D M, LAMBIN E F, et al. Global desertification: building a science for dryland development[J]. Science, 2007, 316: 847.
[19] PENG Haiying, LI Xiaoyan, LI Guangyong, et al. Shrub encroachment with increasing anthropogenic disturbance in the semiarid Inner Mongolian grasslands of China[J]. Catena, 2013, 109(5): 39
[20] DENG Lei, SHANGGUAN Zhouping, SWEENEY S. Changes in soil carbon and nitrogen following land abandonment of farmland on the Loess Plateau, China[J]. PloS One, 2013, 8(8):e71923.
[21] HOU Jian, FU Bojie. Vegetation dynamics during different abandoned year spans in the land of the Loess Plateau of China[J]. Environmental Monitoring and Assessment, 2014, 186(2):1133.
[22] DUCHICELA J, SULLIVAN T S, BONTTI E, et al. Soil aggregate stability increase is strongly related to fungal community succession along an abandoned agricultural field chronosequence in the Bolivian Altiplano[J]. Journal of Applied Ecology, 2013, 50(50): 1266.
[23] 蔡文涛. 鄂尔多斯高原弃耕农田植被与土壤物理性质动态[D].北京:中国科学院大学, 2016:1.
CAI Wentao. Dynamics of the vegetation, soil physical property in the abandoned croplands in Ordos plateau[D]. Beijing: University of Chinese Academy of Sciences, 2016:1.
[24] 宋娟丽, 吴发启, 姚军, 等. 弃耕地植被恢复过程中土壤酶活性与理化特性演变趋势研究[J]. 西北农林科技大学学报(自然科学版), 2009, 37(4): 103.
SONG Juanli, WU Faqi, YAO Jun, et al. Changes of soil physical and chemical properties during vegetation restoration on abandoned cropland[J]. Journal of Northwest A & F University(Natural Science Edition), 2009, 37(4): 103.
[25] 宋娟丽, 吴发启, 姚军, 等. 弃耕地植被恢复过程中土壤理化性质演变趋势研究[J]. 干旱地区农业研究, 2009, 27(3): 168.
SONG Juanli, WU Faqi, YAO Jun, et al. Changes of soil physical and chemical properties during vegetation restoration on abandoned cropland[J]. Agricultural Research in the Arid Areas, 2009, 27(3): 168.
[26] 张海东, 汝海丽, 焦峰, 等. 黄土丘陵区退耕时间序列梯度上草本植被群落与土壤C、N、P、K化学计量学特征[J]. 环境科学, 2016, 37(3): 1128.
ZHANG Haidong, RU Haili, JIAO Feng, et al. C, N, P, K stoichiometric characteristic of leaves, root and soil in different abandoned years in Loess Plateau[J]. Environmental Science, 2016, 37(3): 1128.
[27] CLEVELAND C C, LIPTZIN D. C: N: P stoichiometry in soil: Is there a “Redfield ratio” for the microbial biomass?[J]. Biogeochemistry, 2007, 85(3): 235.
[28] 安慧, 杨新国, 刘秉儒, 等. 荒漠草原区弃耕地植被演替过程中植物群落生物量及土壤养分变化[J]. 应用生态学报, 2011, 22(12): 3145.
AN Hui, YANG Xinguo, LIU Bingru, et al. Changes of plant community biomass and soil nutrients during the vegetation succession on abandoned cultivated land in desert steppe region[J]. Chinese Journal of Applied Ecology, 2011, 22(12): 3145.
[29] 薛超玉, 焦峰, 张海东, 等. 黄土丘陵区弃耕地恢复过程中土壤与植物恢复特征[J]. 草业科学, 2016, 33(3): 368.
XUE Chaoyu, JIAO Feng, ZHANG Haidong, et al. The characteristics of plant species and soil quality in the restoration process of the Loess Hilly Region[J]. Pratacultural Science, 2016, 33(3): 368.

