气相色谱-质谱法测定热带水果中植物甾醇的含量
李涛 李琪 林丽云
摘 要 为探究热带水果中植物甾醇的种类和含量。将香蕉、火龙果、木瓜、菠萝、龙眼样品进行冷冻干燥处理、索氏抽提、皂化提取、衍生,采用气相色谱-质谱(GC-MS)法进行麦角甾醇、菜油甾烷醇、菜油甾醇、豆甾醇、谷甾醇的分析测定,并用胆甾烷醇内标法进行定量分析。结果表明:菜油甾烷醇、麦角甾醇均为未检出。5种甾醇的含量总和为4.05~34.89 mg/100 g,含量顺序为火龙果>菠萝>木瓜>香蕉>龙眼。
关键词 植物甾醇;气相色谱-质谱法;热带水果中图分类号 R151.3 文献标识码 A
植物甾醇是一类天然功能活性物质,广泛存在于植物细胞与组织中。植物甾醇与胆固醇具有同样的环状结构,区别在于其侧链的不同[1]。植物甾醇可以抑制人体对胆固醇的吸收,防止动脉硬化,同时,还具有抗肿瘤、提高免疫力等多种生理功能[2]。人体内不能合成植物甾醇,也不能由胆甾醇转化而成,只能由食物中摄取[3-4]。因此,在每日膳食结构中所摄入的食品、农产品中植物甾醇的种类和含量等方面的研究受到人们越来越多的关注。
近年来,文献报道对甾醇的测定方法有薄层色谱法[5]、电化学法[6]、液相色谱法[7]、气相色谱法[8]等,每种方法都有优、缺点。气相质谱法因其具有较高的灵敏度和精密度、可以同时多组分分析、不需要大量的试剂作为流动相等优点得到广大研究者的认可。杨春英等[9]采用气相质谱法测定14种食用植物油中的植物甾醇,陈树东等[10]采用气相质谱法测定植物油。文献报道中甾醇的研究多集中在粮油谷物[9-12],水果方面的甾醇研究主要是苹果、梨、桃等一些温带水果[13]。关于热带水果的甾醇种类和含量的论文鲜有报道。因此,为了满足消费者的消费需求,本研究采用气相质谱法对几种热带水果甾醇进行测定分析,填补热带水果甾醇含量的数据,为热带水果后续产品的开发和加工提供数据支撑。
1 材料与方法
1.1 样品
本研究选取香蕉、菠萝、木瓜、火龙果、龙眼5种热带水果为研究对象,在超市、水果店等消费环节随机取样,每个品种取5个样品,每个样品采样量在1 kg,将每个品种的5个样品匀浆作为一个品种的样品进行分析。
1.2 仪器与试剂
气相色谱质谱联用仪(5975C),美国Organmation公司;冷冻干燥机(ALPHAI-2LD),德国CHRIST公司;超低温冷冻储存箱(BCD-5654DS),中科美菱;氮吹仪(N-EVAP24),美国Organmation公司;索氏浸提仪(2050),美国Foss Analytical AB;电子天平(AUX 220),日本岛津。
麦角甾醇(纯度98%)、菜油甾烷醇、菜油甾醇(纯度98%),J&K公司;豆甾醇(纯度95%)、谷甾醇(纯度≥97%),Sigma公司。
正己烷、二氯甲烷、丙酮(均为色谱纯),天津市科密欧化学试剂有限公司;石油醚、氢氧化钾、乙醇(均为分析纯),广州化学试剂厂,水为符合GB/T 6682规定的一级水。
1.3 方法
1.3.1 样品制备 取样品可食部分,冷冻干燥处理(14 Pa,-50 ℃,24~48 h),粉碎过40目筛,备用。
1.3.2 水分测定 参照GB 5009.3-2010进行水分测定。
1.3.3 脂肪提取 参照GB/T 5009.6-2016将1.3.1的备用样品进行油脂抽提。
1.3.4 总甾醇的皂化和提取 取油脂样品100 μL,加入50 μg膽甾烷醇作为内标,用2 mol/L KOH乙醇溶液4 mL和二氯甲烷0.5 mL涡旋震荡1 min混匀。70 ℃水浴震荡45 min,室温冷却。加入二氯甲烷5 mL,超纯水3 mL混合均匀,离心后去除上清液,再用5 mL超纯水洗3次下层液体(每次去除上清液),氮吹仪吹干有机相备用。
1.3.5 TMS衍生 加入100 μL衍生剂MSHFBA∶1-MIN(95∶5,V/V)75 ℃衍生20 min,正己烷定容1 mL过滤膜上机检测。
1.4 仪器工作条件
1.4.1 色谱条件 毛细管柱:HP-5MS柱(30 m× 0.25 mm×0.25 μm);升温程序:起始温度100 ℃保持1 min,以50 ℃/min升至250 ℃,然后以10 ℃/min升至280 ℃,保持17 min。进样口温度250 ℃;柱流速:1.2 mL/min。
1.4.2 质谱条件 电子轰击离子源(EI),电子能量70 eV,离子源温度230 ℃,接口温度280 ℃,监测方式:SIM模式。
1.5 标准溶液配制
称取甾醇标准品5 mg,用丙酮溶解并定容至5 mL,配制成1 mg/mL的标准品储备液。在-20 ℃保存。
1.6 数据处理
采用气相色谱法-质谱法对待测组分进行测定,根据保留时间定性、峰面积定量,以胆甾烷醇为内标参比计算甾醇含量。
2 结果与分析
2.1 色谱、质谱条件的优化
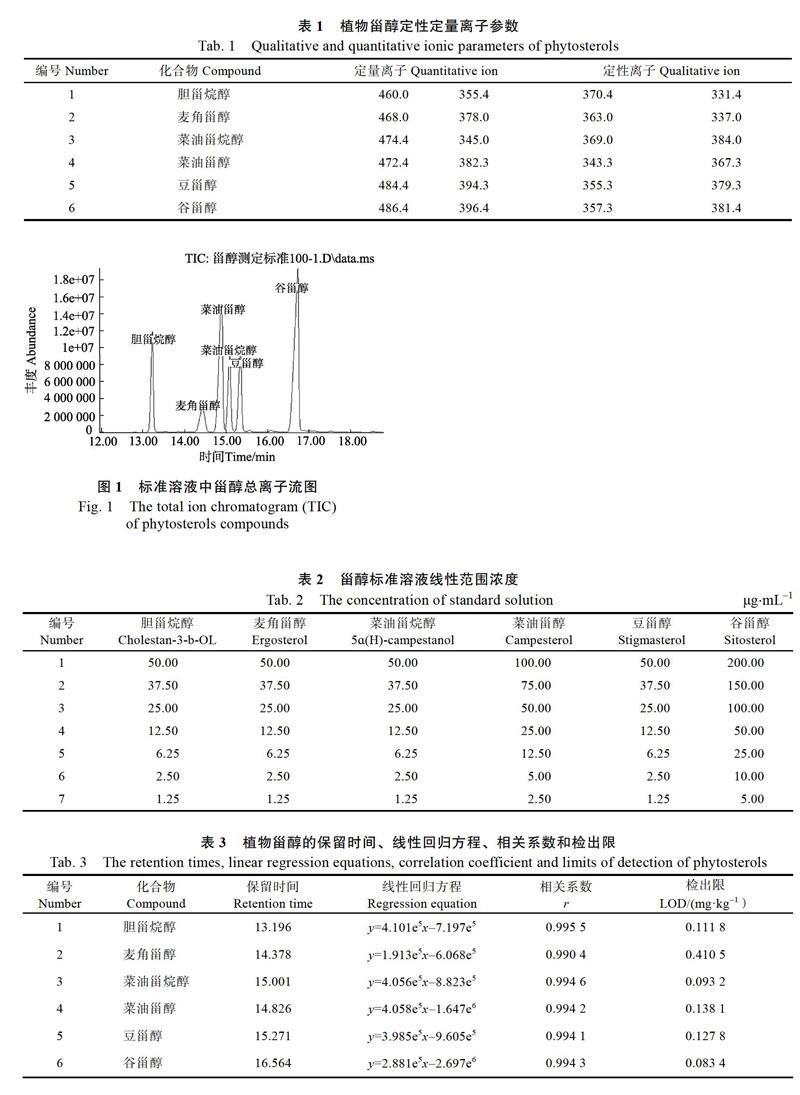
考察60、80、100、120 ℃共4个水平的起始柱温,为了使目标化合物较好地分离和提高分离效率,最终确定100 ℃为柱子起始温度,并保持1 min,以50 ℃/min升至250 ℃。确定起始温度后,升温速率是影响分离的关键因素,选取5、10、15、20 ℃/min共4个升温速率优化实验,升温速率为5 ℃/min时,分析时间久且峰形差;升温速率为15、20 ℃/min时,分析时间短,但容易出现重叠峰,目标化合物分离不完全。因此,根据目标化合物的分离效果、峰型、分析时间等因素。确定采用10 ℃/min为最佳升温速率。实验条件优化后升温程序为起始温度100 ℃,保持1 min,以50 ℃/min升至250 ℃,然后以10 ℃/min升至280 ℃。在此条件下,目标化合物在17 min内得到较好的分离。并采用SIM扫描模式针对目标化合物的特征离子进行监测。定性定量离子参数见表1,总离子流图见图1。
2.2 线性范围和检出限
在最优的实验条件下,配制一系列浓度的甾醇标准溶液进行测试,标准曲线中谷甾醇浓度为200、150、100、50、25、10、5 μg/mL甾醇混合标准溶液,其他甾醇浓度见表2。进样体积为1 μL。以甾醇浓度为横坐标,峰高为纵坐标,计算得出标准线性回归方程、相关系数、检出限,从表3可知各甾醇具有良好的线性关系。
2.3 加标回收实验
在样品中添加2、5、10 mg/kg浓度,测定各甾醇的回收率,按1.3方法进行皂化、提取、衍生,其加标的回收率在78%~102%,回收率的相对标准偏差小于5.0%,说明本研究的方法精密度和准确度良好。
2.4 样品中甾醇的含量测定
植物甾醇含量、香蕉的脂肪含量均以干基计,样品中水分含量和脂肪含量见表4。从表5可知,5种样品中菜油甾烷醇、麦角甾醇均为未检出,菜油甾醇的含量范围为0.55~16.41 mg/100 g,含量较高的为菠萝。豆甾醇的含量范围为0.36~ 20.03 mg/100 g,含量较高的为火龙果。谷甾醇的含量范围为3.52~16.51 mg/100 g,含量较高的为菠萝。5种甾醇的含量总和为4.05~34.89 mg/100 g,由多到少为火龙果>菠萝>木瓜>香蕉>龙眼。
3 讨论
植物甾醇测定的种类为麦角甾醇、菜油甾烷醇、菜油甾醇、豆甾醇、谷甾醇,根据化学结构把这5种植物甾醇分类[14],豆甾醇、麦角甾醇、谷甾醇、菜油甾醇、菜油甾烷醇属于同一类,由于这一类的甾醇广泛分布于植物中,目前文献对这一类的研究较多。本研究建立了采用GC-MS分析热带水果中植物甾醇含量的方法,该方法高效、科学、准确。利用该方法分析香蕉、火龙果、木瓜、菠萝、龙眼样品中的植物甾醇,均为未检出菜油甾烷醇和麦角甾醇。麦角甾醇是真菌细胞膜的重要组成成分[15],菜油甾烷醇是植物甾醇的饱和形式,含量远远低于植物甾醇的含量,因此,未检出属于正常范围[14]。菜油甾醇、豆甾醇、谷甾醇3種植物甾醇在5种热带水果中均有检出,这说明,热带水果在植物甾醇方面值得做详细研究。同时,韩军花等[13]采用气相色谱仪检测分析木瓜样品中菜油甾醇含量为5.35 mg/100 g、豆甾醇含量为2.87 mg/100 g、谷甾醇含量为8.63 mg/ 100 g,同本研究采用气相色谱质谱法测定木瓜样品中的3种甾醇含量相近。
本研究的5种热带水果样品中,其中火龙果脂肪含量和植物甾醇含量较高。火龙果脂肪含量较高的主要贡献是火龙果籽,火龙果籽富含油脂,火龙果籽含油率在30%左右。而植物甾醇主要存在于油脂中,火龙果的植物甾醇可能主要存在于火龙果果肉中的火龙果籽中,目前对火龙果籽研究较多的在脂肪酸、氨基酸等方面。希望今后对火龙果籽中植物甾醇方面可以系统研究。同时本研究发现火龙果的豆甾醇含量较高。有研究表明[16],豆甾醇可以有效预防某些癌症,包括卵巢癌、前列腺癌、乳腺癌和结肠癌等。
消费者摄入植物甾醇的来源主要是谷物、坚果、蔬菜和水果[17]。虽然从含量上看水果中植物甾醇含量远低于植物油、坚果、谷物等。但从每日摄入量分析,消费者每日摄入量较多的是水果和蔬菜,通过本次对香蕉、火龙果、木瓜、菠萝、龙眼5个品种的植物甾醇含量不同,高于目前韩军花等[13]文献中报道的西瓜、桃等。建议消费者多食用不同种类的水果,不仅是为了补充水分、维生素、糖还可以补充植物甾醇等成分。热带水果品种丰富,后续研究应对更多品种的热带水果分析植物甾醇的种类和含量,在探究热带水果在植物甾醇方面贡献率的同时指导消费者更加合理科学地消费。
参考文献
- 左春山, 刘大勇, 徐启杰, 等. 植物甾醇的结构与功能的研究进展[J]. 河南科技, 2013(17): 211-213.
- Ferreetti G, Bacchetti T, Masciangelo S, et al. Effect of phytosterols on copper lipid peroxidation of human low-density lipoproteins[J]. Nutrition, 2010, 26(3): 296-304.
- Bernd G, Gunther S, De Guy B, et al. Plant sterols and car-diovascular disease: a systematic review and meta-analy- sis[J]. European Heart Journal, 2012, 33(4): 444-451.
- Agot L, Amundsen P, Leiv O, et al. Plant sterol ester–enriched spread lowers plasma total and LDL cholesterol in children with familial hypercholesterolemia[J]. The American Journal of Clinical Nutrition, 2002, 76(2): 338-344.
- 刘海霞, 仇农学, 王 峰, 等. 苹果籽油中植物甾醇含量的薄层色谱-分光光度法测定[J]. 中国油脂, 2008, 33(11): 76-79.
- 张媛媛, 吕双双, 李书国. 电化学分析法快速测定粮油食品中的总植物甾醇含量[J]. 现代食品科技, 2015, 31(5): 297-302.
- 牟德华, 赵玉华, 朱艳丽, 等. 高效液相色谱法测定植物甾醇的研究[J]. 食品工程, 2007(1): 62-64.
- 鲍忠定, 许荣年, 张颂红. 毛细管气相色谱法测定油中植物甾醇和胆固醇[J]. 分析化学, 2002, 30(12): 1 490-1 493.
- 杨春英, 刘学铭, 陈智毅, 等. 气相色谱-质谱联用法测定14种食用植物油中的植物甾醇[J]. 中国粮油学报, 2013, 28(2): 123-128.
- 陈树东, 林晓佳, 吴钟玲, 等. 固相萃取-气相色谱-质谱联用法测定植物油中的胆固醇和4种植物甾醇[J]. 中国油脂, 2016, 41(7): 94-98.
- 王多娇, 周 玮, 颜春荣, 等. 油脂中胆固醇及植物甾醇组成及含量分析[J]. 中国油脂, 2016, 41(2): 106-109.
- 魏晓珊, 邓乾春, 张 逸, 等. 亚麻籽油中植物甾醇含量的测定[J]. 中国油脂, 2015, 40(11): 107-111.
- 韩军花, 杨月欣, 冯妹元, 等. 中国常见植物食物中植物甾醇的含量和居民摄入量初估[J]. 卫生研究, 2007, 36(3): 301-305.
- 何文森. 植物甾烷醇衍生物的制备、功效及降胆固醇机理研究[D]. 无锡: 江南大学, 2013.
- 曹龙辉, 李晓珺, 赵文红, 等. 麦角甾醇的研究进展[J]. 中国酿造, 2014, 33(4): 9-12.
- Panda S, Jafri M, Kar A, et al. Thyroid inhibitory, antiperoxidative and hypoglycemic effects of stigmasterol isolated from Butea monosperma[J]. Fitoterapia, 2009, 80(2): 123-126.
- 盛 漪, 华 伟, 谷文英. 植物甾醇资源在食品原料中分布[J]. 粮食与油脂, 2002, 15(5): 40-41.

