方波脉冲电转化酿酒酵母条件优化
胡明瑜 白文钦 潘晓雪 吴红 雷开荣

摘 要 方波脉冲对细胞电击转化的效果优于指数波脉冲。目前,酵母电转化常使用的是指数波脉冲,方波脉冲转化酵母的研究较少。为了优化方波脉冲转化酿酒酵母的条件,在1M山梨醇的电击缓冲体系中,以酿酒酵母营养缺陷型菌株EGY48为试验对象,使用方波脉冲转化质粒,通过统计酵母转化子数量,摸索和優化脉冲电压、脉冲次数和脉冲宽度的参数。试验结果显示,脉冲电压为500 V,脉冲宽度为15 ms,脉冲次数为1~3次时,方波脉冲转化酵母的效率较高。
关键词 方波脉冲;电转化;酿酒酵母;脉冲电压;脉冲宽度;脉冲次数
中图分类号:Q78 文献标志码:A DOI:10.19415/j.cnki.1673-890x.2018.34.017
方波是一种特殊的脉冲波,在峰值和低值之间瞬时变换。在对细胞进行方波电击时,脉冲电压瞬间达到峰值,维持一定的脉冲宽度后,瞬间降为低值,完成一次方波脉冲。已有大量研究表明,方波脉冲对细胞电击转化的效果好于指数衰减脉冲波。Takahashi等[1]对人白血病细胞K562进行基因电击转化,在β-半乳糖苷酶基因瞬时表达试验中,指数衰减波的转化率仅为1%,方波脉冲的转化率约为5%,而且细胞存活率更高;在新霉素抗性基因的细胞转化试验中,方波脉冲转化率接近1%,指数衰减波转化率不到0.01%。Liu等[2]用荧光标记的寡聚核苷酸,比较方波脉冲和指数波脉冲转化不同造血细胞的效果,方波脉冲转染效率更高,而且转入的寡聚核苷酸的活性更强。Vierra等[3]对玻璃海鞘(Ciona intestinalis)的受精卵进行电击转化,两种脉冲方式转化的LacZ基因在胚中瞬时表达效率接近,而方波脉冲转化后,正常发育胚的比例更高。此外,利用方波脉冲对血吸虫、猪胎成纤维细胞等成功转入RNA、DNA等生物大分子[4-5]。这些研究表明方波脉冲电转化效率高、适应性广,具有较广泛的用途。
酿酒酵母(Saccharomyces cerevisiae)是真核单细胞微生物,基于酿酒酵母开发的分析技术已广泛应用于不同生物的生长发育、病原与寄主的致病/抗病机理、生物与环境/激素信号应答等多方面的研究。酿酒酵母易于培养,可作为生物反应器大规模生产难以化学合成的生物活性大分子。例如,Callari等[6]在酿酒酵母中分别表达细菌中的ssf基因簇和不同植物来源的酯酰辅酶A连接酶基因,用于合成具有抗癌、抗炎、抗痉挛等活性的当归酯化物前体当归酰辅酶A。优化的生物反应器以丙酸为底物,产生的当归酰辅酶A滴度达到6.4 mg·L-1;以当归酸为底物产生的当归酰辅酶A滴度达到40 mg·L-1。酿酒酵母的转化方法有化学法和电击法,其中电击法常用的是指数衰减脉冲波,而利用方波脉冲对酵母转化质粒等大分子的研究较少。冀照君等[7]在0.6 mol·L-1的蔗糖溶液中优化了方波脉冲电穿孔酵母细胞的条件,表明方波脉冲可以有效增强酵母细胞通透性,但没有开展酵母转化试验。本试验在1M山梨醇的电击缓冲体系中,以酿酒酵母EGY48营养缺陷型菌株为研究对象,优化方波脉冲电击参数,建立了稳定的方波脉冲电转化方法。
1 材料与方法
1.1 试验材料
1.1.1 酵母菌株和质粒
从OriGene公司购买DupLEX-ATM酵母双杂交试剂盒。使用的酵母为营养缺陷型菌株EGY48(MATα,trp1,his3,ura3,leu2::6,LexAop-LEU2),该菌株已导入pSH18-34报告质粒和pEG202-GID1质粒,这两个质粒分别包含URA3和HIS3基因。试验中,酵母转化用pJG4-5-D8N质粒包含TRP1基因。
1.1.2 主要生化试剂
山梨醇、尿嘧啶、组氨酸、色氨酸、YNB均购于上海生工生物有限公司。
1.1.3 主要仪器和耗材
ECM830型方形波电转仪和1 mm电转化杯为美国BTX公司产品。
1.2 试验方法
1.2.1 酵母感受态细胞制备
每组处理使用同一批酵母感受态细胞进行试验,参照OriGene公司试剂盒操作指南和BTX公司ECM 399型电转化仪实验指南制备感受态细胞。用接种环取EGY48菌株在YNB(-His-Ura)平板上划线培养;30 ℃下培养3 d后,挑取单菌落,接种于10 mL YNB(-His-Ura)液体培养基,30℃、200 rpm培养16~
20 h;取100 μL培养液稀释10倍,测量OD600吸光值为0.5~0.8;吸取1.25~2.00 mL菌液到100 mL YNB(-His-Ura)液体培养基,30℃、200 rpm培养5~6 h,OD600吸光值为0.6~0.8;5 000 rpm离心5 min,去掉上清,收集菌体,加入30 mL冰预冷的无菌水,重悬菌体;用无菌水重复清洗两次;离心收集菌体,倒掉上清,加入20 mL预冷的1M山梨醇重悬;离心后,去掉上清,加入1.2 mL预冷的1M山梨醇重悬;按每管70μL分装,备用。
1.2.2 酵母转化
用试剂盒提取pJG4-5-D8N质粒,测定浓度为
350 ng/μL;取1 μL加入酵母感受态细胞,轻轻混匀;冰上静置5 min,轻轻吸出加入预冷的电击转化杯;按照文中表述的不同参数电击转化;迅速向电击杯加入1 mL预冷的1M山梨醇;吸出菌液,转移到1.5 mL离心管,离心收集菌体;用残留的少量上清液重悬菌体后,菌液转移到YNB(-His-Ura-Trp)平板上推平板,30 ℃倒置培养3~5 d。
1.2.3 酵母转化率
每个电击转化事件中,pJG4-5-D8N质粒用量约为350 ng。酵母转化率换算为每微克质粒转化子数,应乘以2.86系数。
1.2.4 酵母转化子验证
制备少量酵母菌液作为模板,用引物对D8N-1(5′-AAGCGCGAGTACCAAGACGCC-3′)和D8N-2(5′-CACGGCGGGCGGGAGATCG-3′)进行扩增验证。扩增条件为:98 ℃预变性5 min,1个循环;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min。PCR产物在1%琼脂糖凝胶电泳约20 min,凝胶成像系统观察照相。
2 结果与分析
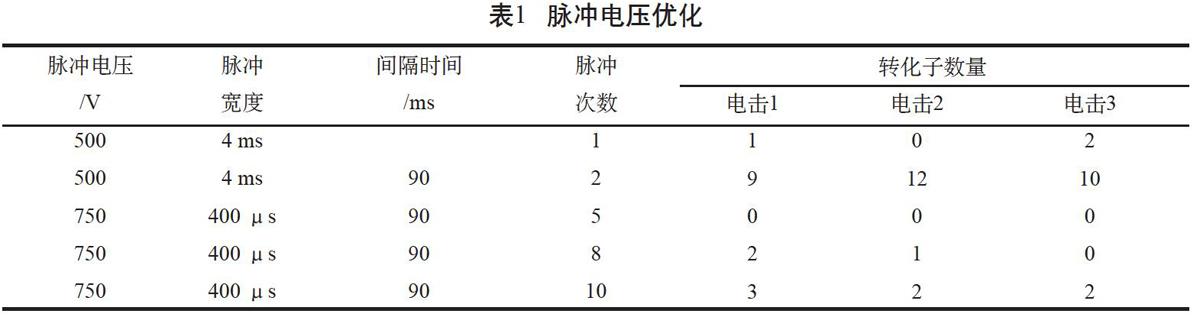
2.1 方波脉冲电压优化
ECM830型方形波电转化仪有低压和高压两种电击模式,低压模式电压范围是5~500 V,脉冲宽度为10 μs~10 s;高压模式电压范围是505~3 000 V,脉冲宽度10~500 μs。由于低压和高压模式的脉冲宽度范围限制,分别选择低压模式脉冲电压500 V和高压模式脉冲电压750 V,进行酵母电转化试验。电击转化结果表明,设置脉冲电压500 V,脉冲宽度4 ms,单次脉冲仅能获得1~2个转化子;脉冲2次,能获得约10个转化子。而在高压模式下,脉冲电压750 V,脉冲宽度400 μs,分别脉冲5、8和10次,仅能获得少量转化子(见表1)。这说明采用低压模式,设置方波脉冲电压500 V较适合酵母转化。
2.2 方波脉冲次数优化
在低压模式下,设置脉冲电压500 V,脉冲宽度4 ms,脉冲次数分别设为2、3、4、5、6次,对酵母进行电转化。结果表明,脉冲2次获得酵母转化子数量较少;脉冲5次、6次,酵母转化子数量在10~20;脉冲4次酵母转化子达到30个;脉冲3次获得的酵母转化子最多,达到77个(见表2)。这说明在脉冲电压500 V、脉冲宽度4 ms的条件下,脉冲3次的酵母转化效率较高。
2.3 脉冲宽度优化
在低压模式下,设置脉冲电压500 V,脉冲宽度分别为5 ms、10 ms、15 ms、20 ms、25 ms。通过单次脉冲转化酵母,比较不同脉冲宽度的电转化效果。结果表明(见表3),脉冲宽度为5 ms、10 ms时,获得酵母转化子数量分布在25~46;脉冲宽度为15 ms时,获得酵母转化子急剧增加到167个;脉冲宽度增加为20 ms、25 ms时,酵母转化子数量反而降低,而且分别有约20.1%和31.7%的菌落在培养3 d后才出现,生长速度减缓。这说明用脉冲电压500 V进行单次电击,脉冲宽度在15 ms时,酵母转化效率较高。
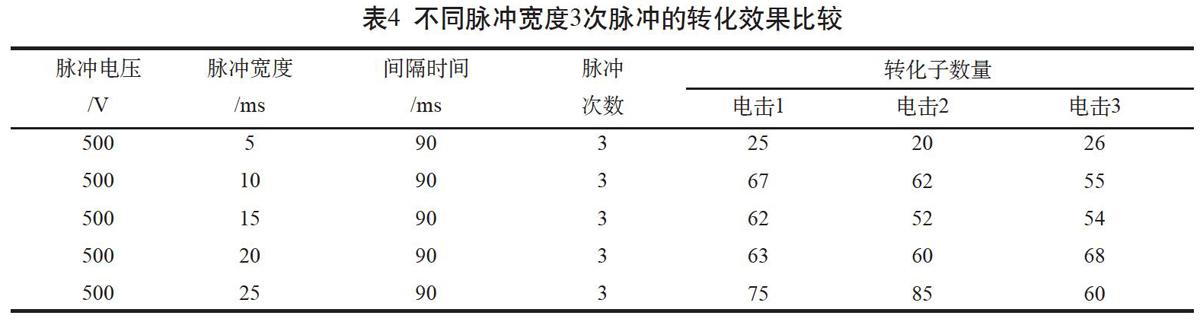
2.4 不同脉冲宽度3次脉冲的转化效果比较
在低压模式下,设置脉冲电压500 V,脉冲次数为3次,脉冲宽度分别为5 ms、10 ms、15 ms、20 ms、25 ms。酵母转化结果表明,脉冲宽度为10 ms、15 ms、20 ms时,酵母转化子数量均分布在50~70范围内;脉冲宽度为25 ms时,获得的酵母转化子分布在60~90范围内(表4)。然而,观察菌落生长情况,发现10 ms和15 ms脉冲处理酵母转化子生长速度较快,菌落大小均匀一致;而20 ms和25 ms处理中,分别约有49.5%和72.3%菌落在培养3 d后才出现,生长速度减缓。
2.5 酵母转化子鉴定
每个平板随机挑取酵母单菌落,在10 μL的ddH2O中吹吸混匀,取1 μL混悬菌液为模板,扩增D8基因片段。电泳结果显示,在所有检测的酵母单菌落中均扩增出约500 bp的目标片段,而未转化质粒的酵母阴性对照中不能扩增出目标带(见图1)。这表明在YNB(-His-Ura-Trp)平板中生长的酵母单菌落为阳性转化子。
3 小结
ECM830型方形波电转化仪在不同脉冲电压模式下,脉冲宽度范围不同,在高压模式下,脉冲宽度上限仅为500 μs。而采用指数衰减波电转化酵母时,常用脉冲宽度为4~4.5 ms。推测在高压模式下,脉冲宽度可能难以满足酵母电转化条件。试验中,设置脉冲电压750 V,脉冲宽度400 μs,脉冲10次,仅获得极少的酵母转化子,表明在高压模式下电转化酵母难度较大。因此,选择在脉冲电压500 V的低压模式下,优化方波脉冲电转化条件。
脉冲次数是电转化的一个重要参数,脉冲次数太少对细胞的穿孔效果不好,影响质粒进入细胞;脉冲次数过多,对细胞造成的损伤大,细胞难以存活,导致转化效率降低。试验中,脉冲电压500 V,脉冲宽度4 ms,脉冲3次时转化效率最高,达到77个,进一步增加脉冲次数,转化子数量反而逐渐减少。表明脉冲宽度在4 ms 及更长时,脉冲次数应该在3次以内。
在酵母电转化过程中,脉冲电压为500 V时,获得大量的酵母转化子,表明在细胞两侧施加的电压能够产生微孔,并且微孔大小可以使质粒进入细胞。脉冲宽度也是电转化的重要参数,对细胞膜微孔的形成、形态维持、孔径大小有重要影响。在脉冲电压为500 V时,分析了不同脉冲宽度对酵母转化的影响,试验显示,脉冲宽度为15 ms时,获得的酵母转化子最多,达到167个,远远高于其他脉冲宽度处理获得的酵母转化子数量。这说明脉冲电压为500 V,脉冲宽度为15 ms,单次脉冲在细胞膜表面产生的微孔数量和大小最有利于质粒转移。
进一步探讨不同脉冲宽度多次脉冲电转化酵母的效果,结果显示脉冲宽度为10 ms、15 ms、20 ms和25 ms时,酵母转化子数量分布在50~90,没有明显差异。然而,脉冲宽度为20 ms和25 ms时,可能对细胞伤害较大,分别约有49.5%和72.3%的菌落生长速度减缓。综合试验结果,方波脉冲电转化酵母,脉冲电压为500 V,脉冲宽度为15 ms,脉冲次数为1~3次时,质粒转化效率较高。
参考文献:
[1] M. Takahashi, T. Furukawa, H. Saitoh, et al. Gene transfer into human leukemia cell lines by electroporation: experience with exponentially decaying and square wave pulse[J]. Leukemia Research,1991,15(6):507-513.
[2] Y. Liu, R. Bergan. Improved intracellular delivery of oligonucleotides by square wave electroporation[J]. Antisense and Nucleic Acid Drug Development,2001,11(1):7-14.
[3] D.A. Vierra, S.Q. Irvine. Optimized conditions for transgenesis of the ascidian Ciona using square wave electroporation[J]. Development Genes and Evolution,2012,222(1):55-61.
[4] J.M. Correnti, E.J. Pearce. Transgene expression in Schistosoma mansoni: introduction of RNA into schistosomula by electroporation[J]. Molecular and Biochemical Parasitology,2004,137(1):75-79.
[5] J.W. Ross, J.J. Whyte, J. Zhao, et al. Optimization of square-wave electroporation for transfection of porcine fetal fibroblasts[J]. Transgenic Research,2010,19(4):611-620.
[6] R. Callari, D. Fischer, H. Heider, et al. Biosynthesis of angelyl-CoA in Saccharomyces cerevisiae[J]. Microbial Cell Factories,2018,17(1):72.
[7] 冀照君,孫波,迟玉杰,等.方波脉冲电穿孔法提高酵母菌细胞通透性的条件优化[J].食品科学,2010,31(15):50-54.

