刺五加不同部位的乙醇提取物成分分析
胡勇超 符群
摘 要:目的:对刺五加不同部位的乙醇提取物进行成分测定分析。方法:以刺五加根、茎、叶、果为研究对象,选择75%乙醇为提取溶剂,用超聲波辅助法提取刺五加的有效成分,采用紫外可见分光光度法对刺五加不同部位的有效成分含量进行测定,并对比分析。结果:刺五加不同部位乙醇提取物的有效成分存在显著差异,其多酚含量由高到低依次为:叶>果>根>茎;黄酮含量由高到低依次为:叶>根>果>茎;多糖含量由高到低依次为:果>茎>叶>根;总皂苷含量由高到低依次为:根>茎>果>叶。刺五加不同部位醇提物的抗氧化性由高到低依次为:叶>根>果>茎。结论:从实际应用角度分析,刺五加的根、茎、叶、果均具有一定的药用价值,可根据其含量高低和抗氧化性有针对性的进行开发利用。
关键词:刺五加;乙醇提取物;成分分析
中图分类号:S567.19;R285.5;TQ464 文献标识码:A 文章编号:1006-8023(2018)06- 0001-06
Analysis of the Components in Ethanol Extracts from Different Parts of Acanthopanax Senticosus
HU Yongchao1, FU Qun2*
(1. McCain Foods (Harbin) Co.Ltd, Harbin 150040; 2. College of Forestry, Northeast Forestry University, Harbin 150040)
Abstract: The components of ethanol extract from Acanthopanax senticosus were analyzed. Taking Acanthopanax root, stem, leaf and fruit as research objects, 75% ethanol was used as the extraction solvent, and the effective components of Acanthopanax senticosus were extracted by ultrasonic assisted method. The contents of Acanthopanax senticosus were determined by UV spectrophotometry and the data were compared and analyzed. The effective contents of ethanol extract from Acanthopanax senticosus were significantly different, and the content of polyphenols was from high to low: leaf> fruit> root> stem; flavonoid content from high to low: leaf> root> fruit; the contents of total saponins from high to low were as follows: root> stem> fruit> leaf. The antioxidant properties of the extracts from Acanthopanax senticosus were as follows: leaf> root> fruit> stem. From the application point of view, the roots, stems, leaves and fruits of Acanthopanax senticosus have certain medicinal value, and can be developed and utilized according to their contents and antioxidant.
Keywords: Acanthopanax senticosus; ethanol extract;component analysis
刺五加(Acanthopanax senticosus ( Rupr.et Maxim.) Harms),又名五加参,为五加科(Araliaceae)五加属多年生落叶灌木,主要分布在俄罗斯东部边缘地区、日本的北海道、朝鲜以及我国的东北、河北、山西等地[1-2]。刺五加的药用价值较高,属传统中药的一种,其具有味辛、微苦、性温和无毒等特点[3]。研究表明,刺五加具有多种活性成分,不仅具有活血、抗肿瘤、抗癌、抗病毒、补肾、安神、有助于睡眠和益气健脾的功效[4-6],而且还可以治疗心血管疾病、糖尿病和神经衰弱等症[7-8]。
近几年来,随着刺五加资源在食品、医药等行业的应用范围不断扩大,其需求量也日益增多,现全国年需求量已达到几十万吨以上。但对刺五加应用和研究相对较多的部位多集中于根和果实,对于刺五加其它部位的研究相对较少。例如,目前对于刺五加根中化学成分的研究,见于文献报道的主要有苷类化合物和黄酮类化合物[9-10],对刺五加果实中多糖提取的相关研究也较多[11-12],但对于刺五加不同部位多种有效成分的含量的研究却未见报道。若能将刺五加不同部位多种有效成分进行测定分析,并有针对性的开发利用,将在一定程度上缓解市场上刺五加资源需求量大,供应紧张的问题。
本研究通过对刺五加根、茎、叶、果中的多酚、黄酮、多糖和总皂苷的含量进行测定分析比较,以其对北方林区刺五加资源有针对性的综合开发利用、保护刺五加资源以及刺五加新产品的研制提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
试验原料:同植株的刺五加果实、叶片、根、茎(样本采集自黑龙江省萝北县)。
主要试剂:芦丁、乙腈、紫丁香苷、刺五加苷E、没食子酸、1,10-邻二氮菲、脂溶性维生素E、水溶性维生素C、铁氰化钾、对氨基苯磺酸、盐酸萘乙二胺、DPPH、邻苯三酚和乙醇等,试剂均为分析纯。
T6型号新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);FW100高速万能粉碎机(天津泰斯特仪器公司);电子天平YP200IN;DHG9240A电热恒温鼓风干燥箱(上海索域设备有限公司);1204型分析天平(上海卓精电子科技有限公司);旋转蒸发仪R-205B(上海申胜仪器公司);TGL-16G高速离心机(上海安亭科学仪器厂);Multi N/C 2100S总有机碳;FD-1型真空冷冻干燥机(北京博医康试验仪器有限公司);KQ-500DE台式数控超声波清洗器(昆仑市超声波仪器有限公司)。
1.2 试验方法
1.2.1 样品的处理
将刺五加果实、叶片、根和莖去除杂质,洗净,烘干至恒重,分别粉碎过60目,筛上物重新粉碎,直至全部过60目筛,分别收集全部筛下物备用。
1.2.2 对刺五加不同部位活性成分的提取
分别精密称取刺五加果、根、茎、叶粉碎物9 g,分别以300 mL的75%乙醇浸泡,过夜,置超声提取器中提取(T = 30 ℃,W = 100 KHz),超声时间20 min,在3000 r/min下离心10 min,分别取上清液和沉淀物,重复提取操作3次,合并3次的上清液,上清液进行真空旋转蒸发去除溶剂后进行冷冻干燥备用。
1.2.3 刺五加不同部位提取物中主要成分的含量测定
1.2.3.1 多酚含量的测定
(1)多酚标准曲线的绘制
精密称取对照品没食子酸4.0 mg,用甲醇溶解于100 mL容量瓶,制成浓度为0.04 mg/mL的标准品溶液,备用。分别取0.5、1.0、2.0、4.0、8.0 mL标准品溶液置于25 mL容量瓶中。采用福林酚法测定多酚并绘制标准曲线。以对照品的质量(m)为横坐标,吸光度(A)为纵坐标进行标准曲线的绘制,由标准曲线可知,没食子酸含量与吸光度之间的线性回归方程为y = 8.306 3 x - 0.070 31,其相关性系数R2为0.998 37,线性关系较好。
(2)样品多酚的测定方法
分别取刺五加根、茎、叶、果的醇提物冻干粉20 mg用甲醇定容至10 mL,即配制成2 mg/mL的刺五加提取物溶液。精密吸取刺五加根、茎、叶、果的提取物溶液0.5 mL,按照上述标准曲线的制备方法进行试验操作测定其含量,并进行3组平行试验。
1.2.3.2 黄酮含量的测定
(1)黄酮标准曲线的绘制
分别精密量取芦丁对照品溶液0.0、0.5、1.0、2.0、3.0、4.0、5.0 mL,将其移入25 mL容量瓶中,采用硝酸铝显色发法,分别以浓度(mg/ml)为横坐标,吸光度值(A)为纵坐标进行标准曲线的绘制,由所得标准曲线可知,浓度与吸光度之间的线性回归方程为y = 9.842 2 x - 0.001 46,其相关性系数R2为0.998 69,线性关系较好。
(2)样品黄酮的测定方法
分别取刺五加根、茎、叶、果的醇提物冻干粉20 mg加入10 mL容量瓶中,以80%乙醇定容,即配制成2 mg/mL的刺五加提取物溶液。各取1 mL刺五加根、茎、叶、果的提取物溶液进行黄酮含量的测定,按照黄酮标准曲线的制作方法进行试验,并进行3组平行试验。
1.2.3.3 多糖含量的测定
采用苯酚-硫酸法测定。
(1)多糖标准曲线的绘制
精确称取105 ℃干燥后的葡萄糖103.8 mg,加蒸馏水溶解,定容至100 mL。得质量浓度为1.038 mg/mL 的葡萄糖标准溶液。分别精确量取0、1.0、3.0、5.0、7.0、9.0和11.0 mL 的葡萄糖标准液,置于100 mL的容量瓶,加水定容至100 mL,摇匀。采用苯酚-硫酸法绘制标准曲线。以吸光度(A)为纵坐标,质量浓度C(mg/mL)为横坐标进行标准曲线的绘制,由所得标准曲线可知,葡萄糖浓度与吸光度之间的线性关系为y = 13.045 x - 0.023 54,其相关性系数R2为0.998 13,线性关系较好。
(2)样品多糖的测定方法
分别取刺五加根、茎、叶、果的醇提物冻干粉10 mg用蒸馏水定容至100 mL,即配制成0.1 mg/mL的刺五加提取物溶液。精密吸取刺五加根、茎、叶、果的提取物溶液2 mL,按照上述标准曲线的制备方法进行试验操作测定其含量,并进行3组平行试验。
1.2.3.4 总皂苷含量的测定
按照赵萍的方法加以改动进行试验[13],有研究发现,齐墩果酸型的皂苷在刺五加中含量较多,而且皂苷类这些主要是以齐墩果酸为配基的三萜皂苷的化合物形式存在。因此,试验采用齐墩果酸为对照品。
(1)标准曲线的绘制
精确称取齐墩果酸对照品10 mg,用乙醇溶解,制得1 mg/mL的标准溶液。分别移取0.1、0.2、0.3、0.4、0.5 mL,用乙醇定容至0.5 mL,然后再加入0.5 mL 的8%香草醛-乙醇溶液、0.5 mL 的77%硫酸溶液,摇匀,于60 ℃恒温水浴10 min,冷却,于538 nm处测定吸光度,同时,以乙醇溶液作为空白对照。以对照品浓度为横坐标,吸光度(A) 为纵坐标,进行标准曲线的绘制,由所得标准曲线可知,齐墩果酸浓度(μg/mL)与吸光度之间的线性回归方程为y = 40.56 x + 0.003,其相关性系数R2为0.999 0,线性关系较好。
(2)样品总皂苷的测定方法
用分析天平称经过醇提物冻干粉50 mg加入500 mL容量瓶中用80%乙醇定容至刻度,即配制成0.1 mg/mL的样液。量取样品溶液2 mL,按照上述标准曲线的制备方法进行试验操作测定其含量,并进行3组平行试验。
1.2.4 刺五加不同部位提取物对DPPH自由基清除能力的测定
首先用无水乙醇将DPPH配制成0.3 mmol/L的溶液。用分析天平称经过醇提物冻干粉50 mg加入500 mL容量瓶中用80%乙醇定容至刻度,即配制成0.1 mg/mL的样液。用移液管从提取物溶液中分别移取体积为0.05、0.1、0.2、0.4、0.8、1.6、3.2、6.4 mL于10 mL容量瓶内,用80%乙醇配制成浓度分别为 0.005、0.01、0.02、0.04、0.08、0.16、0.32、0.64 mg/mL的刺五加提取物溶液,待用。将配制好的的刺五加叶总提液按ABC加入反应溶液(取3组做平行试验),在整个操作过程需避光,加入反应液后摇匀,需密封避光反应30 min,釆用无水乙醇作为空白对照,利用紫外分光光度计在波长515 nm处测定吸光度值。以VC为参照。
DPPH清除率% =[A -(B-C)]/A×100%。
式中:A为3 mL无水乙醇+3 mLDPPH溶液;B为3 mL样品溶液+3 mLDPPH溶液;C为3 mL样品溶液+3 mL无水乙醇。
1.3 统计分析
应用Origin 7.5软件;Microsoft Excel 2003处理数据。
2 结果与分析
2.1 刺五加不同部位主要活性物质含量的测定结果分析
2.1.1 刺五加不同部位的多酚含量分析
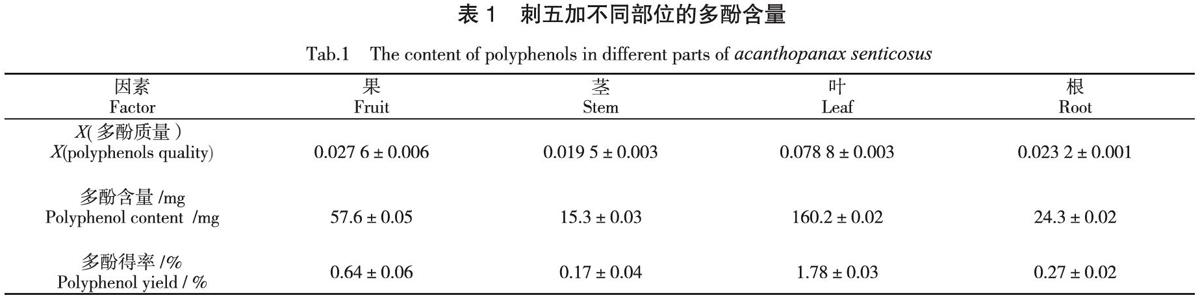
按照1.2.3.1的方法,分别测定刺五加根、茎、叶、果中的多酚含量,结果见表1。
植物多酚是一类广泛存在于植物皮、木、根、叶及果实中的多羟基酚类化合物,大量研究表明,植物多酚具有抗菌、抗氧化、抗癌和抗心血管疾病等疗效,目前在食品、药品和化妆品等行业普遍应用[14-15]。由表1可以看出,在相同的提取条件下,刺五加不同部位中多酚含量存在显著差异,其中刺五加叶中多酚含量最高,可达到160.2 mg,刺五加茎中多酚含量最低,仅为15.3 mg。刺五加果中多酚含量虽然仅次于刺五加叶,但是其含量仅为刺五加叶的三分之一。因此,今后在对刺五加中多酚物质进行提取应用时可有针对性的选用刺五加叶作为提取原料,这在一定程度上可以起到保护刺五加资源、提高提取率的作用。
2.1.2 刺五加不同部位的黄酮含量分析
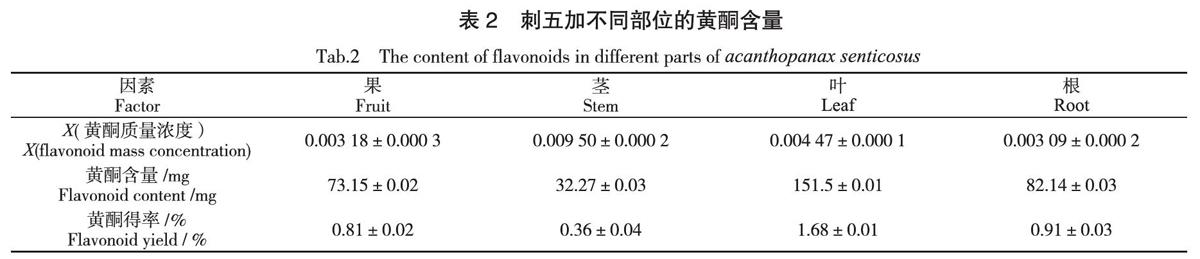
按照1.2.3.2的方法,分别测定刺五加根、茎、叶、果中的黄酮含量,结果见表2。
由表2可以看出,黄酮类物质在刺五加的根、茎、叶、果中均有存在,但在不同部位其含量和分布存在不同,这与Hu HB的研究结果相一致[16]。本试验结果表明,在相同的提取条件下,刺五加不同部位中黃酮含量存在显著差异。其含量由高到低依次为:叶>根>果>茎;黄酮得率由高到低依次为:叶>根>果>茎。这与刘江亭[17]、屈跃刚[18]等人的研究结果相一致,刺五加黄酮类活性物质主要存在于刺五加叶和根系统中,其中刺五加叶中黄酮含量最高。由于黄酮类活性物质具有抗氧化、抗自由基等药理作用以及预防和治疗人类的心血管疾病的功效,因此,在生产制造黄酮类药物时可有针对性的选取刺五加叶和根作为提取原料。
2.1.3 刺五加不同部位的多糖含量分析
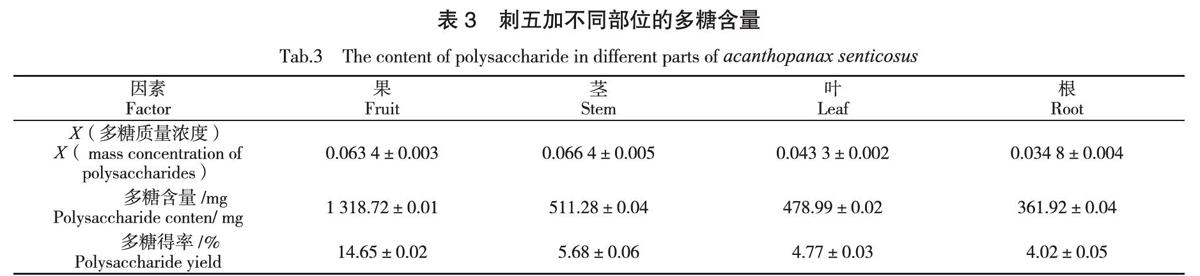
按照1.2.3.3的方法,分别测定刺五加根、茎、叶、果中的多糖含量,结果见表3。
由表3可以看出,刺五加中多糖是刺五加众多活性成分中含量较多、分布较广的物质之一,其广泛的存在于刺五加的不同部位中。试验结果表明,在相同的提取条件下,刺五加不同部位中多糖含量存在显著差异。其含量由高到低依次为:果>茎>叶>根;多糖得率由高到低依次为:果>茎>叶>根。这与Li Z F等人的研究结果一致[19],刺五加多糖类物质与黄酮类物质的分布类似,在整株植株中都有分布,且在刺五加果实中含量最高,可达到刺五加茎中多糖的2倍,刺五加根中多糖的4倍之多。因此,在制备刺五加多糖类药物制剂时,可优先挑选刺五加果实作为多糖提取原料。
2.1.4 刺五加不同部位的总皂苷含量分析
按照1.2.3.4的方法,分别测定刺五加根、茎、叶、果中的总皂苷含量,结果见表4。
由表4可以看出,虽然刺五加中总皂苷类物质是刺五加最重要的活性物质之一,具有抗氧化、抗衰老、提高记忆力、治疗高血压、预防心脑血管疾病的功效,但刺五加中总皂苷含量与多糖类物质和黄酮类物质相比,相对较少,在总皂苷含量最高的刺五加根中其含量仅为21.306 mg。这与郭冷秋等人的研究结果相一致[20]。试验结果表明,在相同的提取条件下,刺五加不同部位中总皂苷含量存在显著差异。其含量由高到低依次为:根>茎>果>叶;多糖得率由高到低依次为:根>茎>果>叶。这与王一涵等人的研究结果相一致[21],刺五加总皂苷含量在刺五加根和刺五加茎中相对较高,分别占干药材重量的0.6% ~ 0.9%和0.6% ~ 1.5%。因此,在刺五加总皂苷提取以及制备相关药物时,可优先选择刺五加根和茎作为原料,这在一定程度上可提高刺五加总皂苷的产出率。
2.1.5 刺五加不同部位的提取物抗氧化活性研究
按照1.2.4的方法,分别测定刺五加根、茎、叶、果乙醇提取物的DPPH清除率,结果如图1 所示。
由图1可以看出,刺五加不同部位的乙醇提取物对DPPH自由基都有一定的清除能力,而且清除能力均先随着样液浓度的增加而逐渐增强,达到一定浓度后,随着样液浓度的增加而趋于平缓。但不同部位提取物之间的清除能力存在显著差异。这表明刺五加不同部位的醇提物都具有一定的抗氧化性,但抗氧化能力大小存在差异。根据试验结果可知,刺五加不同部位的醇提物抗氧化性由高到低依次为:叶>根>果>茎。这可能是因为刺五加叶和根的醇提物中黄酮含量相对较高,而黄酮类物质具有较高的抗氧化性[22],所以表现为对DPPH清除效果较好,这与前文中的研究结果相一致。
3 结论
本研究采用超声辅助乙醇提取法对刺五加不同部位的有效成分进行提取制备,采用紫外可见分光光度法对刺五加不同部位有效成分中的多酚、黄酮、多糖和总皂苷含量进行测定分析,并比较了刺五加不同部位的提取物抗氧化活性。试验结果表明,刺五加中多糖含量远远高于其它3种物质,而多酚和黄酮含量相近,总皂苷含量最低。刺五加不同部位乙醇提取物的有效成分间存在显著差异,具体表现为:刺五加不同部位中多酚含量由高到低依次为:叶>果>根>茎;黄酮含量由高到低依次为:叶>根>果>茎;多糖含量由高到低依次为:果>茎>叶>根;总皂苷含量由高到低依次为:根>茎>果>叶。刺五加不同部位醇提物的抗氧化性由高到低依次为:叶>根>果>茎。从实际应用角度分析,在刺五加类药品和保健食品制备过程中,可根据不同部位不同物质含量的高低及抗氧化性大小有针对性的选择利用,这对提高刺五加资源的利用率具有重要的意义。
【参 考 文 献】
[1]WANG Z B, GAO H Y, XU F M, et al. Three new compoundsfrom the leaves of Acanthopanax senticosus Harms[J]. Chinese Chemical Letters, 2010, 21(6): 702-705.
[2]范惠霞. 刺五加中主要活性成分的药动学研究[D]. 济南:济南大学, 2014.
FAN H X. Pharmacokinetic study of the major active components of Acanthopanax senticoccus in rats[D]. Jinan: University of Jinan, 2014.
[3]白雪, 胡文忠, 姜爱丽, 等. 刺五加活性成分的研究进展[J]. 食品工业科技, 2016,37(4):378-381.
BAI X, HU W Z, JIANG A L, et al. Research advance on acanthopanax structure and the content of active ingredient[J]. Science and Technology of Food Industry, 2016, 37(4): 378-381.
[4]杨智慧.无梗五加叶化学成分及药理活性研究[D].长春:吉林农业大学,2012.
YANG Z H. Studies on the chemical composition and pharmacological effects of the leaves of Acanthopanax sessiliforus (Rupr.et Maxim) Seem[D]. Changchun: Jilin Agricultural University, 2012.
[5]杨明,丁立威,丁乡.刺五加产供销分析[J].中国现代中药,2013,15 (2):151-153.
YANG M, DING L W, DING X. Analysis of the supply and marketing of Acanthopanax senticosus[J]. Modern Chinese Medicine, 2013, 15(2): 151-153.
[6]罗周良.刺五加资源及质量研究[D].哈尔滨:黑龙江中医药大学,2009.
LUO Z L. Studies on resources and quality of Acanthopanax senticosus[D].Harbin:Heilongjiang University Of Chinese Medicine,2009.
[7]孫海涛,邵信儒.超声波辅助提取刺五加浆果色素工艺优化[J].食品科学,2011,32(22):109-113.
SUN H T, SHAO X R. Optimization of ultrasonic-assisted extraction of pigments from Acanthopanax senticosus Harms fresh fruit[J]. Food Science, 2011, 32(22): 109-113.
[8]PARK S Y, CHANG S Y, YOOK C S, et al. New 3, 4-seco-lupane-type triterpene glycosides from Acanthopanax seticosus foma inemis[J]. Journal of Natural Products, 2000, 63(12): 1630-1633.
[9]孙永杰. 刺五加茎叶中总黄酮的提取及其抗氧化功效研究[D].长春:吉林农业大学,2012.
SUN Y J. Study on the extraction of Acanthopanax sterns and leaves total flavonoids and its antioxidant function[D]. Changchun: Jilin Agricultural University, 2012.
[10]张英华,关雪.刺五加叶中黄酮类提取物的抗氧化性及抑菌作用研究[J].东北农业大学学报,2012,43(3):85-90.
ZHANG Y H, GUAN X. Antioxidation and antibacterial property of flavonoids compounds extracted from Acanthopanax leaves[J]. Journal of Northeast Agricultural University, 2012,43(3): 85-90.
[11]冯跃,高腾,顾欢欢,等. 单因素试验优选刺五加多糖的提取条件研究[J]. 山东畜牧兽医,2016,37(8):8-9.
FENG Y, GAO T, GU H H, et al. Optimization of extraction conditions of Acanthopanax senticosus polysaccharides by single factor test[J]. Shandong Animal Husbandry and Veterinary Medicine, 2016, 37(8): 8-9.
[12]张小飞,果秋婷. Box-Behnken响应面法优化微波提取刺五加多糖工艺[J]. 中国药师,2015,18(9):1502-1505.
ZHANG X F, GUO Q T. Optimization of microwave extraction technology for Acanthopanax senticosus polysaccharide by box-behnken response surface methodology[J]. China Pharmacist, 2015, 18(9): 1502-1505.
[13]赵萍,田晶,费旭,等.刺五加皂苷的提取工艺[J].大连工业大学学报,2013,32(5):316-319.
ZHAO P, TIAN J, FEI X, et al. Extraction of Acanthopanax senticosus saponins[J]. Journal of Dalian Polytechnic University, 2013, 32(5): 316-319.
[14]周孟清,石松. 微波輔助提取石榴皮中抗氧化成份研究[J]. 畜禽业,2011,(10):44-47.
ZHOU M Q, SHI S. The study about microwave-assisted extraction antioxidant ingredients from pomegranate peel[J]. Livestock and Poultry Industry, 2011, 10: 44-47.
[15]付婷婷,李慧,吴洪军,等.山杏和山丁子多酚的抗氧化活性研究[J].林业科技,2016,41(4):60-63.
FU T T, LI H, WU H J, et al. Antioxidant Activity of Polyphenols from Prunus armeniaca and Malus baccata[J]. Forestry Science & Technology,2016,41(4):60-63.
[16]HU H B, ZHU J H. Flavonoid constituents from the roots of Acanthopanax brachypus[J]. Chemical & Pharmaceutical Bulletin, 2011, 59(1):135-139.
[17]刘江亭,蒋海强.三萜类化合物药理作用研究进展[J].中国中医药咨询,2011,3(10):321-321.
LIU J T, JIANG H Q. Research progress on the pharmacological action of three terpenoids[J]. Chinese Medicine Consultation in China, 2011, 3(10):321-321.
[18]屈跃刚. 刺五加总黄酮提取工艺的研究[D].长春:长春工业大学,2012.
QU Y G. Research of the process for extraction of total flavonoids from Acanthopanax senticosus[D]. Changchun: Changchun University of Technology, 2012.
[19] LI Z F, XU N, FENG B M, et al. Two diketopiperazines from Acanthopanax senticosus Harms[J]. Journal of Asian Natural Products Research, 2010,12(1): 51-55.
[20]郭冷秋,张博,李廷利. 刺五加总苷的提取及纯化研究进展[J]. 中医药学报,2012,40(4):127-129.
GUO L Q, ZHANG B, LI T L. Advances in anti-diabetes mechanism of active components in traditional Chinese medicine[J]. Acta Chinese Medicine and Pharmacology, 2012, 40(4): 127-129.
[21] 王一涵. 刺五加中苷类成分的研究[D].延边:延边大学,2014.
WANG Y H. Study on glycoside components of Acanthopanax senticosus[D]. Yanbian: Yanbian University, 2014.
[22]樊星,闫静,刘舒,等. 刺五加根有效组分的抗氧化活性分析[J]. 中国试验方剂学杂志,2016,22(9):5-8.
FAN X, YAN J, LIU S, et al. Antioxidant activity of effective components from roots of Acanthopanacis senticosi radix et rhizoma seu caulis[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(9):5-8.

