酶解制备高溶解性蛋清蛋白粉工艺优化及其免疫调节活性研究
彭琦,马美湖,金永国
(华中农业大学食品科技学院,国家蛋品加工技术研发分中心,湖北武汉 430070)
随着人民生活水平的提升,人们对自身健康越来越关注,保健品市场潜力巨大。蛋白质作为人体必需营养素之一,是生命活动的主要承担者,而孕妇、老人、小孩以及体质较弱的成年人往往都缺乏蛋白质,所以各式各样的蛋白质类保健品应运而生,越来越受到消费者的喜爱并逐渐走进消费者家庭。
鸡蛋中的蛋白质是鸡胚发育的主要结构和功能物质,其中蛋清含有11%~13%的蛋白质,主要包括卵白蛋白、卵转铁蛋白、卵类粘蛋白、卵黏蛋白和溶菌酶等[1]。这些蛋白质必需氨基酸与总氨基酸比接近0.4,必需氨基酸与非必需氨基酸比接近0.7,是优质蛋白质源[2];而且具有多种生物活性,如卵转铁蛋白的免疫增强活性[3,4],溶菌酶的抑菌活性[5,6]等。有研究报道胰蛋白酶水解卵转铁蛋白的产物可以促进抗原呈递细胞小鼠骨髓源性树突状细胞的成熟[7],水解蛋清蛋白可以调节人类外周血细胞中加重的免疫反应[8]。
蛋清蛋白质因其良好的起泡性[9~11],凝胶性[12,13]被广泛用于食品生产加工中。但是鲜蛋壳蛋存在保质期短,运输、使用不方便的问题,为了提高蛋白质的保质期,方便储存和运输,将蛋清制成蛋清粉是目前人们对鸡蛋清的主要加工方式[14~16]。但是,现有工艺加工成的蛋清粉存在溶解性差的问题,严重制约蛋清粉在食品领域的应用。为此,研究提高蛋清粉的溶解性的工艺是蛋清粉加工急需解决的技术问题。现有的提高蛋白质溶解性的方法主要有物理法、化学法和酶法等[17],在这些方法中,生物酶法由于绿色无毒、安全可控等优势应用广泛。齐宝坤等人将超声技术与酶解技术相结合,作用于制备豆乳粉工艺上,比未经处理的豆乳粉溶解度提高了近10%[18];而马志良通过几种酶的筛选然后分段酶解得到了高溶解度的花生蛋白[19]。故本实验用酶法对蛋清蛋白进行水解来提高其溶解性,并对筛选得到的高溶解性蛋白粉进行模拟胃肠道消化,探究消化产物的免疫调节活性,为以后开发为蛋白质类保健产品提供理论参考。
1 材料与方法
1.1 原料与试剂
新鲜鸡蛋,采购于九峰山养鸡场。
RAW264.7细胞,购于中国科学院上海生命科学研究院细胞资源中心。
木瓜蛋白酶(最适pH为6~7,最适温度为60 ℃)、碱性蛋白酶(最适pH为8.5,最适温度为55 ℃)、中性蛋白酶(最适pH为7,最适温度为55 ℃)、风味蛋白酶(最适pH为7,最适温度为50 ℃),上海源叶生物有限公司;面包酵母,食品级,安琪酵母股份有限公司;磷酸二氢钠、磷酸氢二钠等均为分析纯,国药集团试剂有限公司;胃酶、胰酶、脂多糖(LPS),美国Sigma公司;CCK-8试剂盒,北京庄盟生物科技有限公司;NO试剂盒,南京建成生物科技有限公司;IL-1βElisa试剂盒,欣博盛生物科技有限公司。
1.2 仪器与设备
Sigma3-30K高速冷冻离心机,美国Sigma公司;K9840半自动凯氏定氮仪,济南华舜仪器有限公司;HH-4数显电子恒温水浴锅,巩义市予华仪器有限责任公司;HYP-308消化炉,上海纤检仪器有限公司;SP-1500喷雾干燥机,上海顺仪实验设备有限公司;HERAcell 150I二氧化碳培养箱,德国 Thermo Scientific公司;synergy HT多功能酶标仪,美国Biotek公司。
1.3 方法
1.3.1 工艺流程
鲜蛋→清洗→打蛋→搅拌→过滤→酵母脱糖→酶解→喷雾干燥→模拟胃肠道消化→免疫调节活性评价
1.3.2 单因素实验
1.3.2.1 酶的筛选
选择中性蛋白酶、风味蛋白酶、碱性蛋白酶和木瓜蛋白酶进行酶解。所有蛋白酶均在其最适的酶解温度和pH环境条件下酶解,中性蛋白酶采用pH为7的磷酸盐缓冲液溶解,酶解温度55 ℃;风味蛋白酶采用pH为7的磷酸盐缓冲液溶解,酶解温度50 ℃;碱性蛋白酶采用pH为8.5的Tris-HCl缓冲液溶解,酶解温度55 ℃;木瓜蛋白酶采用pH为6.5的的磷酸盐缓冲液溶解,酶解温度60 ℃。酶解时间为30 min,加酶量为500 U/g。分别制成粉,测定其溶解度和分散性,选出两种酶进行复配。
1.3.2.2 酶配比
在确定两种较佳复配酶的种类的基础上,以不同的比例(1:1、1:2、2:1、3:1、1:3、2:3、3:2)进行酶的复配,固定酶浓度为500 U/g,酶解时间为30 min,酶解温度为57 ℃,pH为7,分别制成粉,测定其溶解度和分散性,选出最优复配酶的比例。
1.3.2.3 酶解时间
在确定最优复配酶比例的情况下,将酶解温度、pH和加酶量固定为57 ℃、7和500 U/g,改变酶解时间为30、60、90、120和150 min进行酶解,分别测定其溶解度和分散性。
1.3.2.4 加酶量
在确定最优复配酶比例的情况下,将酶解温度、pH和酶解时间固定为57 ℃、7和30 min,改变加酶量为500、600、700、800、900、1000和1100 U/g进行酶解,分别测定其溶解度和分散性。
1.3.3 蛋白质溶解度的测定
采用氮分散性作为蛋白质溶解度指标,氮分散性=可溶性氮/总氮
总氮采用凯氏定氮的方法:对于可溶性氮,首先配置1%的蛋白粉溶液,用磁力搅拌器搅拌1 h,然后定容至100 mL,静置5 min,取一定体积的溶液于50 mL离心管,以1500 r/min速度离心10 min,取上清液用凯氏定氮法测得可溶性氮,实验做三次平行。
1.3.4 分散性的测定
参照文献[20]的方法并有所改动。取2 g样品加入50 mL蒸馏水,用磁力搅拌器以一定速度进行搅拌,待所有结块都散开时记录所用时间即为分散时间,实验做三次平行。
11日下午,于晓明一行来到位于青岛市西海岸新区的人大代表所在企业考察调研。在海尔集团中德产业园、互联工厂和澳柯玛智能工厂,于晓明向企业负责人和技术人员详细了解了产业升级和物联网发展情况。
1.3.5 模拟胃肠道消化
根据文献[21]的方法,将溶解度最好的蛋清蛋白粉以 4%的比例溶解于蒸馏水中,搅拌均匀,用盐酸调节pH到2,以1:80的酶底比加入胃酶,于37 ℃下反应2 h,立即用1 mol/L的NaOH调节pH至7.5,以1:50的酶底比加入胰酶,与37 ℃下反应4 h,反应结束后置于沸水浴中 10 min使酶灭活,然后在 4000 r/min的转速下离心10 min,收集上清液冻干待用。
1.3.6 酶解鸡蛋蛋白粉消化产物对 RAW264.7细胞增殖的影响
将对数生长期的RAW264.7巨噬细胞按2×104个/孔接种于96孔板中,贴壁4 h后,吸出培养液,加入终浓度为25、50、100 μg/mL的含有1.3.5节所得样品的培养液100 μL,阳性对照为终浓度为100 ng/mL的LPS,空白对照为不给药的培养基,每个浓度设5个复孔。将96孔板放置于恒湿恒温培养箱中培养24 h。取出培养板更换正常培养液,再向每孔加入 10 μL CCK-8试剂,置于培养箱中反应2 h,使用酶标仪在450 nm波长下测OD值,实验做3次平行。

1.3.7 酶解鸡蛋蛋白粉消化产物对 RAW264.7细胞NO释放和分泌IL-1β的影响
取对数生长期的细胞以1×106每孔接种于12孔板中,贴壁4 h,吸出培养液,加入终浓度为25、50、100 μg/mL的含有1.3.5节所得样品的培养液1 mL,阳性对照为终浓度为100 ng/mL的LPS,空白对照为不给药的培养基,每个浓度设3个复孔。将12孔板放置于恒湿恒温培养箱中培养24 h。收集上清,按照NO和L-1β试剂盒上的操作测定NO和IL-1β的含量。
1.3.8 酶解鸡蛋蛋白粉消化产物对 RAW264.7细胞胞内酶的影响
1.3.9 数据分析
所有实验进行 3次重复,单因素实验数据采用SPSS 17.0软件进行One-way ANOVA分析,平均值之间用Duncan’s multiple range test进行多重比较。正交实验结果采用极差分析法进行分析。
2 结果与分析
2.1 酶种类对蛋清蛋白粉溶解度和分散性的影响

图1 不同种类的酶对酶解产物溶解性和分散性的影响Fig.1 Effects of different kinds of enzymes on the solubility and dispersibility of enzymatic hydrolyzates
如图1所示,四种酶中,中性蛋白酶酶解之后的溶解度显著升高(p<0.05),为89.25±3.22%。经木瓜蛋白酶和碱性蛋白酶酶解 30 min之后的蛋清蛋白粉溶解度变化不显著(p>0.05),但风味蛋白酶酶解之后的溶解度显著降低(p<0.05),可能是因为风味蛋白酶属于外切酶,对于完整的蛋白大分子几乎没有作用[22]。在酶解初期风味蛋白酶作用于相对分子质量较小的蛋白质使一些疏水性基团暴露,导致蛋白粉溶解度降低。分散性为蛋白粉在一定量水中完全分散的时间,从图中可以看到,溶解度高的蛋白粉其分散时间相对较短,这是因为溶解度高的蛋白粉颗粒表面可以迅速与水分子结合、溶解、扩散,进而分散开来,这与孙临政[23]的实验结果相一致。
结合溶解度和分散性指标来看,溶解度最高的中性蛋白酶解产物分散性也较好,碱性蛋白酶和木瓜蛋白酶溶解度相近,但是木瓜蛋白酶酶解产物的分散性较好,所以综合溶解度和分散性,选择了中性蛋白酶和木瓜蛋白酶按比例进行复配进行后面的实验。钟振生等人[24]在研究中性蛋白酶和木瓜蛋白酶水解大豆分离蛋白的研究中,得出两者复合比单一酶效果要好,并且两种酶同时加入的酶解效果比分步酶解的果好。
2.2 酶配比对蛋清蛋白粉溶解度和分散性的影响

图2 不同酶配比对酶解产物溶解度和分散性的影响Fig.2 Effect of different ratio of enzyme on the solubility and dispersibility of enzymatic hydrolysates
本实验将筛选出来的中性蛋白酶与木瓜蛋白酶以1:1、1:2、2:1、1:3、3:1、2:3和3:2的配比加入进行实验,酶解温度为57 ℃,酶解时间30 min,加酶量为500 U/g,pH为7,结果如图2所示。
可以看到,以不同比例酶解之后,溶解度最高为84.97±4.92%,不如单酶酶解的高,这是因为复合酶共同酶解的最适条件还需进一步摸索。七种比例中,中性蛋白酶与木瓜蛋白酶的比例为1:1、1:2、1:3的时候溶解度没有显著性差异(p>0.05),相对较高,说明中性蛋白酶与木瓜蛋白酶共同酶解,当木瓜蛋白酶与中性蛋白酶占比相当或者更多时,酶解所得蛋清粉溶解度较高。而在这三种比例中,中性蛋白酶与木瓜蛋白酶的比例为 1:2的时候得到产物的分散性最佳,为51.24±1.38 s,所以选择中性蛋白酶与木瓜蛋白酶1:2的比例进行复合酶酶解条件优化实验。
2.3 酶解时间对蛋清蛋白粉溶解度和分散性的影响
图3是复合酶酶解时间对酶解产物溶解度和分散性的影响。可以看出酶解30 min和60 min时,酶解产物的溶解度没有显著性差异(p>0.05),在酶解 90 min时溶解度达到最高,为91.71±0.61%,在酶解时间超过90 min之后,溶解度就急剧下降。由此可知,用中性蛋白酶与木瓜蛋白酶以1:2的比例酶解,在90 min时酶解产物的溶解度最高,时间过短酶解程度不够,而酶解时间过长时,一方面因为过度酶解导致疏水性基团的暴露,另一方面,长时间加热会使蛋清蛋白质发生交联、聚集,导致酶解产物的溶解性降低[25]。
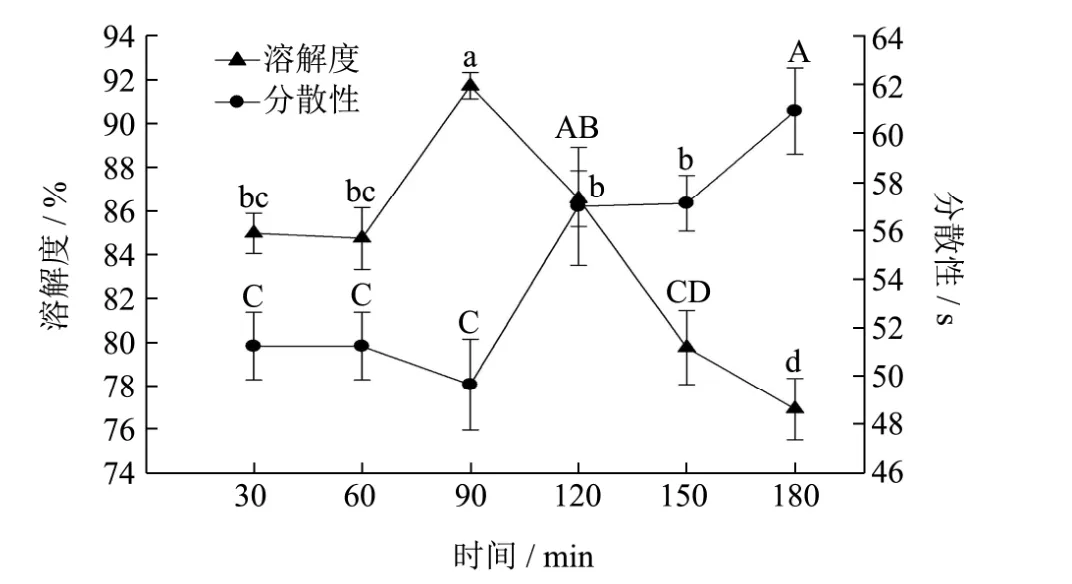
图3 酶解时间对酶解产物溶解度和分散性的影响Fig.3 Effect of hydrolysis time on the solubility and dispersibility of enzymatic hydrolysates
2.4 加酶量对蛋清蛋白粉溶解度和分散性的影响
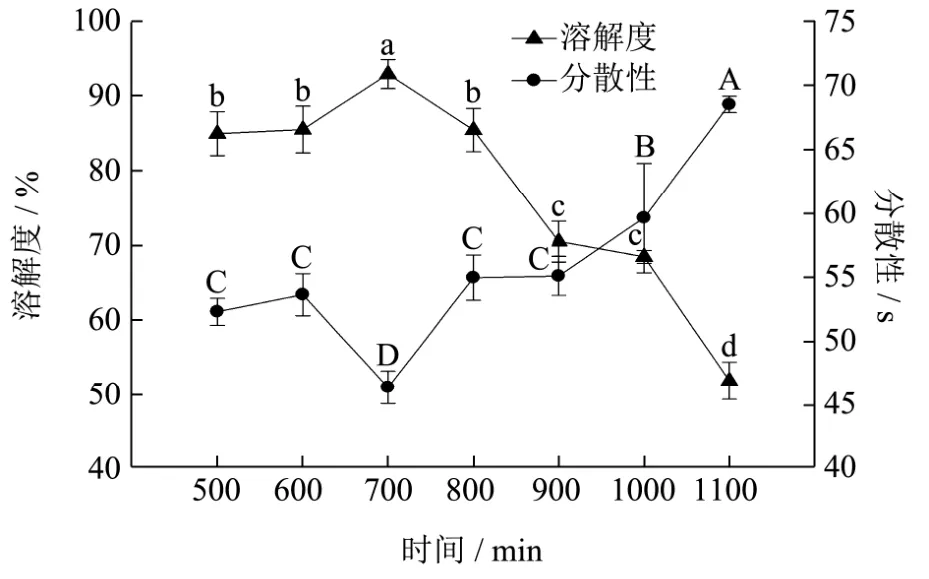
图4 不同加酶量对酶解产物溶解度和分散性的影响Fig.4 Effect of enzyme usage on the solubility and dispersibility of enzymatic hydrolysates
从图4中可以看出,随着加酶量的增加,酶解产物的溶解度先增加后降低。在加酶量从500 U/g增加到到700 U/g时,酶解产物溶解度逐渐增加,在700 U/g的时候溶解度达到最高,为 92.92±1.94%。继续增加加酶量,溶解度逐渐降低。由此可知,用中性蛋白酶与木瓜蛋白酶以1:2的比例酶解,加酶量在700 U/g时,溶解度最高。这是因为适度酶解会增加肽水解产物的氨基酸残基中氨基和羧基的电离,亲水性增加,从而增加疏水性肽和水解物中完整蛋白质的相互作用,使蛋白质表面疏水性降低从而增加溶解性。而酶添加量过多时,水解物中疏水性基团进一步增多[26],从而降低了蛋清蛋白粉的溶解度。
2.5 正交实验确定最佳酶解条件
2.5.1 正交实验
由于中性蛋白酶和木瓜蛋白酶的最适温度都为50~60 ℃,蛋清中主要蛋白质如卵白蛋白在超过60 ℃时会变性而发生聚集;且四种蛋白酶最适pH在6~7左右,所以在单因素实验过程中没有进行酶解温度和酶解pH的实验,而是在正交试验中分别设了4个梯度。在单因素实验的基础上,根据所用酶的最适温度和pH,以酶解温度、酶解pH、酶解时间和加酶量四个因素,进行四因素四水平的正交试验。正交因素水平表见表1。
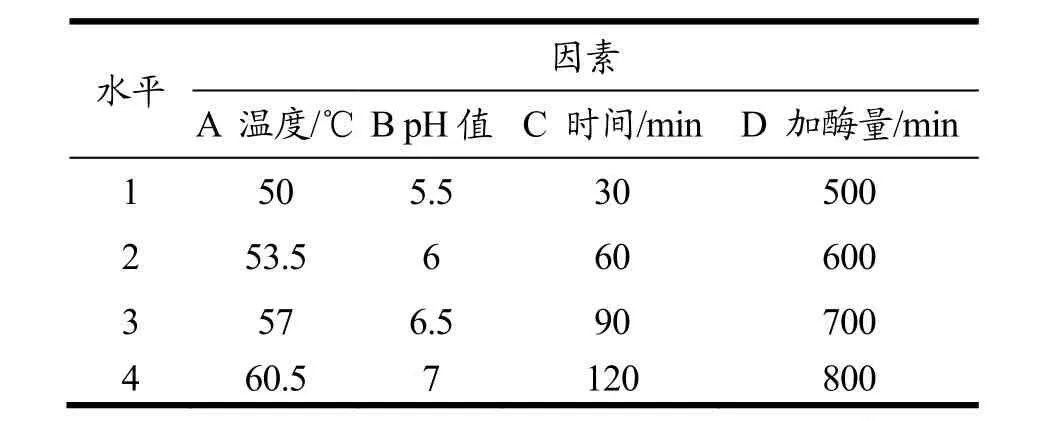
表1 正交设计实验因素与水平Table 1 Factors and levels of the orthogonal design
2.5.2 综合评分法进行正交试验结果分析
综合评分法是根据各个指标的重要程度,对得出的实验结果进行分析,给每一个试验评出一个分数作为这个试验的总指标。本实验中根据溶解度与分散性的重要性,规定综合分=0.55×溶解度隶属度+0.45×分散性隶属度。


表2 正交试验设计与结果Table 2 Results of orthogonal array experiment
表2是正交试验的极差分析表,通过极差分析,得出四个因素的重要程度排序为 B>C>A>D,即酶解pH>酶解温度>酶解时间>加酶量。对最优组进行验证实验得到,在优化出来的最优条件下,即酶解温度53.5 ℃、酶解pH 5.5、酶解时间90 min、加酶量为800 U/g时,溶解度为96.61%,分散性为39.62 s,都达到了较好的水平,说明此次正交优化实验是有效的。
2.6 酶解鸡蛋蛋白粉消化产物对RAW264.7细胞中酶的影响
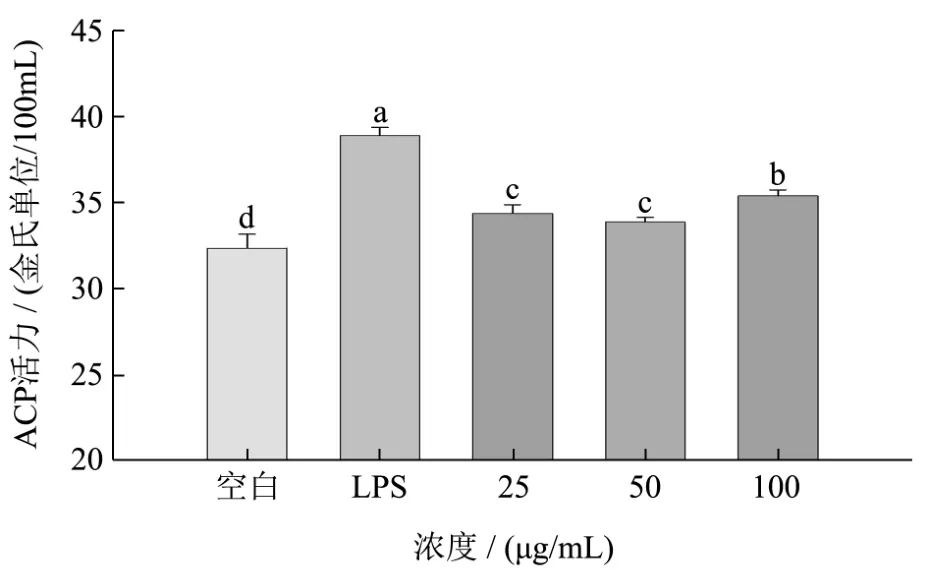
图5 酶解蛋清粉消化产物对RAW264.7细胞内ACP的影响Fig.5 Effect of SGDP on ACP in RAW264.7

图6 酶解蛋清粉消化产物对RAW264.7细胞内LZM的影响Fig.6 Effect of SGDP on the LZM in RAW264.7
BALB/c小鼠经Abelson鼠白血病病毒诱导会产生肿瘤,肿瘤产生之后,收集小鼠的腹水单核样巨噬细胞得到RAW264.7细胞株,RAW264.7巨噬细胞具有多种功能,包括吞噬作用、抗原呈递和多种细胞因子的分泌[27,28]。RAW264.7巨噬细胞受到刺激时被激活,致使细胞中酶的分泌及活性增加,细胞代谢提高,而奠定了巨噬细胞活化的基础,也是实现各种功能的基础。巨噬细胞内具有多种胞内和胞外酶,也可分泌一些可溶性因子,这些物质在一定程度上可反映该细胞的功能状态[29]。
酸性磷酸酶是巨噬细胞的标志酶,活性高低反应了巨噬细胞被激活的程度。溶菌酶是巨噬细胞的一种胞外酶,可在体外溶解细菌。由图5可知,经过样品处理后,RAW264.7产生的ACP显著增多(p<0.05),且随着浓度的升高,有上升的趋势。由图6可知,相比于空白对照,经过样品处理之后,RAW264.7产生的溶菌酶含量显著上升(p<0.05),但是各浓度之间的差异不显著(p>0.05)。
综上可知,在巨噬细胞经过样品处理之后,巨噬细胞活化的标志酶酸性磷酸酶含量显著上升,说明巨噬细胞被激活,溶菌酶的含量也显著上升,这些酶都与巨噬细胞的功能有关,本实验结果预示了样品有增强免疫调节功能的效果。
2.7 酶解鸡蛋蛋白粉消化产物对RAW264.7细胞增殖、分泌NO和IL-1β的影响

图7 酶解蛋清粉消化产物对RAW264.7增殖的影响Fig.7 Effect of SGDP on the RAW264.7 cell proliferation

图8 酶解蛋清粉消化产物对RAW264.7释放NO的影响Fig.8 Effect of SGDP on the NO releasing in RAW264.7
在机体受到病原体入侵时,巨噬细胞增殖速率会增加,且会通过释放出更多的免疫相关的细胞因子起到免疫调节作用。
由图7可知,与空白对照相比,阳性对照与浓度为50 mg/mL和100 mg/mL组显著增加巨噬细胞的增殖能力(p<0.05),说明样品在一定的浓度下可以有效的刺激巨噬细胞增殖。一氧化氮NO是一种具有强活性的自由基,在生物体内具有许多作用,如可以介导免疫调节作用,参与学习和记忆等等,是机体免疫过程中非常重要的一种中间物质[30]。由图8可知,浓度为100 mg/mL组跟对照组相比NO释放量显著增加(p<0.05),但是浓度为25 mg/mL和50 mg/mL时,样品对 RAW264.7细胞释放 NO没有显著影响(p>0.05)。IL-1β属于白细胞介素,能够激活T细胞及巨噬细胞,在免疫调节过程中发挥重要作用。由图9可知,50 mg/mL和100 mg/mL组和空白对照组相比,显著增加了RAW264.7细胞分泌IL-1β的量(p<0.05),且存在着剂量效应关系。
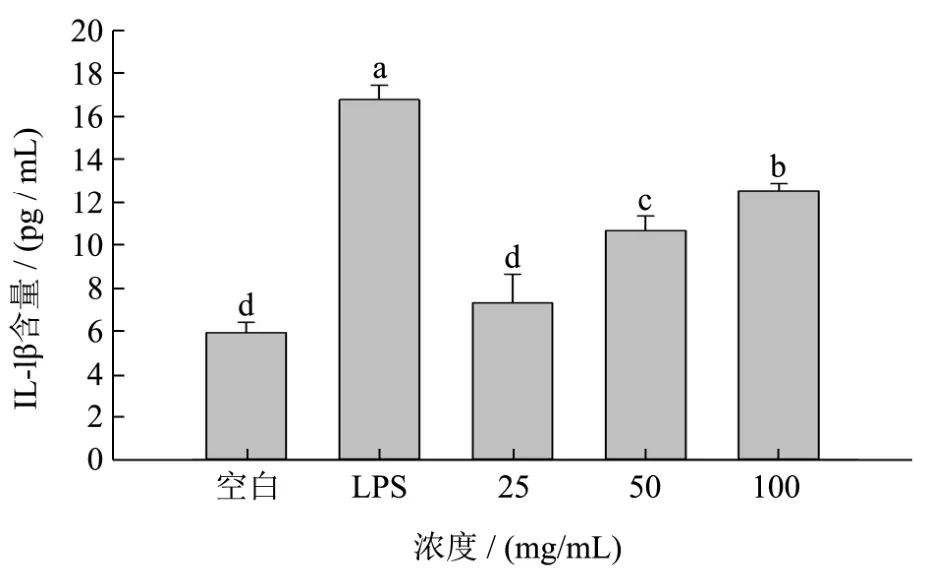
图9 酶解蛋清粉消化产物对RAW264.7分泌IL-1β的影响Fig.9 Effect of SGDP on the IL-1β secretion in RAW264.7
3 结论
鸡蛋蛋清是一种优质蛋白质源,但其喷雾干燥所得的蛋清蛋白粉溶解性能不佳。本研究以绿色安全高效的生物酶解的方法,通过单因素实验和正交试验,优化了酶解条件,即用中性蛋白酶和木瓜蛋白酶以1:2的比例进行酶解,酶解温度、酶解时间、酶解pH分别为53.5 ℃、90 min、5.5,加酶量为800 U/g。在这种酶解条件下得到的酶解蛋清蛋白粉溶解度达到96.61%,分散性达到39.62 s,具有不错的溶解性能。本研究对优化得出的高溶解性酶解蛋清粉进行模拟胃肠道消化,使消化产物作用于巨噬细胞 RAW264.7,消化产物作用之后,巨噬细胞内酸性磷酸酶和溶菌酶含量显著增多,说明巨噬细胞被激活,为提高机体免疫调节作用奠定了基础;同时,噬细胞增殖指数增加到1.28,且巨噬细胞释放NO和分泌IL-1β与空白对照相比也显著增加(p<0.05)。综上,本实验以复合酶解的方法,通过酶解条件优化得到了高溶解性的鸡蛋蛋白粉,且优化得到的鸡蛋蛋白粉具有免疫调节活性。本研究为将蛋清蛋白开发为保健食品提供了理论基础。
[1]马美湖.禽蛋蛋白质[M].北京:科学出版社,2016 MA Mei-hu. Egg proteins [M]. Beijing: Science Press, 2016
[2]江潇潇,叶宇飞,章豪,等.鸡蛋清、鸡蛋黄中17种氨基酸成分比较[J].浙江农业科学,2015,56(9):1498-1499 JIANG Xiao-xiao, YE Yu-fei, ZHANG Hao, et al.Comperation of 17 kinds of amino acids in egg white and egg yolk [J]. Journal of Zhejiang Agricultural Sciences, 2015,56(9): 1498-1499
[3]Xie Hang, Huff Gerry R, Huff William E, et al. Effects of ovotransferrin on chicken macrophages and heterophilgranulocytes [J]. Developmental & Comparative Immunology, 2002, 26(9): 805-815
[4]汤群,徐明生,林日新,等.卵转铁蛋白的免疫调节作用评价[J].食品研究与开发,2013,34(24):247-250 TANG Qun, XU Ming-sheng, LIN Ri-xin, et al. Evaluation on immune-enhancement effect of ovotransterrin [J]. Food Research and Development, 2013, 34(24): 247-250
[5]Zhang Z, Wang Y, Zheng F, et al. Ultrasensitive SERS assay of lysozyme using a novel and unique four-way helical junction molecule probe for signal amplification [J].Chemical Communications, 2015, 51(5): 907-910
[6]刘益丽,邓霄禹,江明锋.溶菌酶抑菌活性及检测方法研究进展[J].中国畜牧兽医,2013,40(8):189-194 LIU Yi-li, DENG Xiao-yu, JIANG Ming-feng. Research progress on function of non-structural proteins of classical swine fever virus [J]. China Animal Husbandry & Veterinary Medicine, 2013, 40(8): 189-194
[7]Liu L, Xu M, Tu Y, et al. Immunomodulatory effect of protease hydrolysates from ovotransferrin [J]. Food &Function, 2017, 8(4): 1452-1459
[8]Lozano-Ojalvo D, Molina E, López-Fandiño R. Regulation of exacerbated immune responses in human peripheral blood cells by hydrolysed egg white proteins [J]. PloS One, 2016,11(3): e0151813
[9]Yang X, Foegeding E A. Effects of sucrose on egg white protein and whey protein isolate foams: factors determining properties of wet and dry foams (cakes) [J]. Food Hydrocolloids, 2010, 24(2): 227-238
[10]Huang T, Tu Z, Wang H, et al. Promotion of foam properties of egg white protein by subcritical water pre-treatment and fish scales gelatin [J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2017, 512(1):171-177
[11]Wang G, Troendle M, Reitmeier C A, et al. Using modified soy protein to enhance foaming of egg white protein [J].Journal of the Science of Food and Agriculture, 2012, 92(10):2091-2097
[12]Van Den Berg M, Jara F L, Pilosof A M R. Performance of egg white and hydroxypropylmethylcellulose mixtures on gelation and foaming [J]. Food Hydrocolloids, 2015, 48: 282-291
[13]许亚彬,胥伟,黄迪.蛋清液与蛋清粉对鲢鱼鱼糜凝胶性的改良效果比较[J].中国家禽,2016,38(4):34-37 XU Ya-bin, XU Wei, HUANG Di. Comparison of improvement effect of egg white solution and egg white powder on gelling properties of silver carp surimi [J]. China Poultry, 2016, 38(4): 34-37
[14]Nishanthi M, Chandrapala J, Vasiljevic T. Properties of whey protein concentrate powders obtained by spray drying of sweet, salty and acid whey under varying storage conditions[J]. Journal of Food Engineering, 2017, 214: 137-146
[15]Chen C, Chi Y J, Xu W. Comparisons on the functional properties and antioxidant activity of spray-dried and freeze-dried egg white protein hydrolysate [J]. Food and Bioprocess Technology, 2012, 5(6): 2342-2352
[16]孙颜君,吕加平,刘振民.不同喷雾干燥温度对乳蛋白浓缩物加工性质的影响[J].食品科技,2014,39(1):42-47 SUN Yan-jun, LV Jia-ping, LIU Zhen-min. Effect of spray drying temperature on the functionality of milk protein concentrate [J]. Food Science and Technology, 2014, 39(1):42-47
[17]Rayo L M, E Carvalho L C, Sardá F A H, et al. Production of instant green banana flour (Musa cavendischii,var. Nanicão)by A pulsed-fluidized bed agglomeration [J]. LWT-Food Science and Technology, 2015, 63(1): 461-469
[18]齐宝坤,隋晓楠,王中江,等.超声联合酶解法提高豆乳粉溶解性的工艺研究[J].食品工业科技,2016,37(4):283-287 QI Bao-kun, SUI Xiao-nan, WANG Zhong-jiang, et al. Study on improvement of solubility of soybean milk powder by a combination of ultrasound and enzymatic hydrolysis treatment [J]. Science and Technology of Food Industry, 2016,37(4): 283-287
[19]马治良.花生蛋白的生物酶法制备及功能作用改善[D].泰安:山东农业大学,2014 MA Zhi-liang. Enzymatic preparation and funtion improvement of protein from hot-pressed peanut meal [J].Taian: Shandong Agricultural University, 2014
[20]闫忠心,靳义超.喷雾干燥温度对牦牛乳粉溶解特性的影响[J].食品科学,2016,37(7):23-26 YAN Zhong-xin, JIN Yi-chao. Effect of spray drying temperature on solubility of yak milk powder [J]. Food Science, 2016, 37(7): 23-26
[21]Wang B, Li B. Effect of molecular weight on the transepithelial transport and peptidase degradation of casein-derived peptides by using caco-2 cell model [J]. Food Chemistry, 2017, 218: 1-8
[22]万丽娜,熊星星,罗岩,等.风味蛋白酶修饰蛋清酶解液的研究[J].食品工业,2013,6:105-108 WAN Li-na, XIONG Xing-xing, LUO Yan, et al. Study on the flavourzyme embellish egg albumen hydrolysate [J]. The Food Industry, 2013, 6: 105-108
[23]孙临政,迟玉杰,王欢,等.喷雾干燥条件对蛋清粉冲调效果的影响[J].中国家禽,2014,36(2):29-33 SUN Lin-zheng, CHI Yu-jie, WANG Huan, et al. Effect of condition of spray drying on egg white powder [J]. China Poultry, 2014, 36(2): 29-33
[24]钟振声,陈钰,文锡莲.木瓜蛋白酶与中性蛋白酶水解大分离蛋白的研究[J].现代食品科技,2009,25(9): 1039-1042,1079 ZHONG Zhen-sheng, CHEN Yu, WEN Xi-lian. Hydrolysis of soybean protein isolate by papain and neutral protease [J].Modern Food Science and Technology, 2009, 25(9):1039-1042, 1079
[25]Raikos V, Campbell L, Euston S R. Rheology and texture of hen's egg protein heat-set gels as affected by ph and the addition of sugar and/or salt [J]. Food Hydrocolloids, 2007,21(2): 237-244
[26]Horax R, Vallecios M S, Hettiarachchy N, et al. Solubility,functional properties, ace-i inhibitory and dpph scavenging activities of alcalase hydrolysed soy protein hydrolysates [J].International Journal of Food Science & Technology, 2017,52(1): 196-204
[27]Lee S J, Lim K T. Phytoglycoprotein Inhibits Interleukin-1βand Interleukin-6 via p38 Mitogen-activated Protein Kinase in lipopolysaccharide-stimulated RAW 264.7 cells [J].Naunyn-Schmiedeberg’s Archives of Pharmacology, 2008,377(1): 45-54
[28]Zhang D, Wu M, Guo Y, et al. Purification of lactobacillus acidophilus surface-layer protein and its immunomodulatory effects on RAW264. 7 cells [J]. Journal of the Science of Food and Agriculture, 2017
[29]程安玮.甘草多糖的提取及对小鼠腹腔巨噬细胞的免疫调节[D].无锡:江南大学,2008 CHENG An-wei. Extraction of polysaccharide from glycyrrhiza uralensis fish and its immunomodulatory activity in mice peritoncal macrophage [D]. Wuxi: Jiangnan University, 2008
[30]Malla B, Chang B Y, Kim S B, et al. Potential of the cnidium monnieri fruits as an immune enhancer in escherichia coli infection model [J]. Journal of Pharmacy & Pharmacology,2016, 68(11): 1430-1439

