中性内肽酶相互作用蛋白质的功能
胡春荣 杜欣娜 李凤君 金艺华 张 虎 马利峰
(佳木斯大学附属第一医院,黑龙江 佳木斯 154007)
中性内肽酶(NEP)是脑内最重要的天然β淀粉样肽(Aβ)降解酶,是影响脑内Aβ分解代谢速率的限制因素〔1〕。NEP可以降解或灭活许多生物活性肽。在脑中,NEP表达于神经元的突触前膜和突触后膜,主要分布于黑质纹状体通路及海马等易于形成老年斑的区域,在Aβ的水解过程中发挥关键酶的作用。NEP被认为是调节脑内淀粉样前体蛋白(APP)分解代谢的关键酶〔2〕。尽管如此,仍旧缺乏NEP相互作用蛋白质的整体认识,本文通过数据库查询与NEP相互作用的所有蛋白质,通过基因本体(GO)和KEGG分析较为全面地认识NEP及其相互作用的蛋白质的功能。
1 资料与方法
1.1查找与NEP相互作用的蛋白质 利用蛋白之间相互作用数据库PINA2(http://cbg.garvan.unsw.edu.au/pina/)查找与NEP相互作用的蛋白质。
1.2在线软件SRING分析与NEP结合蛋白质之间相互作用的网络 将上述得到的蛋白列表,输入STRING中,进行蛋白质间相互作用网络分析。
1.3GO和KEGG分析 利用DAVID(https://david.ncifcrf.gov/)对上述蛋白列表进行GO和KEGG信号通路分析。
2 结 果
2.1与NEP结合的蛋白质的生物学过程(GO分析) 与NEP结合的蛋白集合参与翻译起始、多肽代谢途径、细胞内蛋白定位、胞内运输、RNA分解代谢等生物学过程(见图1)。

图1 与NEP相互作用的蛋白质参与的生物学过程
2.2与NEP结合的蛋白质的分子功能(GO分析) 与NEP结合的蛋白集合主要具有蛋白结合、核酸结合、酶结合、单链DNA结合、激酶结合等结合功能(见图2)。

图2 与NEP相互作用的蛋白质的分子功能
2.3与NEP结合的蛋白质的细胞定位(GO分析) 与NEP结合的蛋白主要定位于细胞外秘体、胞质部分、核糖体、胞内细胞器、髓鞘等部位(见图3)。
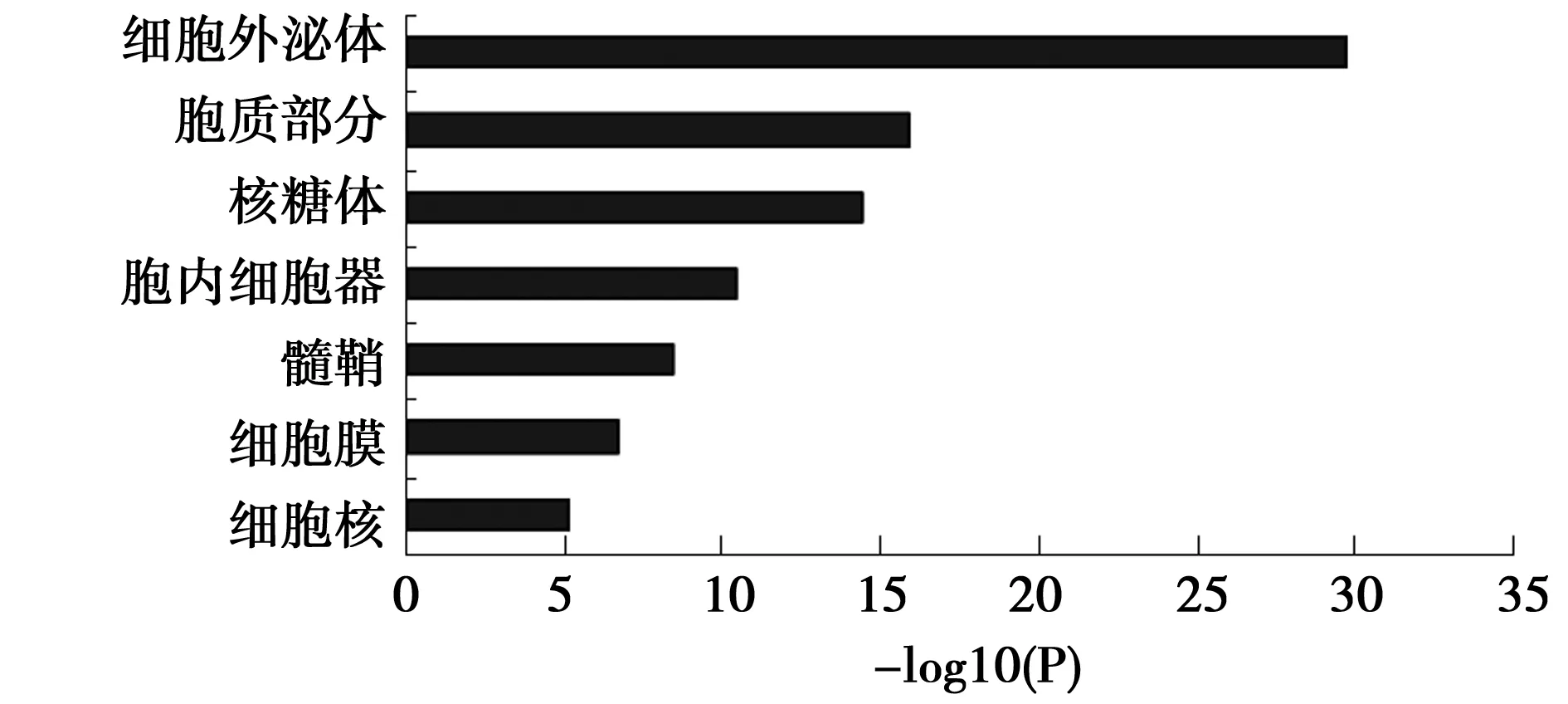
图3 与NEP相互作用的蛋白质的细胞定位
2.4KEGG 信号通路分析 与NEP结合的蛋白主要参与帕金森病(PD)、阿尔茨海默病(AD)、吞噬体、内质网蛋白加工、cGMP-PKG信号通路等(见图4)。

图4 与NEP相互作用的蛋白质参与的信号通路
3 讨 论
NEP可以在疏水性残基的氨基侧切割肽,并使几种肽类激素失活,包括胰高血糖素、脑啡肽、P物质、神经降压素、催产素和缓激肽,分子量约为100 kD,属于Ⅱ型跨膜糖蛋白。该蛋白是常见的急性淋巴细胞白血病抗原,是人类急性淋巴细胞白血病诊断中的重要细胞表面标志物。然而,该蛋白质不限于白血病细胞,并且在多种正常组织中发现。它是肾脏中特别丰富的糖蛋白,其存在于近端小管和肾小球上皮的刷子边缘上。在脑中,大脑部分锥体神经细胞、小脑和脊髓分子细胞层、部分神经胶质细胞,脑脊液都可检测到其存在〔3〕。本文结果显示,NEP结合蛋白可以定位在细胞的多个部位,且部分蛋白可以随外泌体分泌出细胞,这一结果很重要,提示NEP结合蛋白可能经外周循环到达比较远的位置起作用。
近年来,关于内源性Aβ降解酶类的研究一直在进行,也取得了一定进展。已经发现了几种内肽酶具有降解Aβ的活性。AD患者脑内在易发生Aβ沉积的区域,表现为NEP mRNA及其表达产物降低,神经变性斑块部位NEP活性较弱〔4〕,表明NEP在清除脑内Aβ过程中可能起着重要作用,提示NEP可以作为AD药物研发及临床治疗的新靶点。本结果也显示,NEP结合蛋白参与AD和PD的疾病过程。任凯等〔5〕人证明NEP可以降解Aβ,可以保护由Aβ沉积造成的神经细胞凋亡。与此类似的是,张静等〔6〕认为NEP对Aβ25~53诱导的神经细胞损伤保护作用可能与凋亡相关基因有关。神经干细胞(NSCs)经基因工程高表达NEP后,移植进入AD小鼠脑内,结果不仅增强了突触的可塑性,而且改善了AD的病理状态〔7〕。另外,Lin等〔8〕研究人员首次将外源NEP mRNA经纳米胶束引入大脑内,治疗脑部疾病,结果显示可以促进Aβ的清除,开创了基于NEP mRNA治疗的新纪元。本文结果显示,NEP结合蛋白主要表现为与蛋白、核酸及酶类结合,参与细胞内蛋白质定位、多肽和RNA降解、大分子代谢。这也帮助我们在整体上认识NEP主要通过降解作用,降低有害多肽水平,实现AD的预防和治疗。另外,本文发现NEP结合蛋白还可以促进血管紧张素的成熟,为心力衰竭和高血压等心血管疾病的预防和治疗提供新视角。
最后,关于NEP结合蛋白的细胞定位分析显示部分蛋白可以参与到细胞外泌体中,但是NEP本身并不是一种分泌蛋白〔8〕。那么NEP是否可以通过某种方式到细胞外发挥作用需要进一步研究和确认。鉴于脑内Aβ可以转运到外周循环中,达到靶器官进行降解,是否可以考虑通过某种手段增加外周循环或靶器官中的NEP水平,加速Aβ降解,从而间接降低脑内Aβ水平,从而预防和治疗AD,值得进一步探讨。
1Bacskai BJ,Kajdasz ST,McLellan ME,etal.Non-Fc-mediated mechanisms are involved in clearance of amyloid-beta in vivo by immunotherapy 〔J〕.J Neurosci,2002;22(18):7873-8.
2Caccamo A,Oddo S,Sugarman MC,etal.Age and region dependent alterations in Aβ degrading enzymes:implications for Aβ-induced disorders〔J〕.Neurobiol Aging,2005;26(5):645-54.
3蔡大勇.中性内肽酶在神经疾病中的病理生理作用〔J〕.中国老年保健医学杂志,2003;1(3):35-40.
4Magavi SS,Leavitt BR,Macklis JD.Induction of neurogenesis in the neocortex of adult mice〔J〕.Nature,2010;405(6789):951-5.
5任 凯,崔云燕,邵世滨,等.慢病毒介导的中性内肽酶对Aβ诱导的SK-N-SH细胞凋亡的影响〔J〕.中国病理生理杂志,2008;24(12):2470-4.
6张 静,王 坤,杨玲玲,等.腺病毒介导的NEP基因对Aβ25-35诱导的SK-N-SH细胞凋亡的抑制作用〔J〕.山东大学学报(医学版),2010;48(3):48-52.
7Blurton-Jones M,Spencer B,Michael S,etal.Neural stem cells genetically-modified to express neprilysin reduce pathology in Alzheimer transgenic models〔J〕.Stem Cell Res Ther,2014;5(1):46.
8Lin CY,Perche F,Ikegami M,etal.Messenger RNA-based therapeutics for brain diseases:an animal study for augmenting clearance of beta-amyloid by intracerebral administration of neprilysin mRNA loaded in polyplex nanomi celles〔J〕.J Control Release,2016;235:268-75.

