扩心方对扩张型心肌病大鼠肌浆网Ca2+-ATP酶及受磷蛋白的影响*
樊 华,杨爱玲,王佑华,彭珑萍,丛丽烨,苑素云,曹 敏,邓 兵,周 端
(上海中医药大学附属龙华医院心内科 上海 200032)
扩张型心肌病(Dilated cardiomyopathy,DCM)属原发性混合型心肌病的一种[1],国内流行病学调查发现DCM的5年病死率为15-50%。该病主要表现为左心室、右心室或双侧心室增大,伴有心肌肥厚,心肌收缩功能减退,伴或不伴有心力衰竭(Heart Failure,HF)。临床主要表现为低射血分数值、进行性心衰、恶性心律失常、血栓栓塞、心源性休克及猝死等,并可发生于疾病发展过程中的任何阶段[2],是导致心衰的主要病因之一[3]。治疗集中在抗心衰、抗心律失常及抗凝等对症治疗,缺乏针对性的治疗,而中医对该病的治疗在调整心功能、改善临床症状及提高生存率等方面有一定的优势[4]。诸多研究表明,心肌细胞内的Ca2+浓度或钙稳态对心肌舒缩功能起着重要的调节作用,心肌肌浆网Ca2+-ATP酶(SERCA2α)及受磷蛋白(PLB)等作为肌浆网钙调控相关蛋白,对此过程发挥着重要的作用,故对这一环节的深入研究,对阐明DCM发病机制、提高DCM的临床疗效具有重要意义。
扩心方是我院周端教授的经验方,该方由生黄芪、黄精、丹参、桂枝、瓜蒌皮、黄荆子等中药组成,在临床上用于治疗扩张型心肌病多年,长期作为院内协定方应用于临床扩心病治疗。前期[5]的临床研究发现,扩心方可明显改善心功能及临床症状,提高患者生活质量,收到良好效果,但其作用机制不明,有待深入研究价值。本研究通过观察扩心方对阿霉素诱导的扩张型心肌病模型大鼠心功能、心肌病理及心肌肌浆网钙调控相关基因、蛋白的影响,初步探讨扩心方治疗扩张型心肌病的作用机制,为扩心方研究与应用提供实验依据。报道如下。
1 材料与方法
1.1 实验动物
健康雄性Wistar大鼠60只,SPF级,体重(200±20)g,由上海中医药大学动物实验中心提供,动物许可证号:SCXK(京)2012-0001。饲养条件:室温22-24℃,相对湿度50%-60%,12 h/12 h明暗。
1.2 仪器与药物
1.2.1 仪器
GEViVid7型超声仪及12 L高频浅表探头(美国通用电气公司)、RM2016病理切片机(德国Leica公司)、7300荧光定量PCR仪(美国ABI公司)、Rt2100c酶标检测仪(中国Rayto公司)、neofuge 13R冷冻离心机(中国力康公司)、日本尼康光学显微镜。
1.2.2 药物
阿霉素(ADR)(深圳万乐药业有限公司生产,产品批号:1703E1;规格:10 mg/瓶),4℃保存;扩心方(由生黄芪、黄精、丹参、桂枝、瓜蒌皮、黄荆子等组成,以水煎煮、真空浓缩、喷雾干燥、干式制粒)临用前用蒸馏水溶解;卡托普利为中美上海施贵宝制药有限公司生产(国药准字H31022986);戊巴比妥钠,4%多聚甲醛溶液,苏木素-伊红染液,RNA提取液(塞维尔生物科技有限公司,货号G3013),SERCA2a、PLB、GAPDH引物(擎科创新生物科技有限公司,货号分别为NM_001110139.2、NM_001110139.2、NM_001110139.2),兔抗大鼠SERCA2a、PLB、GAPDH抗体(Abcam公司,货号分别为ab150435,ab85146,ab181602),HRP标记的羊抗兔IgG(CST公司,货号7074S)。
1.3 分组与造模
动物在屏障系统环境下适应性饲养一周。用随机数字表法将60只大鼠分为6组(n=10):即正常组,模型组,扩心方低、中、高剂量组及卡托普利组。根据常规DCM大鼠模型制备方法[6],将ADR用生理盐水配成1 mg·mL-1溶液,50只造模大鼠均腹腔注射ADR2.5 mg/(kg·week),正常组10只大鼠腹腔注射等量的生理盐水,共6周(阿霉素的累积剂量达到15 mg·kg-1)。造模前各组随机取3只做心脏超声,检测左室射血分数(left ventricular ejection fraction,LVEF)、左室舒张期末径(left ventricular internal diastolic diameter,LVIDD)、左室收缩期末径(left ventricular internal systolic diameter,LVIDS)、左室短轴缩短率(fraction shortening,FS),各组比较差异无统计学意义(P>0.05)。注射ADR 4周后,60只大鼠均做心超,造模组与正常组比较差异有统计学意义(P<0.05),即造模成功。
1.4 给药
从注射ADR第5周开始灌胃给药,根据体表面积换算法换算法得出:卡托普利组剂量为5 mg/kg/天,用蒸馏水配成10 mg·mL-1溶液;扩心方中剂量为3.6 g/kg/天,低剂量为中剂量的1/2,即1.8 g/kg/天,高剂量为中剂量的2倍,即7.2 g/kg/天,用蒸馏水配成1 g·mL-1的溶液;正常组和模型组给予与中剂量组等量的生理盐水,每天上午灌胃1次,连续给药4周。
1.5 指标检测及方法
1.5.1 超声心动图检测
分别在造模前、造模4周后及给药4周后,大鼠使用气体麻醉系统进行麻醉,取仰卧位,心前区备皮,采用多功能超声诊断仪,用频率为6-12 MHz的探头进行检测。取胸骨旁左室长轴切面、心脏四腔切面和M型超声心动图,分别测量LVIDD、LVIDS、EF、FS,取3个心动周期求平均值。
1.5.2 病理学检测
以戊巴比妥钠按40 mg·kg-1对大鼠进行麻醉,开胸取心脏后,分离左心室部分,将其分为心尖部与心底部,心尖部组织置于-80℃冰箱保存中用于PCR、Western blotting检测;心底部组织置于4%多聚甲醛溶液中固定24 h以上,进行脱水、浸蜡、石蜡包埋、切片,经HE染色观察心肌组织的形态学改变。
1.5.3 SERCA2α及PLB mRNA表达水平的RT-PCR半定量测定
SERCA2α、PLB、GAPDH(内参照)引物序列间表1。取-80°保存的大鼠心尖部组织剪成100 mg左右大小组织块,采用Trizol一步法提取mRNA,测定其浓度后,按二步法进行RT-PCR反应。
1.5.4 SERCA2α及PLB蛋白表达水平的Western-blot半定量测定
取100 mg左右组织块提取蛋白。以BCA蛋白定量试剂盒定量各组蛋白浓度;进行10%SDS-PAGE凝胶电泳分离目的蛋白;将目的蛋白转移至PVDF膜上;5%脱脂奶粉封闭;分别孵育兔抗大鼠SERCA2α多克隆抗体(1∶1 000)、PLB多克隆抗体(1∶1 000)、GAPDH(1∶2 000)抗体4℃过夜;最后用HRP标记的山羊抗兔IgG(1∶2 000)孵育2 h。使用ECL显色试剂盒曝光显影。

表1 目的基因和内参基因的引物序列及扩增条件
表2 各组心脏超声比较(s)
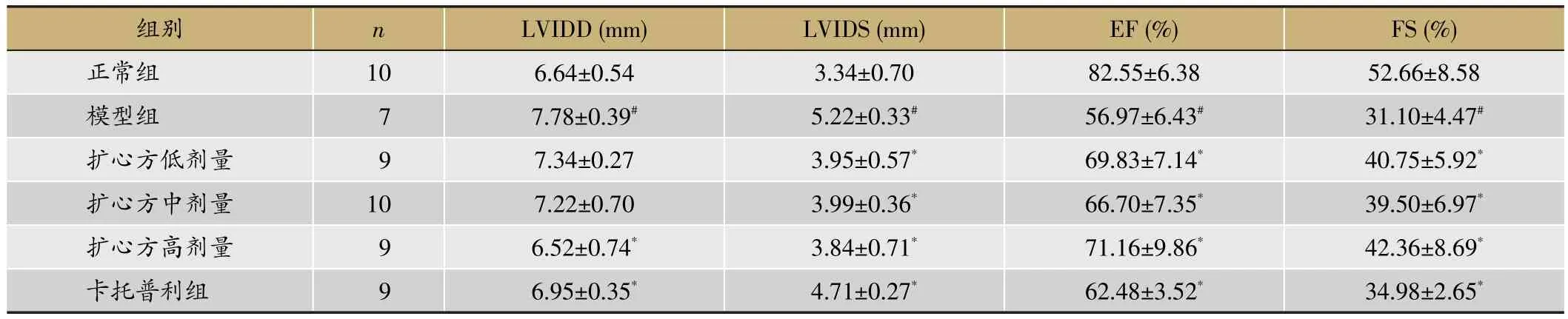
表2 各组心脏超声比较(s)
与正常组比较,#P<0.05;与模型组比较,*P<0.05
FS(%)52.66±8.58 31.10±4.47#40.75±5.92*39.50±6.97*42.36±8.69*34.98±2.65*组别正常组模型组扩心方低剂量扩心方中剂量扩心方高剂量卡托普利组n 10 7 9 1 0 9 9 LVIDD(mm)6.64±0.54 7.78±0.39#7.34±0.27 7.22±0.70 6.52±0.74*6.95±0.35*LVIDS(mm)3.34±0.70 5.22±0.33#3.95±0.57*3.99±0.36*3.84±0.71*4.71±0.27*EF(%)82.55±6.38 56.97±6.43#69.83±7.14*66.70±7.35*71.16±9.86*62.48±3.52*

图1 各组大鼠超声心动图检测结果
1.6 统计学处理
采用SPSS 19.0软件进行统计学处理,计量资料以均数±标准差(x±s)方式表示,两组均数比较用配对t检验分析,多个样本均数间两两比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
随着给药剂量的累积,注射ADR的大鼠逐渐出现精神不振,毛发杂乱,体重增加减慢等表现,第4周开始,部分大鼠出现腹水,腹泻;正常组大鼠反应灵敏,毛发光泽,体重增长迅速;第8周实验结束时,正常组和扩心方中剂量组全部存活,扩心方低、高剂量组及卡托普利组均死亡1只,模型组死亡3只。死亡大鼠行尸体解剖发现,存在肝大、胸水、腹水、腹腔内脏器粘连等现象。
2.2 各组大鼠超声心动图检测结果比较
各组大鼠超声心动图检测结果比较(表2,图1)与正常组相比,模型组的大鼠LVIDD及LVIDS值升高,EF及FS值降低(P<0.05),提示造模成功;与模型组大鼠相比,扩心方高、中、低及卡托普利组大鼠LVIDD、LVIDS值降低,EF、FS值升高,差异有统计学意义(P<0.05)。
2.3 各组大鼠心肌细胞病理学改变比较
各组大鼠心肌细胞病理学改变比较(图2)HE染色(图2A)可见,正常组心肌细胞形态规则,心肌纤维排列整齐,心肌间质无增生。模型组(图2B)出现心肌细胞肥大,间质增生,炎性细胞浸润,细胞排列紊乱,局部断裂,有出血和炎症等病理改变。经过治疗后,各组染色(图2C-F)可见心肌细胞肥大、间质增生、炎症细胞浸润、排列紊乱等表现均较模型组有所改善。上述病理表现提示扩心方治疗对于心肌重塑有改善作用,可有效缓解DCM心肌肥大、坏死、纤维化等改变。

图2 各组大鼠心肌细胞病理学改变比较
2.4 各组大鼠SERCA2α及PLB mRNA表达比较
各组大鼠SERCA2α及PLB mRNA表达比较(图3)与正常组相比,模型组SERCA2α的mRNA水平显著下降(P<0.05),经扩心方各剂量及卡托普利干预后,DCM大鼠SERCA2α的mRNA水平均显著升高(各治疗组vs模型组,均有P<0.05);模型组PLBd的mRNA水平较正常组显著上升(P<0.05);而经治疗后,PLB的mRNA水平显著降低(各治疗组vs模型组,均有P<0.05)。

图3 各组大鼠SERCA2α及PLB mRNA表达比较
2.5 各组大鼠SERCA2α和PLB蛋白表达比较

图4 各组大鼠SERCA2α和PLB蛋白表达比较
各组大鼠SERCA2α和PLB蛋白表达比较(图4)在分子量100 kD、74 kD处可见清晰的表达条带。与正常组相比,模型组的SERCA2α条带明显变淡变细,而PLB条带则增粗,经扩心方各剂量及卡托普利治疗后,条带分别有不同程度改变。进一步半定量分析显示,模型组中SERCA2α表达量较正常组降低(P<0.05),而扩心方各剂量及卡托普利组较模型组SERCA2α表达量则显著升高(各治疗组vs模型组,均有P<0.05);模型组中PLB表达量较正常组升高(P<0.05),而扩心方各剂量组较模型组PLB表达量则显著降低(各治疗组vs模型组,均有P<0.05)。
3 讨论
周端教授提出扩张型心肌病乃先天禀赋不足、后天失养、久病体虚等因素交互作用,导致气阴亏虚、或阳气虚衰,心脉痹阻,血运不畅,心体胀大,久则血不利而为水,血瘀痰水停留,亦使心体胀大,从而发为本病。治以益气养阴、温通阳气,佐以活血化痰利水,设扩心方加减治疗,基本方由生黄芪、黄精、丹参、桂枝、瓜蒌皮、黄荆子等组成。全方从整体观念出发,标本兼治,黄芪、黄精补益心气、纳气平喘、滋阴填精以为君;丹参、瓜蒌皮行气宽胸、活血化瘀以为臣;再佐以桂枝温阳利水,黄荆子行气涤痰平喘。扩心方临床研究表明,其对扩张型心肌病患者的症状及心功能改善均有较好的作用,优于单纯西药治疗,明显提高生活质量。并且部分患者再入院率明显下降,提示远期疗效较好。为进一步探讨其作用机制,本实验选用ADR腹腔注射致DCM模型,并予扩心方干预治疗。
心肌功能障碍是DCM发生发展的一个主要原因,其病理表现以心肌细胞收缩和(或)舒张功能异常为主,Ca2+转运在此过程中起着至关重要的作用。生物体内的多种钙调控蛋白均对Ca2+转运有调控作用,其中,心肌肌浆网Ca2+-ATP酶(SERCA2α)是参与钙离子调节的主要蛋白之一。本研究探讨扩张型心肌病中SERCA2α和PLB的变化及扩心方的干预作用。
SERCA2α的主要功能是将细胞液中的Ca2+摄取到肌浆网中,使细胞液中Ca2+浓度下降,肌浆网中Ca2+储备升高。若SERCA2α水平降低,肌浆网摄取的Ca2+减少,将直接引起胞浆中Ca2+浓度下降速度减慢,肌浆网Ca2+储备降低,进而引起两方面的病理变化:一是降低的Ca2+瞬变峰值会使Ca2+释放入胞液的速度和量减少,导致心肌收缩功能障碍;二是钙摄取的下降使得肌浆网不能快速从胞液中摄回Ca2+,故胞质中的Ca2+含量较高,心肌无法充分舒张,导致心肌舒张功能障碍。Jiang Y等[7]的实验研究证明,SERCA2α的表达对心肌的损伤及预后起着重要作用。我们的实验也发现,随着大鼠心功能的降低,SERCA2αmRNA、蛋白表达水平亦显著下降,与相关研究的发现类似[8,9]。
PLB是调节 SERCA2α活性的一个重要蛋白。Tsuji T等[10]研究显示,PLB的过度表达会导致SERCA2α活性显著降低。PLB对SERCA2α的抑制作用,会导致肌浆网摄取Ca2+减少,胞浆Ca2+浓度下降速度减慢,肌浆网Ca2+贮存降低,从而使DCM大鼠心脏功能进一步减弱。我们的实验结果也得出相同的结果,DCM大鼠的PLB mRNA及蛋白水平显著升高。因此,我们可以通过改善心肌肌浆网钙调控相关蛋白的表达或活性,如提高SERCA2a的表达,降低PLB的表达,来改善DCM的心功能及临床症状,减少心肌损伤。
我们在研究中发现,与模型组相比,扩心方干预治疗4周后,DCM大鼠的EF、FS值明显提高,心肌病理形态改善明显,提示扩心方可有效改善DCM大鼠的心功能及心肌损伤,同时,心肌SERCA2αmRNA及蛋白表达升高,PLB mRNA及蛋白表达降低,提示扩心方改善DCM的机制可能与提高心肌肌浆网钙调控相关蛋白SERCA2α的表达、降低PLB的表达有关。一方面,扩心方通过提高DCM大鼠心肌SERCA2α的表达,改善肌浆网对Ca2+的摄取与储存功能,从而改善心肌细胞的舒缩功能;另一方面,扩心方通过抑制DCM大鼠心肌PLB的表达,缓解PLB对SERCA2α的抑制作用,间接提高肌浆网钙泵的摄钙能力,从而改善心肌细胞舒缩功能。
通过以上研究,我们认为扩心方可通过纠正SERCA2α、PLB mRNA和蛋白表达的异常,改善心肌细胞内Ca2+分布和运转障碍,恢复Ca2+介导的兴奋-收缩偶联过程,最终起到改善心功能、减轻心肌损伤的作用。
1 Elliott P,Andersson B,Arbustini E,et al.Classification of the cardiomyopathies:apposition statementfrom statementfrom the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases.EUR Heart J,2008,29(2):270-276.
2 葛均波,徐永健.内科学(第八版).北京:人民卫生出版社,2013:272-276.
3 曹敏,王佑华.中西医结合治疗心力衰竭理论与实践(第一版).北京:科学出版社,2017:2.
4 樊华,居励之,王佑华.扩张型心肌病的中医药治疗进展.中西医结合心脑血管病杂志,2017,15(9):1051-1055.
5 王佑华,林赟霄,苑素云,等.扩心方治疗扩张型心肌病的临床疗效观察.上海中医药杂志,2017,51(6):60-62.
6 秦保锋,严世芸.腹腔注射阿霉素诱导实验扩张型心肌病大鼠模型的建立.中国实验诊断学,2012,16(12):2185-2187.
7 Jiang Y,Tian L L,Wang L H,et al.Cardioprotective Effects Of Serca2a Overexpression Against Ischemia-Reperfusion-Induced Injuries In Rats.Curr Gene Ther,2017,3(17):248-258.
8 Boardman N T,Aronsen J M,Louch W E,et al.Impaired left ventricular mechanical and energetic function in mice after cardiomyocyte-specific excision of Serca2.Am J Physiol Heart Circ Physiol,2014,306(7):1018-1024.
9 Wang L,Cui Y,Liu Q,et al.Puerarin Enhances Ca2+Reuptake and Ca2+Content of Sarcoplasmic Reticulum in Murine Embryonic Stem Cell-Derived Cardiomyocytes via Upregulation of SERCA2a.Cell Physiol Biochem,2017,44(3):1199-1212.
10 Tsuji T,Del Monte F,Yoshikawa Y,et al.Rescue of Ca2+overloadinduced left ventricular dysfunction by targeted ablation of phospholamban.Am J Physiol Heart Circ Physiol,2009,296(2):310-317.

