2008—2017年炎症性肠病住院患者临床变迁分析
李 婷 王巧民
安徽医科大学附属省立医院消化内科(230001)
炎症性肠病(inflammatory bowel disease,IBD)是一组病因不明、与多种因素相关的慢性复发性胃肠道炎症性疾病,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn’s disease,CD),两者具有不同的病理和临床特征[1]。中国自1956年报道首例IBD病例以来,其发病率呈显著增长趋势[2-4]。随着临床医师对该病认识的深入,其诊治水平明显提高。本研究对安徽医科大学附属省立医院近10年间新诊断住院IBD患者的住院资料进行回顾性分析,系统比较2013年前后住院病例临床特征和诊治方式的差异,以期明确该医疗中心IBD的临床变迁,为进一步加深临床医师对IBD的理解以及IBD的临床诊治提供参考。
对象与方法
一、研究对象
收集安徽医科大学附属省立医院2008年1月—2017年11月新诊断住院IBD患者的住院资料,诊断标准参考中华医学会消化病学分会制订的《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[5],包括临床拟诊和确诊IBD患者。不符合相关诊断标准和资料不完整者予以排除。
二、方法
阅读入组IBD患者的住院资料,采集性别、年龄、病程、症状和体征、肠外表现/并发症、内镜、活检病理和影像学表现、治疗药物、手术信息。以2013年1月为分界点将患者分为2组:2008年1月—2012年12月组(A组)和2013年1月—2017年11月组(B组),比较两组间UC和CD收治情况、临床特征和诊治方式的差异。疾病评估参照2012年版 IBD 诊治共识[5]。
三、统计学分析
结 果
一、历年IBD收治情况
共515例IBD患者纳入研究,其中UC 358例(69.5%),CD 157例(30.5%)。A组 UC 136例,CD 41例,B组UC 222例,CD 116例。由图1可见,2013年后IBD住院人数增长明显,2017年UC住院人数是2013年的3.72倍(67/18),CD住院人数是2013年的3倍(33/11)。
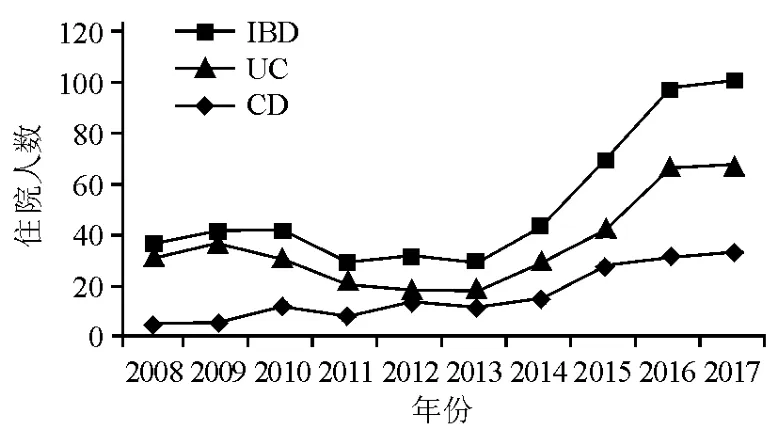
图1 2008年1月—2017年11月IBD、UC和CD住院人数增长情况
二、不同年代IBD患者临床特征比较
A组UC患者男女比例为1.23∶1(75/61),B组为1.41∶1(130/92),平均确诊年龄分别为(44.40±14.32)岁和(41.16±13.50)岁。两组临床类型均以慢性复发型最为常见[A组71.3%(97/136),B组73.9%(164/222)];两组间病变范围和疾病活动性严重程度(改良Truelove-Witts疾病严重程度分型)差异显著(P<0.05),A组病变范围主要为左半结肠[47.8%(65/136)],B组则主要为广泛结肠[54.5%(121/222)];A组疾病严重程度以轻中度居多[85.3%(116/136)],B组中重度患者比例较高[83.8%(186/222)]。
A组CD患者男女比例为1.41∶1(24/17),B组为1.76∶1(74/42),平均确诊年龄分别为(35.98±15.74)岁和(31.24±10.93)岁。依据蒙特利尔分型,两组间确诊年龄、病变部位、疾病行为均有明显差异,B组17~40岁确诊者的比例明显高于A组[75.0%(87/116)对 56.1%(23/41),P <0.05],40岁以后确诊者较A组明显减少[19.8(23/116)对36.6%(15/41),P<0.05];B组病变累及回结肠者的比例明显高于A组[65.5%(76/116)对46.3%(19/41),P <0.05],疾病行为为狭窄/穿透者的比例较A组有所增加[44.8%(52/116)对34.1%(14/41),P>0.05],且 B 组有50.9%(59/116)的患者出现并发症,主要为合并肛周病变[44.8%(52/116)对22.0%(9/41),P <0.05]。B组患者疾病活动性严重程度(Best CDAI评分)为中重度活动者的比例明显高于A组,差异有统计学意义[58.6%(68/116)对36.6%(15/41),P<0.05]。
三、不同年代检查手段和诊断方式比较
近5年UC患者完善结肠镜和活检病理检查者的比例明显增高[结肠镜:97.3%(216/222)对82.4%(112/136),P<0.05;活检病理:96.4%(214/222)对80.1%(109/136),P <0.05],活检部位增多(3.44±1.35对1.98±0.82),典型UC病理改变检出率,尤其是固有膜弥漫急慢性炎细胞浸润(70.3%对36.0%)、隐窝脓肿(42.8%对20.6%)、隐窝结构异常(9.5%对3.7%)检出率明显增高(P均<0.05)。近5年结合临床表现、结肠镜和活检病理改变综合诊断的比例亦明显增高[51.4%(114/222)对23.5%(32/136),P<0.05]。
近5年CD患者完善结肠镜和活检病理检查(包括小肠镜活检病理检查)者的比例明显增高[结肠镜:96.6%(112/116)对 85.4%(35/41),P<0.05;活检病理:97.4%(113/116)对75.6%(31/41),P<0.05],活检部位增多(3.94±1.78对2.57±1.10),且有80.2%(93/116)的患者行CT肠道显像(CTE),肠系造影则明显减少[4.3%(5/116)],但分别仅有10.3%(12/116)和7.8%(9/116)的患者行小肠镜和胶囊内镜检查。近5年CD典型病理改变检出率明显增高,以非干酪样肉芽肿(39.7%对 19.5%)、裂隙样溃疡(29.3%对12.2%)、局灶慢性炎细胞浸润(57.8%对29.3%)最为常见(P均<0.05)。近5年主要诊断方式为结合临床表现、结肠镜和活检病理改变或进一步结合影像学表现的综合诊断,比例明显增高[54.3%(63/116)对31.7%(13/41),P <0.05]。
四、不同年代治疗药物和治疗方式比较
近5年UC患者应用激素和免疫抑制剂的比例明显增高(P<0.05)。在治疗方式的选择上,氨基水杨酸制剂联合局部灌肠的应用仍较普遍,激素联合氨基水杨酸制剂的比例明显增高(P<0.05)(表1)。
近5年CD患者应用免疫抑制剂(P<0.05)、生物制剂(P<0.05)、肠内营养(P>0.05)的比例明显增高,之前则主要应用激素、免疫抑制剂和氨基水杨酸制剂。近5年治疗方式选择免疫抑制剂联合生物制剂的比例明显增高(P<0.05),免疫抑制剂联合肠内营养的比例亦较前增加,但差异未达统计学意义(P>0.05)(表2)。
10年间共28例(7.8%)UC患者和57例(36.3%)CD患者行手术治疗(表1、表2)。
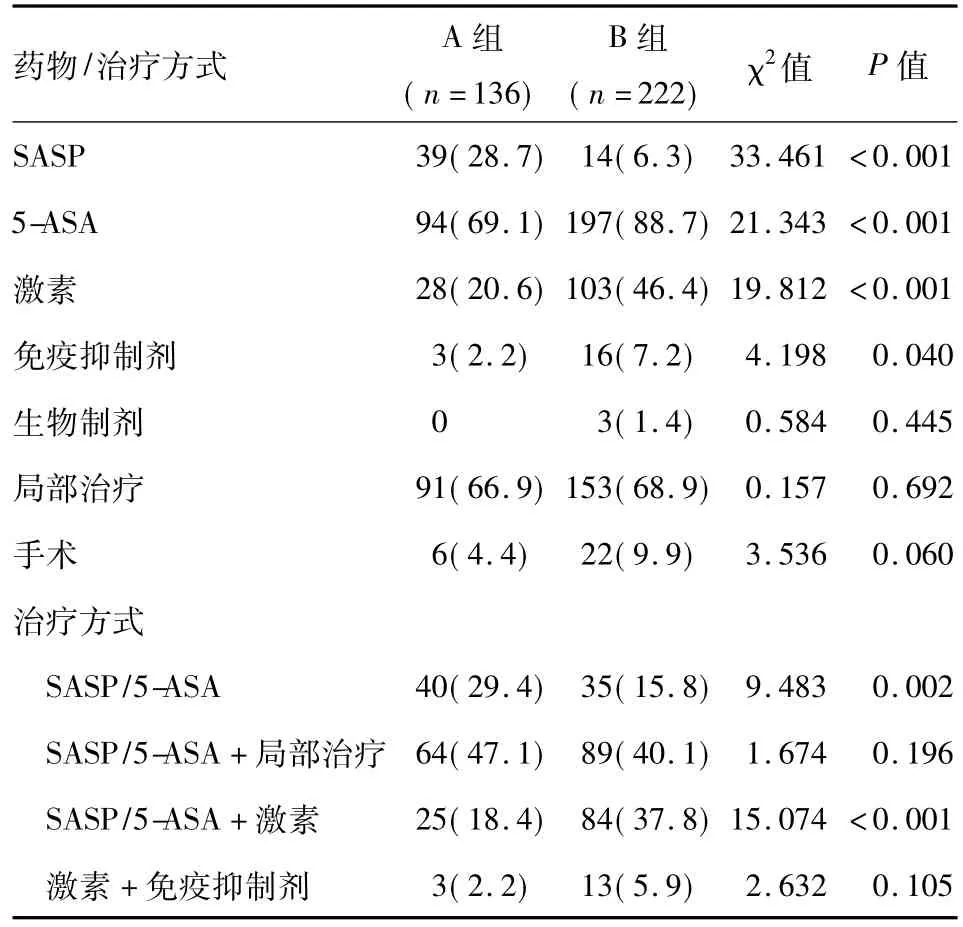
表1 2013年前后UC住院患者治疗药物和治疗方式比较n(%)
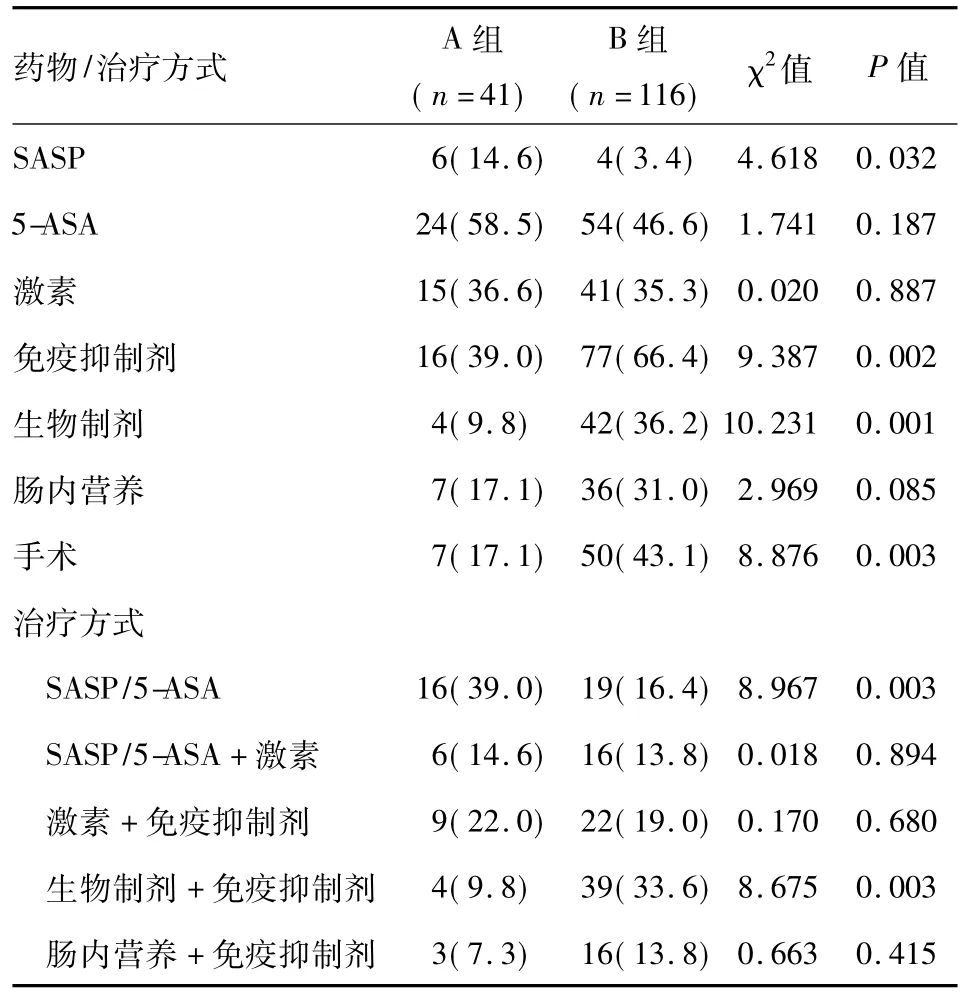
表2 2013年前后CD住院患者治疗药物和治疗方式比较n(%)
讨 论
全球范围内,IBD发病率最高的是北美洲、欧洲等西方发达国家,但近年亚洲发展中国家IBD发病率大幅增加[6]。随着IBD发病率的增加,其临床和诊治特征发生明显变化。从2008年至2017年,安徽医科大学附属省立医院IBD住院病例数增长近200%,尤其是2017年,UC病例数增至2013年的3.72倍,CD病例数增至2013年的3倍。近5年该院IBD病例数明显增加考虑有以下几方面的原因:①随着相关共识意见的发布[5],IBD的诊断和治疗越来越规范化,临床和病理医师的诊断意识和诊断水平不断提高,导致IBD检出率升高。②患者的就医意识逐渐增强,且经济收入的提高和社会医疗保险的广泛覆盖为就医提供了保障。③近年来我国工业化和城市化进程加快、社会经济快速发展带来的环境因素、生活方式、饮食习惯的改变可能与IBD检出率升高有关。
本研究分析显示UC患者男女性别差异不大,CD则更多见于男性,近5年男女比例更是达到1.76∶1。国内外多项研究表明UC男女发病无明显差异,CD患病率在国外文献报道中为女性略高于男性[6-7],我国资料则显示 CD发病男性略多于女性[2,5],可能与中国男性人口基数大于女性有关。依据我国IBD共识意见中的疾病评估标准[5],本组UC患者临床类型以慢性复发型最为常见,2013年前病变范围主要为左半结肠,与国内黑龙江大庆地区[2]、广东中山地区[3]和许多西方国家[8-9]的报道相一致,大多数患者疾病严重程度为轻中度。然而近5年数据显示,UC以累及广泛结肠最为常见,中重度患者的比例超过80%。本组CD患者最常见的病变部位为回结肠,而国外研究显示回肠、结肠和回结肠CD所占比例相近[10]。CD疾病行为主要是非狭窄非穿透,大部分为轻中度活动,但近5年狭窄/穿透和中重度活动患者的比例有所增加,且半数以上患者存在各种并发症,尤其是合并肛周病变。因此,我国IBD患者的临床特征不仅与西方国家存在差异,且随着时间的推移亦不断发生变化,病变复杂性和严重程度更高,增加了临床诊治难度,严重影响患者生活质量和预后。
由于缺乏明确的诊断金标准,IBD的诊断对临床医师而言具有相当大的挑战性。本研究分析显示,近5年IBD患者的结肠镜和活检病理检查完善率较之前明显增加,达到95%以上,典型病理改变检出率亦较之前明显增高。活检病理阳性率的增高除归因于病理医师对IBD组织病理学改变认识的加深,亦与内镜检查时多点、多段取活检有关。近5年的主要诊断方式为临床、内镜、活检病理表现相结合的综合诊断(CD患者尚结合影像学检查结果),符合我国共识推荐[5]。值得注意的是,本组数据显示近5年有约80%的CD患者行CTE。IBD患者在评估小肠情况时,患者往往难以耐受小肠镜检查,而胶囊内镜价格昂贵并有滞留风险。CTE除可显示小肠管腔内、外病变,还可显示窦道、瘘、脓肿等并发症,据报道在无回肠切除术史的CD患者中,其总体敏感性和特异性分别为86.7%和100%[11]。因此,CTE可作为CD诊断和随访的重要工具。
本研究分析显示,2013年之前UC患者疾病严重程度以轻中度为主,治疗药物主要为 SASP/5-ASA,其次为激素,仅有2.2%的患者应用免疫抑制剂。而近5年来,随着中重度UC患者的增多,激素和免疫抑制剂的应用明显增加。新近文献报道东欧国家已逐渐减少使用激素而更多以生物制剂和免疫抑制剂诱导和维持UC缓解[12]。目前CD的主要治疗药物为免疫抑制剂和生物制剂,本组CD患者2013年之后的免疫抑制剂使用率达66.4%,主要治疗方式为生物制剂或激素联合免疫抑制剂,这主要归因于目前降阶梯治疗观念的推广。同时本研究分析显示近5年生物制剂英夫利西单抗的应用明显增加(36.2%),主要用于中重度非狭窄非穿透病变以及具有预后不良高危因素的患者,应用前会全面筛查结核、乙型肝炎病毒、巨细胞病毒、EB病毒、艰难梭菌感染等活动性感染。生物制剂的广泛应用使IBD的治疗目标从临床缓解转变为内镜下黏膜愈合,有证据表明内镜下黏膜愈合与住院率、疾病复发率和手术率降低显著相关[13-14]。另一值得注意的现象是,近5年有31.0%的CD患者应用肠内营养,除用于营养支持外,有13.8%的患者选择肠内营养联合免疫抑制剂诱导疾病缓解。目前肠内营养被推荐作为儿童和青少年CD诱导缓解的一线治疗方案[15-16],依据2013年发布的我国 IBD营养支持治疗专家共识[16],肠内营养亦可作为药物治疗无效或禁忌的成人活动期CD患者的诱导缓解方案。选择手术治疗的IBD患者比例较低,手术原因往往为肠梗阻、肠穿孔、肛周病变等并发症,这一方面是由于很多内科医师的治疗理念尚未转变,更重要的是患者往往难以接受手术治疗。因此,临床医师可能需转变治疗理念,积极与外科医师沟通以确定最佳治疗方案。
综上所述,本研究观察到近10年来安徽医科大学附属省立医院IBD住院患者总体呈增长趋势,近5年增长尤为明显,诊治水平有显著提高。我国IBD患者在临床特征和诊治方式方面不仅与西方国家存在差异,而且随时间推移而发生改变。期待未来有更多大规模多中心临床研究为IBD的正确诊断和治疗提供有价值的信息。
1 Matsuoka K,Kobayashi T,Ueno F,et al.Evidence-based clinical practice guidelines for inflammatory bowel disease[J].J Gastroenterol,2018,53(3):305-353.
2 YangH,LiY,WuW,etal.Theincidenceof inflammatory bowel disease in Northern China:a prospective population-based study[J].PLoS One,2014,9(7):e101296.
3 Zeng Z,Zhu Z,Yang Y,et al.Incidence and clinical characteristics of inflammatory bowel disease in a developed region ofGuangdongProvince, China: a prospective population-based study[J]. J Gastroenterol Hepatol,2013,28(7):1148-1153.
4 Ng SC,Tang W,Ching JY,et al;Asia-Pacific Crohn’s and Colitis Epidemiologic Study(ACCESS)Study Group.Incidence and phenotype of inflammatory bowel disease based on results from the Asia-pacific Crohn’s and colitis epidemiology study[J].Gastroenterology,2013,145(1):158-165.e2.
5 中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].胃肠病学,2012,17(12):763-781.
6 Loftus EV Jr.Clinical epidemiology of inflammatory bowel disease: Incidence, prevalence, and environmental influences[J]. Gastroenterology, 2004, 126 (6):1504-1517.
7 Bernstein CN,Wajda A,Svenson LW,et al.The epidemiology of inflammatory bowel disease in Canada:a population-based study[J].Am J Gastroenterol,2006,101(7):1559-1568.
8 Molinié F,Gower-Rousseau C,Yzet T,et al.Opposite evolution in incidence of Crohn’s disease and ulcerative colitis in Northern France(1988-1999) [J].Gut,2004,53(6):843-848.
9 Portela F,Magro F,Lago P,et al.Ulcerative colitis in a Southern European country:a national perspective[J].Inflamm Bowel Dis,2010,16(5):822-829.
10 Cosnes J,Gower-Rousseau C,Seksik P,et al.Epidemiology and natural history of inflammatory bowel diseases[J].Gastroenterology,2011,140(6):1785-1794.
11 Mackalski BA,Bernstein CN.New diagnostic imaging tools for inflammatory bowel disease[J].Gut,2006,55(5):733-741.
12 Khalif IL,ShapinaMV. Inflammatoryboweldisease treatment in Eastern Europe:current status,challenges and needs[J].Curr Opin Gastroenterol,2017,33(4):230-233.
13 Frøslie KF,Jahnsen J,Moum BA,et al;IBSEN Group.Mucosal healing in inflammatory bowel disease:results from a Norwegian population-based cohort[J].Gastroenterology,2007,133(2):412-422.
14 Colombel JF,Rutgeerts P,Reinisch W,et al.Early mucosal healing with infliximab is associated with improved long-term clinical outcomes in ulcerative colitis[J].Gastroenterology,2011,141(4):1194-1201.
15 Ruemmele FM,Veres G,Kolho KL,et al;European Crohn’s and Colitis Organisation;European Society of Pediatric Gastroenterology,Hepatology and Nutrition.Consensus guidelines of ECCO/ESPGHAN on the medical management of pediatric Crohn’s disease[J].J Crohns Colitis,2014,8(10):1179-1207.
16 中华医学会消化病学分会炎症性肠病学组.炎症性肠病营养支持治疗专家共识(2013·深圳)[J].胃肠病学,2015,20(2):97-105.

