质量守恒定律在初中化学解题中的应用
吴天良
(江苏省苏州市吴江区黎里中学 215200)
学生对质量守恒定律的掌握程度决定他们的解题速度及效率,同时也可以促进学生对化学概念的理解,提升解题思维能力.虽说教材中给出的质量守恒定律的概念较为简单,即“参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和”,但在实际使用过程中存在很多的拓展定义,即本文提出的是三个核心守恒概念.实际解题中,不仅需要掌握概念的本身,更需要深刻理解质量守恒定律的各项引申定义,从而实现巧妙求解.
一、元素种类守恒的应用
质量守恒定律表明化学反应前后反应物及生成物的总质量守恒.相对应的是,反应物与生成物的元素种类也守恒,也就是说反应前后的元素种类不会发生增减,不会产生新元素.例如,电解水实验生成氢气和氧气,则表明水是由氢、氧两类元素组成的.故“元素种类守恒”是对质量守恒定律的宏观反映,侧面揭示了质量守恒定律的本质.受到知识点的限制,在初中化学教学中,对该引申定义的考察只会是简单的题型.学生们在求解的过程中围绕元素种类在化学反应前后不改变即可判断.
例1 现有未知成分的辰砂,加热辰砂与铁的混合物,经验证,得到的产物为FeS与Hg,试问辰砂的主要成分是什么?
解析:欲得知辰砂的成分,可以采用逆向思维,由生成物中元素种类判断反应物中元素种类.现已知生成物元素类型有Fe、S和Hg,而Fe在反应物中已经有提供对象了,故多出的两种元素一定是辰砂的主要成分.故可以得到结论,辰砂的主要成分是HgS.
二、原子种类及数目守恒的应用
原子是化学反应中的最小粒子,化学反应的实质就是原分子的分解与新分子的结合,究其本质,即是原子之间的重新组合.质量守恒定律阐明化学反应前后的质量守恒,而原子种类及数目守恒则是质量守恒最本质、最微观的属性.相较元素种类守恒,原子种类及数目守恒类的题目难度会有所提高.因为此时需要考虑到的不仅是元素种类,还包括其原子数目.
例2 根据质量守恒定律确定下述方程式3XY+Z2Y3=2Z+3M,则物质M的化学式是( ).
A.X2Y3B.XY3C.X3Y2D.XY2
解析欲求物质M的化学式,根据化学反应前后原子种类及数目守恒,反应前化学方程式中元素X的原子个数为3,Y元素的原子个数为6,Z原子的个数为2,反应后生成的Z原子个数为2,那么物质M必定涵盖了剩下的所有元素的原子,故可推断出元素M的化学式为XY2,故选项D正确.
三、化学反应前后物质的总质量守恒应用
化学反应前后质量守恒是对质量守恒定律的直接应用,包含化学反应前后各元素质量的守恒及反应前后各物质质量的总和守恒.对该应用的考查往往以计算题的形式出现,同时也会包含对化学方程及其他化学知识点的考察,难度自然也是质量守恒定律应用中最大的,值得重点去关注.针对此类质量守恒计算题型,解题步骤分别按照审题、写出化学方程式、寻找等量关系、计算求解这几个步骤去完成.
例3 铜粉与氢氧化铜的混合物在空气中加强热,直至反应完全,若反应前后的固体质量未曾发生变化,试求原混合物中铜的质量分数.
解析遇到此类综合性质量守恒求解题型,首先确定发生了哪些化学反应,初步写出化学方程式,寻找其中给出的等量关系.再结合质量守恒定律,确定所求数据.
由于反应前后固体的质量相等,结合反应方程式可知,反应前的铜及氢氧化铜的质量和与反应后氧化铜的总质量相等.同时,结合减少的质量可以推断出氧气的质量等于生成水的质量.故假设在最初的混合物中,铜的质量为x,氢氧化铜的质量为y,于是有:
128 32 98 18
xx/4y9y/49

四、质量守恒定律引申应用
由质量守恒定律可知,化学反应前后的元素种类、原子数目、总质量均不发生改变,那么就可以进一步引申推广到电解质溶液中.同样是化学反应,类比质量守恒定律的三核心守恒概念,可以推断出电荷守恒,即是电解质溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数.
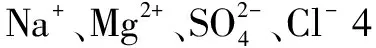
A.2nB.3nC.6nD.8n
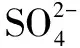
总之,本文例举出来的质量守恒定律范例较为笼统,主要是针对质量守恒定律的三个引申定理,并拓展到离子电荷守恒原理上,对质量守恒定律进行诠释说明.各个化学知识点之间并不是孤立存在的,在求解时也不会单一考察某一个知识点,更多是综合性考查.在实际解题应用时,综合性的教学更能够加深学生对不同知识点之间相互关系的理解,加强学生解题时融会贯通的能力,从而进一步提高学生学习效率.
参考文献:
[1]林秋香.浅谈守恒定律在初中化学解题中的运用[J].中小学教学研究,2016(12):32-33.
[2]李建丽.刍议质量守恒定律在初中化学中的应用[J].教师,2016(28):42-43.

