高效液相色谱法测食品中的阿斯巴甜新旧国标方法的比对
/ 上海市浦东食品药品检验所
阿斯巴甜(Aspartame)是由天冬氨酸和苯丙氨酸结合而成的缩二氨酸的甲基酯,作为新型甜味剂逐渐被人们所熟悉,其应用范围正逐渐扩大[1]。因为阿斯巴甜中含有苯丙胺酸,不适用于苯丙酮尿症患者,因此采取科学方法准确测定食品中阿斯巴甜的含量至关重要[2]。本文通过对比新旧国标方法的不同之处,分析新国标方法的先进性和科学性。
1 实验原理
阿斯巴甜易溶于水、甲醇和乙醇等极性溶剂而不溶于脂溶性溶剂,将不同分类的样品经不同前处理后用水提取阿斯巴甜,提取的溶液注入高效液相色谱仪,经反相色谱分离,根据保留时间定性和峰面积比较进行定量[3][4]。
2 前处理方法的改进
2.1 细化样品分类
对于样品的前处理,目的就是尽量提高目标组分的回收率,旧国标GB 22254-2008[5]中,试样的分类只有碳酸饮料类、乳饮料类、浓缩果汁类以及固体饮料,而新的国标方法GB 5009.263-2016(2017-06-23实施)[6]不仅包含了旧国标中的这四种类别,还增加了餐桌调味料、糖果类、乳制品、冷冻饮品、果冻、蔬菜及其制品、水果及其制品、食用菌和藻类、谷物及其制品、焙烤食品、膨化食品、脂肪类乳化制品、可可制品、巧克力及巧克力制品、坚果与籽类、水产及其制品和蛋制品。新国标方法将样品分类更加细化,提取方法更加科学,更加完善。其中,新国标将碳酸饮料、浓缩果汁、固体饮料、餐桌调味料和除胶基糖果以外的其他糖果分为一类,其前处理也较为简便。
2.2 对于样品的制备,增加匀浆步骤
新国标中对于乳制品、冷冻饮品、果冻、蔬菜及其制品、水果及其制品、食用菌和藻类、谷物及其制品、焙烤食品、膨化食品、脂肪类乳化制品、可可制品、巧克力及巧克力制品、坚果与籽类、水产及其制品和蛋制品这些类别的样品,均提出在提取前,用食品加工机按不同的试样与水的质量比进行匀浆,而后称取匀浆试样进行提取测定。新国标增加匀浆的制备步骤,使样品在提取过程中更加快速完全,有效提高目标组分的回收率。
2.3 对果冻中阿斯巴甜的提取单独增加了前处理方法
新国标中细化明确了果冻中阿斯巴甜的提取,果冻基质弹滑,较难用旧国标中的方法充分提取,新国标提出匀浆称样,并加入80%甲醇水溶液,70 ℃水浴加热提取,有效提高目标组分的回收率。
2.4 前处理中增加了正己烷的使用
新国标中,针对胶基糖果、脂肪类乳化制品、巧克力及巧克力制品。坚果与籽类、水产及其制品、蛋制品这些类别的食品,也分别提出加入正己烷进行前处理。旧国标中,此类样品较难用其规定的方法充分提取,杂质干扰也比较严重,新国标中针对胶基类、含脂肪类物质使用正己烷,正己烷是低毒、无色的液体,不溶于水,对胶基类物质有很好的溶解能力,也对脂肪有较好的提取能力。加入正己烷,有效净化样品的基质干扰以及脂肪的残留,对提高目标组分的回收率起了很大的作用。
3 色谱条件的改变
新国标中升高了柱温箱温度,由25 ℃升至30 ℃;流动相增加乙腈-水(20+80)的选择;检测波长也从208 nm改为200 nm。流动相增加乙腈-水(20+80)的选择,可使检测人员在做实验时根据实验分析条件的不同进行优化选择,使色谱条件更加科学、更加完善。试验发现,相同浓度的标准物质,在相同的试验条件下同时测定,200 nm测定时的阿斯巴甜响应值明显大于208 nm测定时阿斯巴甜的响应值,见图1。

图1 在200 nm和208 nm测定时的阿斯巴甜响应值
4 标准溶液系列的制备及有效期
旧国标中阿斯巴甜标准储备液浓度为1.00 mg/mL,置于冰箱保存,有效期为180 d,其标准使用液的系列浓度为 500 μg/mL、250 μg/mL、125 μg/mL、50.0 μg/mL、25.0 μg/mL, 置于冰箱保存, 有效期为60 d。新国标中,将阿斯巴甜标准储备液浓度改为0.5 mg/mL,置于4 ℃左右冰箱保存,有效期为90 d,其标准使用液的系列浓度为 100 μg/mL、50 μg/mL、25 μg/mL、10.0 μg/mL、5.0 μg/mL,置于 4 ℃左右冰箱保存,有效期为30 d。可以看出,旧国标中选取的使用液浓度较大,往往超过样品所含阿斯巴甜浓度的数倍,而新国标中使用液浓度较小,基本涵盖了样品中所含阿斯巴甜的浓度,且有效期的缩短,保证了标准使用液的有效性,更加科学合理。
5 分析结果的表述
新国标增加了“结果保留3位有效数字”的规定,使方法数据结果更加严谨统一。
6 检出限和定量限
旧国标中仅粗略规定样品称样量为5 g、定容体积为25 mL、进样量为20 μL时,方法检出限为0.002 g/kg,定量限为0.006 g/kg,而新国标中,根据样品类别的不同、前处理方法的不同,分别给定了检出限与定量限(详见表1),使方法更加严谨、规范,更具有科学性。

表1 新国标中各类食品中阿斯巴甜的检出限和定量限
7 实验验证
根据新旧国标对前处理的改变,选取改动较大的果冻及胶基糖果进行实验验证。试验步骤如下:选用市售含阿斯巴甜的果冻及胶基糖果-口香糖,分别根据新旧国标的前处理方法进行重复性对比验证。
7.1 仪器与试剂
高效液相色谱仪— Agilent HPLC配DAD检测器、恒温箱、自动进样器以及Agilent 化学工作站;超声波振荡器;离心机:转速≥4 000 r/min;甲醇;正己烷。
7.2 仪器参考条件
色谱柱—CAPCELL PAK C18 MGⅡ S5,4.6 mmI.D.×250 mm;柱温:30 ℃;流动相:甲醇-水(40+60);流速:0.8 mL/min;进样量:20 μL;检测波长:200 nm。
7.3 样品前处理
因旧国标中,对果冻以及口香糖没有明确的前处理方法,故选择参照固体饮料的前处理步骤。具体条件如表2所示。

表2 新旧国标样品前处理过程
7.4 标准曲线的绘制
根据样品的实际情况,选取新国标中的浓度范围配制标准曲线,具体浓度见表3。

表3 新国标中采用的标准曲线系列浓度
阿斯巴甜浓度与峰面积呈正相关,其线性回归方程为:y= 55.87 178x,线性相关系数R为0.999 6,线性相关系数R≥0.999时可认为线性良好。
7.5 试验结果及重复性比较
根据上述试验条件,试验结果及重复性比较见表4。
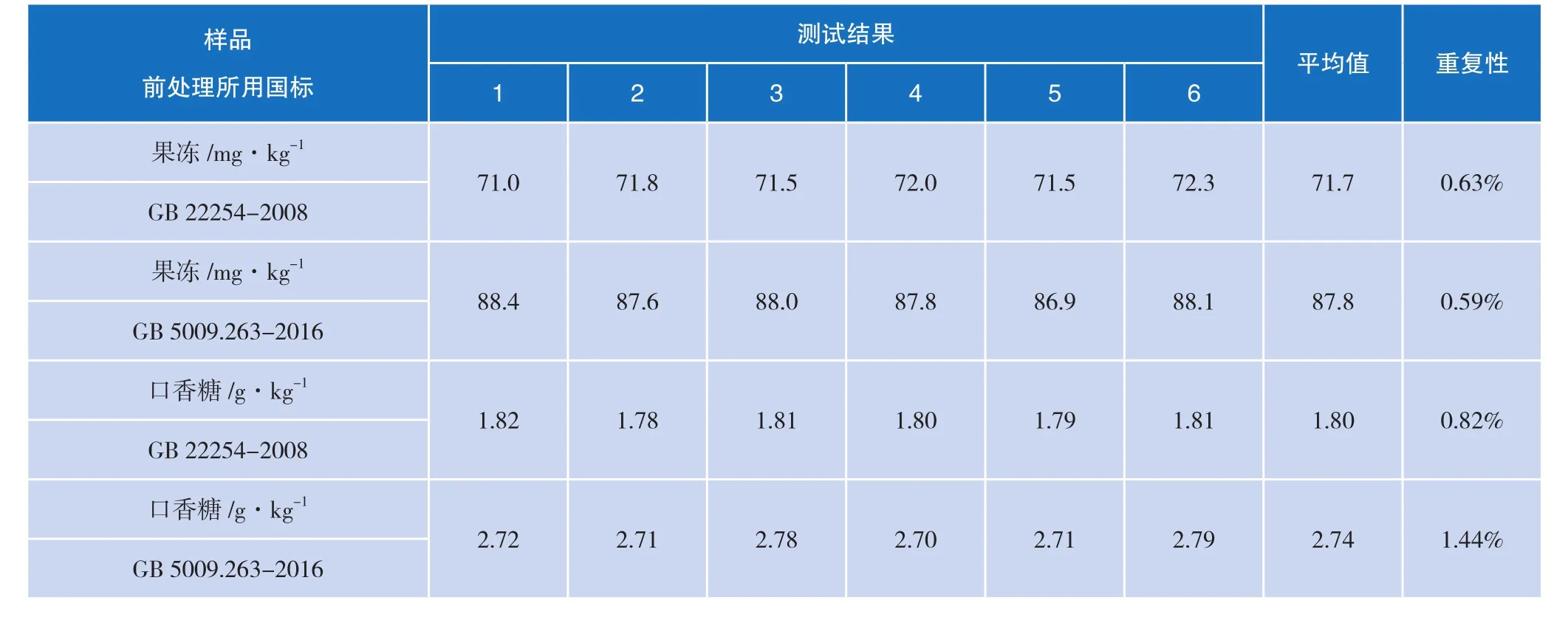
表4 试验结果及重复性
试验证明,新国标中对果冻及胶基糖果(口香糖)前处理方法的改进对阿斯巴甜提取能力有显著提高。
8 结语
新国标对比旧国标,无论是从样品的细化分类、前处理方式方法的改进、色谱条件的优化、标准曲线的有效性和绘制,还是检出限与定量限的改变,都有了更科学、更合理的改进,提高了目标组分的回收率,细化了检出限与定量限,是目前比较完善科学的阿斯巴甜检测方法。
[1]蒋定国,王竹天,杨大进、等.高效液相色谱法测定食品中阿斯巴甜的含量[J].中国卫生检验,2007,17(6).
[2]宋雁,樊永祥,李宁.阿斯巴甜的安全性评价进展情况[J].中国食品卫生杂志,2010,22(1):84-87.
[3]吴燕.高效液相色谱同时测定食品中5种添加剂[J].上海预防医学,2008,20(3):113-115.
[4]刘郁,刘连新,燕传勇,等.高效液相色谱测定茶饮料中的阿斯巴甜含量[J].现代食品科技,2012,28(12):1810-1812.
[5]中华人民共和国卫生部. GB 22254-2008食品中阿斯巴甜的测定[S].北京:中国标准出版社,2008.
[6]中华人民共和国国家卫生和计划生育委员会. GB 5009.263-2016食品安全国家标准 食品中阿斯巴甜和阿力甜的测定[S]. 北京:中国标准出版社,2016.

