基于扫描电镜观察研究真菌孢子检测对稻谷霉变判定
唐 芳 欧阳毅 祁智慧
(国家粮食局科学研究院,北京 100037)
稻谷是我国主要口粮,作为战略储备粮之一,部分稻谷储存时间超过一年,因此稻谷储藏安全是关系到百姓健康、关乎国计民生的大事。近年来,部分稻米加工和储藏企业为了提高经济效益,尽可能提高稻谷储藏水分,以提高整精米率。而高水分稻谷储运过程中,很容易为微生物滋生提供条件。稻谷的储藏安全问题不容忽视。稻谷储藏是否安全,首先要明确判定标准。针对粮食储藏安全判定标准,国内外开展了大量研究工作,总体可归纳为三大类[1]:CO2和干重损失、籽粒发芽能力、肉眼可见霉菌。依据C6H12O6+6O2→6CO2+6H2O+heat公式,储粮质量变化与粮食自身以及生长的微生物呼吸代谢密切相关。Karunakaran等[2-4]通过测CO2释放速率预测粮食质量下降情况,由于检测需要精密仪器,且受实际仓储气密性影响,CO2波动范围较大,鲜见在实际仓储中应用。Seib[5]等提出将干重损失作为粮食质量变化一项指标,但干重损失多少时粮食质量达到不可接受的程度,仍备受争议[5-7]。发芽能力是种子具有生命力的典型特征,可作为粮食种子安全的判定标准[4,8-10],它受温度、水分、破碎以及虫霉侵染等多方面因素的影响,很容易导致下降,因此,作为口粮或储备粮质量安全的判定标准过于严格。肉眼可见霉菌是应用较为广泛的判定标准,因其操作简单直观,有些学者认为是最佳的判定标准[11-13],同时也有部分学者提出这个标准仍存在缺点[14-15]:一方面,肉眼观察到粮粒上有霉变时,粮食质量已经出现问题,缺乏预测性,另一方面,观察者主观性很强,判别差异性很大。因此,肉眼可见霉菌作为安全的判定标准也一直备受争议。Magan曾提出[15],显微镜下观察到微生物菌丝及孢子生长更为及时准确。笔者认为,为确保粮食食用安全,不发生霉变是最基本判定依据。笔者在前人研究的基础上,经过多年的研究,建立储粮霉菌检测方法——真菌孢子计数法[16]。本实验以实仓储藏稻谷样品为研究对象,基于扫描电镜观察稻谷籽粒不同加工阶段微生物生长情况,并与原粮真菌孢子计数检出水平进行对比,以确定稻谷霉变检测判定界限,用于指导储运过程中稻谷霉变判定,为稻谷储藏安全提供检测和判定依据。
1 材料与方法
1.1 实验材料
东北粳稻,采自北京某粮食收储库,2016年4月入库,9月29日粮堆表层共选取12个点,每点在距离表面40 cm出手动采样,取样量500 g左右,样品于4 ℃低温保存。
1.2 主要仪器
SMART生物显微镜:重庆奥特公司;M205FA体视显微镜:德国徕卡公司;E1010离子溅射仪:日本日立公司;S-3000N扫描电子显微镜:日本日立公司;JDMZ 100稻谷出米率检测仪:北京东方孚德公司。
1.3 实验方法
1.3.1 真菌孢子计数法[16]
1.3.2 稻谷脱壳碾米处理
从备选样品中称取一定量稻谷籽粒,一部分采用手工脱壳,一部分采用砻谷脱壳,脱壳后糙米装入密封袋内标注备用。取一定量砻谷脱壳糙米进行碾米加工,制备一级大米[17],并分装入密封袋内标注备用。
1.3.3 体视显微镜观察
称取一定量实验稻谷原粮籽粒及糙米样品,用体视显微镜放大8倍左右进行观察。
1.3.4 扫描电镜观察
对稻谷原粮籽粒、处理后糙米以及一级大米,按照组别随机选取三粒,将试验样品有序粘在扫描电镜样品盘上,采用离子溅射仪对样品表层进行喷金处理,并对籽粒胚乳和胚部进行扫描电镜观察。
2 结果与分析
大部分真菌具有好氧生长特性,粮食储存期间,适宜条件下,真菌先在粮粒表面开始生长。针对这一特性,笔者开发了储粮真菌快速检测方法—真菌孢子计数法:一定量的粮食样品,通过加水剧烈振荡,洗脱粮粒表面已生长的真菌孢子,洗脱液过滤后,于显微镜下放大600~800倍进行真菌孢子观察计数。采用该方法对不同感染水平的小麦、稻谷样品进行了重复性实验(n=8),相对标准偏差(RSD%)范围在8.2%~31.4%;与平板菌落计数法比较,相关系数r2=0.847 9,表明两种方法具有良好的相关性[16]。方法操作简单,单个样品检测时间2-3 min。方法特点是在传统细胞计数法基础上,通过对真菌孢子检测浓度设限(1.0×105个/g),消除了样品自身携带真菌孢子的干扰,达到仅检测储藏过程中生长真菌的目的。
本研究采用上述真菌孢子检测方法,对粮库采集的样品进行孢子计数,选取孢子检出水平范围分别在0~5.0×104、1.0~5.0×105、1.0~5.0×106个/g的样品,标记为Ⅰ、Ⅱ、Ⅲ 组。对各组样品进行表观色泽气味观察比较,并对各组样品原粮、糙米、一级大米进行显微特征观察。具体研究结果如下。
2.1 表观色泽气味比较
Ⅰ、Ⅱ、Ⅲ组样品并排摆放,肉眼观察,颜色略有差别,但不明显。每个样品肉眼观察时,未见明显霉变籽粒。不同组别的稻谷样品,刚开启密封袋时,气味略显差异,Ⅰ组样品略带稻谷固有香气,Ⅱ组样品无香气也无异味,Ⅲ组样品略带霉味。密封袋开封后敞开放置一段时间,气味没有差异。
2.2 体视显微镜观察结果
Ⅰ、Ⅱ、Ⅲ组样品,每组样品中随机称取20 g原粮籽粒放于玻璃皿中待观察。每组样品各称取100 g样品进行砻谷脱壳,然后称取20 g糙米籽粒放于玻璃皿中待观察。按方法1.3.3分别观察原粮籽粒和糙米籽粒,观察结果见图1、图2。

图1 Ⅰ、Ⅱ、Ⅲ组稻谷表面体视显微镜图片(8×)

图2 Ⅰ、Ⅱ、Ⅲ组糙米表面体视显微镜图片(8×)
从图1、图2可以看出,Ⅰ组稻谷颖壳颜色鲜亮,Ⅱ组少数籽粒颖壳有锈斑,颜色略暗,Ⅲ组部分籽粒颖壳有锈斑,颜色变暗。锈斑在8倍放大的情况下,不能确认为霉菌斑。对各组别糙米放大观察,糙米色泽亮度未见明显差异,三组糙米表面均未见明显霉斑,未达到稻谷国标[18]中“生霉粒”的标准——“稻谷粒生霉,去壳后糙米表面有霉斑的颗粒”。但仔细观察,Ⅲ组糠皮层局部破坏区增加,胚芽部分不够饱满。
2.3 扫描电镜观察结果
2.3.1 稻壳表面
Ⅰ、Ⅱ、Ⅲ组稻谷样品中,随机选择稻谷籽粒,扫描电镜放大500倍后,观察稻壳表面情况。从图3可以看出,不同组别稻壳表面菌丝和孢子分布密度存在明显差异。Ⅰ组稻谷颖壳凸起光滑,表面难寻真菌孢子和菌丝踪迹;Ⅱ组颖壳表面可见附着物,可观察到真菌孢子与菌丝结构;Ⅲ组颖壳表面附着物数量明显增加,真菌孢子和菌丝明显比Ⅱ组多。

图3 Ⅰ、Ⅱ、Ⅲ组稻壳表面电镜扫描图片(500×)
2.3.2 糙米表面
2.3.2.1 手剥脱壳糙米表面电镜观察
Ⅰ、Ⅱ、Ⅲ组稻谷样品,随机称取10 g样品,逐一采用手剥脱壳,并置于玻璃皿中。每组糙米样品随机选取3粒,按1.3.4方法处理,并对籽粒胚乳和胚部进行扫描电镜观察。每组3粒样品电镜观察后,选取共性较强具有代表性的图片进行比较,观察结果见图4~图7。
由图4~图7可以看出,Ⅰ组稻谷真菌孢子检出水平为0~5.0×104个/g,糙米籽粒胚乳及胚部表面几乎找不到真菌孢子与菌丝;Ⅱ组检出水平为1.0~5.0×105个/g,可观察到少量真菌孢子与菌丝;Ⅲ组检出水平为1.0~5.0×106个/g,可观察到大量真菌孢子与菌丝体,密度大,菌丝较Ⅱ组的粗壮,且分布较多分生孢子梗结构。手剥脱壳情况下,对糙米糠皮层几乎没有损伤,外层果皮上生长的菌丝和孢子几乎保留原有状态。不同组别样品糙米表面真菌孢子和菌丝分布密度与稻谷原粮真菌孢子检出水平呈正相关。
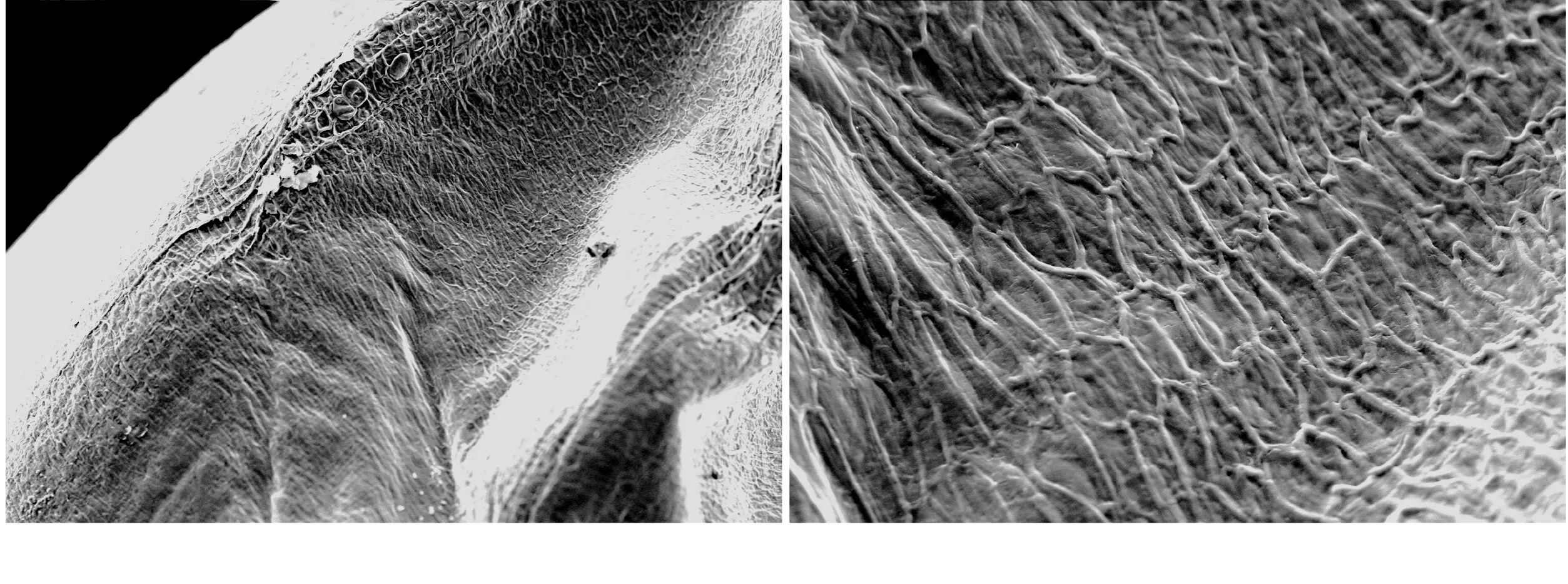
图4 Ⅰ组手剥脱壳糙米胚部表面(左100×、右500×)

图5 Ⅱ组手剥脱壳糙米胚部表面(左100×、右500×)
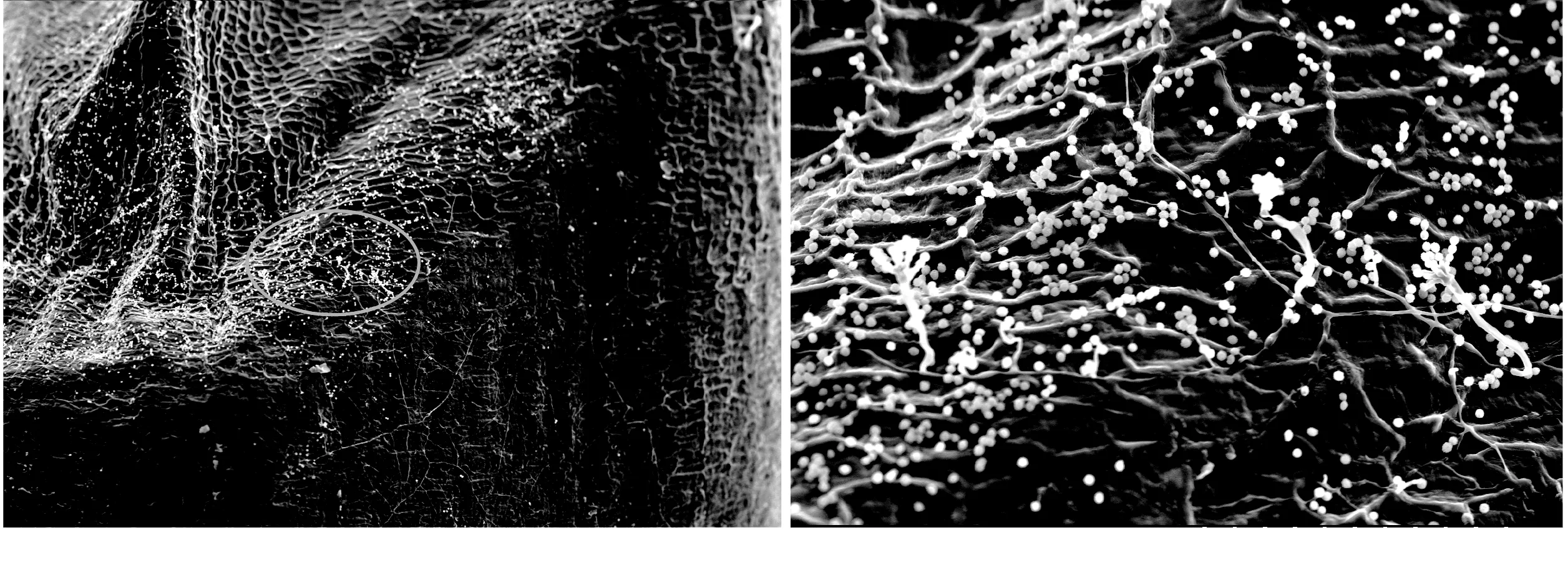
图6 Ⅲ组手剥脱壳糙米胚部表面(左100×、右500×)

图7 Ⅰ、Ⅱ、Ⅲ组手剥脱壳糙米胚乳表面(1 000×)
稻米虽有颖壳保护,当微生物生长到一定程度时,可通过缝隙或裂缝进入,进一步侵染糙米表面。微生物生长会分泌酶类,为其生长提供营养成分,进而导致裂缝扩大[19]。Ⅲ组糙米胚及胚乳表面存在大量的菌丝孢子,多个分生孢子梗结构清晰可见,且胚部菌丝孢子量明显大于胚乳,这与胚芽营养丰富有关。而这些糙米样品,肉眼观察时无明显差别。
2.3.2.2 砻谷机械脱壳糙米表面电镜观察
Ⅰ、Ⅱ、Ⅲ组稻谷样品,随机称取30 g样品,砻谷脱壳后得到糙米,并分别置于玻璃皿中。后续处理方法同手剥脱壳糙米样品,观察结果见图8~图11。
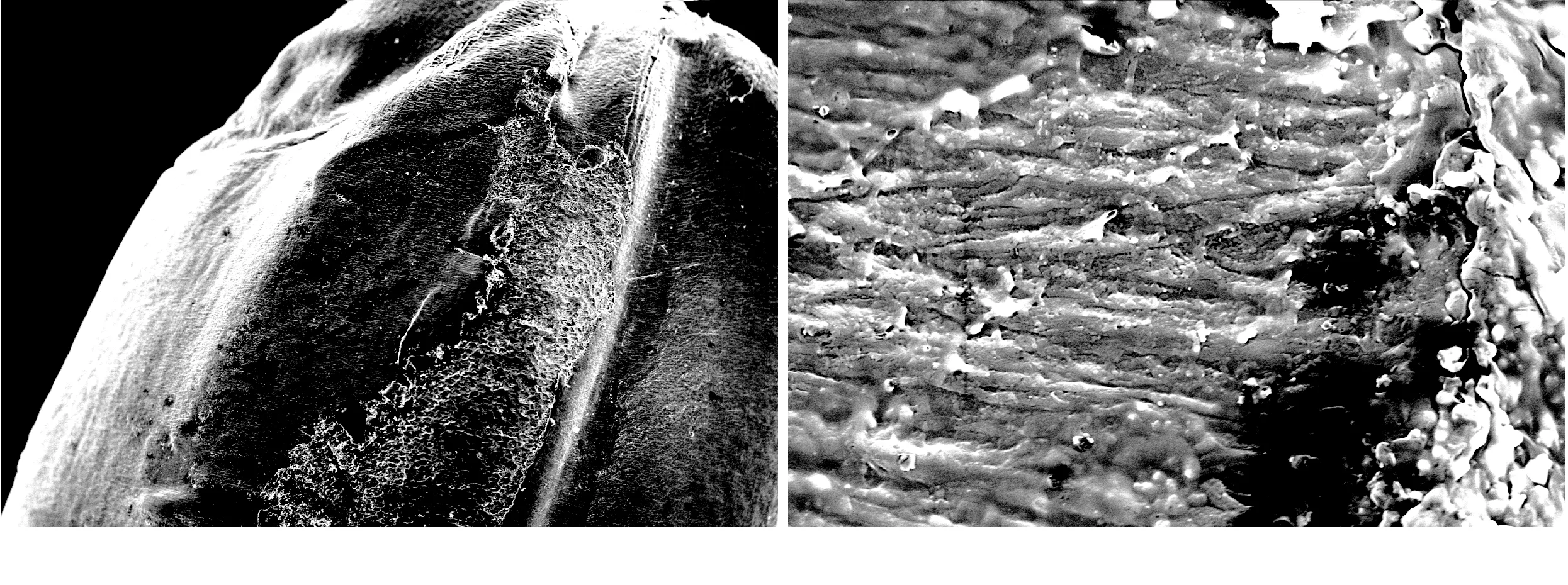
图8 Ⅰ组砻谷脱壳糙米胚乳表面(左40×,右1 000×)

图9 Ⅱ组砻谷脱壳糙米胚乳表面(左40×、右1 000×)
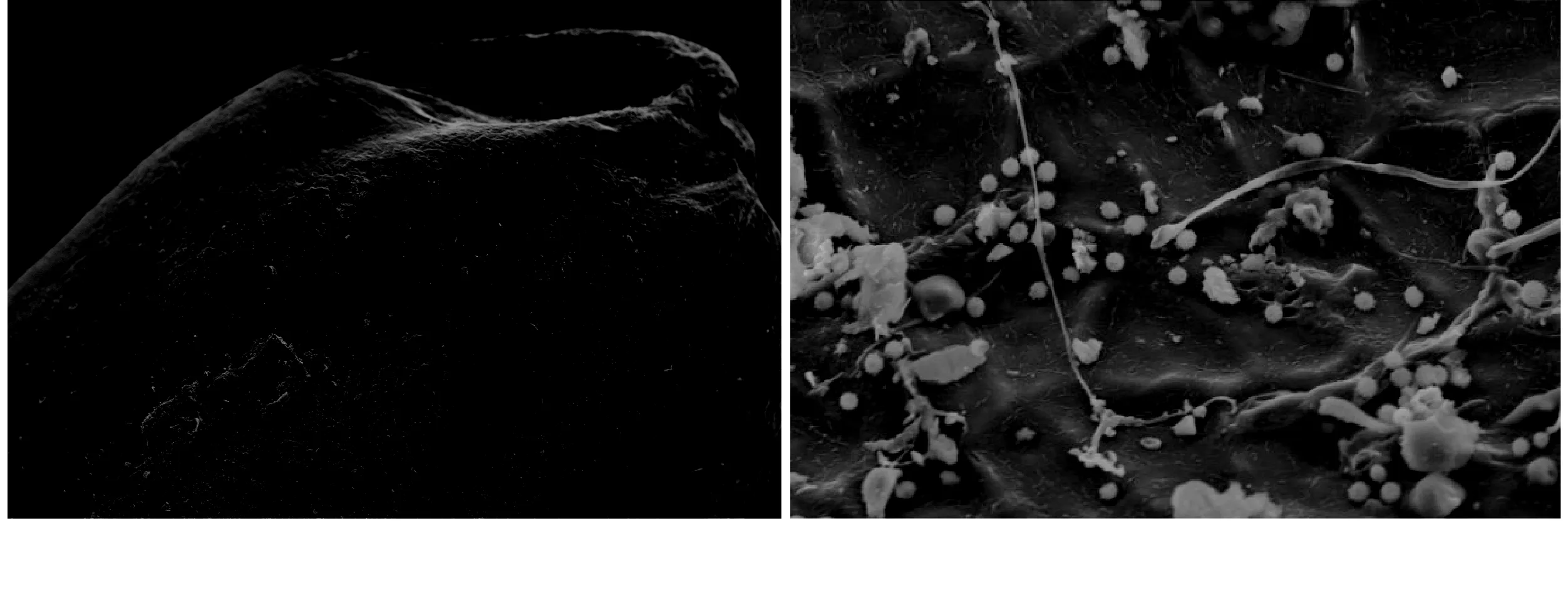
图10 Ⅲ组砻谷脱壳糙米胚乳表面(左40×、右1 000×)

图11 Ⅰ、Ⅱ、Ⅲ组砻谷脱壳糙米胚部 (1 000×)
由组图8~图11可以看出,砻谷脱壳过程中,由于胶辊的挤压和撕搓,致使颖壳脱离,对大面积鼓起的胚乳部分有一定的损伤。I组表面干净,Ⅱ组表面可观察到菌丝附着,有个别散落的孢子,Ⅲ组仍可观察到大量散落的孢子以及被撕扯过菌丝。处于端侧的胚部是内陷结构,损伤较小,与手动剥壳比较,Ⅱ、Ⅲ组糙米胚部仍可清晰观察到菌丝孢子结构,但由于机械摩擦振动或风力作用,产孢结构及部分孢子会脱落,孢子数量相应减少。由此可见,由于砻谷脱壳对糙米表面会造成一定程度的机械损伤,破坏糠皮层的完整结构。若稻谷原粮已有一定程度真菌生长,糙米表面损伤将为真菌入侵籽粒内部提供有利条件,造成潜在的安全隐患。
2.3.3 一级大米表面电镜观察
Ⅰ、Ⅱ、Ⅲ组稻谷样品,随机称取100 g样品,按大米国标[17]要求砻碾至一级大米,并置于玻璃皿中。后续处理方法同手剥脱壳糙米样品,观察结果见图12、图13。

图12 Ⅰ、Ⅱ、Ⅲ组一级大米胚乳部位表面

图13 Ⅰ、Ⅱ、Ⅲ组一级大米胚部表面(1 000×)
图12为一级大米胚乳表面,Ⅰ、Ⅱ、Ⅲ组一级大米粒表面几乎没有皮层残留痕迹,亚糊粉层直接暴露。粒面基本观察不到完整的孢子菌丝结构。亚糊粉层随着真菌检出水平的增加,表面呈现逐渐平滑趋势。图13为Ⅰ、Ⅱ、Ⅲ组样品米胚去净后,胚部淀粉质细胞直接暴露,细胞壁清晰可见。细胞内淀粉颗粒粒径存在明显差异,随原粮真菌孢子检出水平升高,粒径逐步变小。胚芽营养丰富,为微生物生长提供了充足的养分,而胚部真菌大量生长繁殖,已经穿透胚芽,影响到胚部细胞层。因此,导致真菌分布密度越大,胚部细胞淀粉颗粒粒径越小,两者呈负相关。
由此可见,糙米经过碾磨处理后,大部分表层的菌丝孢子可被清除,但大米亚糊粉层及胚部细胞发生的变化,仍与微生物生长程度密切相关。化学成分是否有变化或微生物代谢产物是否有积累,仍需进一步研究。
3 结论
3.1 稻谷虽有颖壳保护,霉菌菌丝仍能通过缝隙或裂缝进入,在糙米表面生长繁殖,且胚芽部位因营养丰富,霉菌生长量大于胚乳部分。
3.2 糙米表面携带的真菌孢子菌丝量与原粮表面真菌孢子检出水平呈正相关。通过扫描电镜观察研究,初步确定真菌孢子检出在1.0~5.0×105个/g水平时,稻谷籽粒可判定为开始霉变,1.0~5.0×106个/g水平时,稻谷籽粒可判定为严重霉变。
3.3 原粮真菌孢子检出水平在1.0~106个/g以上,机械脱壳的糙米,糠皮层遭到破坏,表面损伤为真菌入侵籽粒内部提供有利条件,糙米储存存在较大安全隐患。经碾磨后得到一级大米,胚乳亚糊粉层以及胚部淀粉颗粒均发生一定程度的变化,是否存在食用安全隐患,有待于进一步研究。
[1]KALETA A, GORNICKI K. Criteria of Determination of Safe Grain Storage Time. Review. 2013. http://dx.doi.org/10.5772/52235. http://cdn.intechopen.com/pdfswm/39944.pdf
[2] WHITE N D G, SINHA R N, MUIR W E. Intergranular carbon dioxide as an indicator of biological activity associated with the spoilage of stored wheat[J]. Canadian Agricultural Engineering, 1982, 24:35-42
[3] SROUR S. Thermic properties of grains-production of heat and CO2[M]//Multon J L. Preservation and Storage of Grain, Seeds and their By-Products -Cereals, Oilseeds, Pulses and Animal Feed. New York: Lavoisier Publishing, ISBN 2-85 206-4367, 1988:189-202
[4]KARUNAKARAN C, MUIR W E, JAYAS D S, et al. Safe storage time of high moisture wheat[J]. Journal of Stored Products Research, 2001, 37(3):303-312
[5]SEIB P A, PFOST H B, SUKABDI A, et al. Spoilage of rough rice measured by evolution of carbon dioxide, Proceedings of the 3rd annual workshop on Grains Post-harvest Technology, 1980:75-93, Kuala Lumpur, Malaysia, 29-31
[6]FREER M W, SIEBENMORGEN T J, COUVILLION R J, et al. Modeling temperature and moisture content changes in bunker-stored rice[J]. Transactions of the ASAE, 1990, 33(1):211-220
[7]ADHIKARINAYAKE T B, PALIPANE K B, MÜLLER J. Quality change and mass loss of paddy during airtight storage in a ferro-cement bin in Sri Lanka[J]. Journal of Stored Products Research, 2006, 42(3):377-390
[8]BLACK M. Seed germination and dormancy[J]. Science Progress, 1970, 58:379-393
[9]POMERANZ Y. Biochemical, functional and nutritive changes during storage [M]//Christiansen C M. Storage of cereal grains and their products. 3rd edition. USA: American Association of Cereal Chemists, ISBN 0913250236, 1982:56-114
[10]AL-YAHYA S A. Effect of storage conditions on germination in wheat[J]. Journal of Agronomy & Crop Science, 2001, 186(4):273-279
[11]BOWDEN P J, LAMOND W J, SMITH E A. Simulation of near-ambient grain drying. 1. Comparison of simulations with experimental results[J]. Journal of Agricultural Engineering Research, 1983, 28(4):279-300
[12]RYNIECKI A, NELLIST M E. Optimization of control systems for near-ambient grain drying[J]. Journal of Agricultural Engineering Research, 1991, 48:1-35
[13]NELLIST M E. Bulk storage drying in theory and practice[J]. Journal of the Royal Agricultural Society of England, 1998, 159:120-135
[14]FLEURAT-LESSARD F. Qualitative reasoning and integrated management of the quality of stored grain: a promising new approach[J]. Journal of Stored Products Research, 2002,38(3): 191-218
[15]MAGAN N.Early detection of fungi in stored grain[J]. International Biodeterioration & Biodegradation, 1993, 32(1-3):145-160
[16]程树峰, 唐芳, 伍松陵. 储粮真菌危害早期检测方法的研究 [J]. 中国粮油学报, 2011, 26(4): 85-88
CHENG Shufeng, TANG Fang, WU Songling. Study of determination of early deterioration of stored grain by fungi[J]. Journal of the Chinese Cereals and Oils Association, 2011, 26(4): 85-88
[17] GB 1354—2009大米
GB 1354—2009 Rice
[18]GB 1350—2009稻谷
GB 1350—2009 Paddy
[19]MANGALA H A, REDDY K R N, SINGOTAMU L, et al.Aspergillicolonize and produce AFB1 in discolored rice grain[J]. Journal of Mycology and Plant Pathology, 2006, 36(3):418-426.

