B6-St小鼠与C57BL/6小鼠周围神经再生能力的比较
吴刘成, 杨文杰, 范海华, 易剑峰, 田家玮, 史祎敏, 蒋茂荣
(南通大学1. 实验动物中心, 2. 医学院, 3. 杏林学院, 南通 226001)
现代社会高速发展,社会节奏加快,事故、损伤、地震、疾病等导致的神经损伤的人数也在逐年增多,对个人和社会带来很大的负担,神经损伤的修复始终受到大家的重视。外周神经缺损之后的修复具有重要意义,关系到桥梁性作用、趋化作用和微环境作用[1]。神经修复过程异常复杂并且目前技术有限, 而随着人类基因组序列完成测序,2002年12月小鼠的基因组草图也顺利完成,为深入研究基因与周围神经再生的分子生物学机制奠定基础。短尾小鼠是由乙基亚硝基脲(ENU)诱变获得,稳定遗传的Brachyury基因突变小鼠,被命名为B6-St(B6-Short tail)小鼠[2],小鼠的髓鞘结构有松散、缺失、混乱的迹现。从短尾小鼠脊髓外观表型完好,与正常小鼠无差异,但神经元密度低于正常小鼠[3]。本文旨在通过分别建立两种小鼠的坐骨神经夹伤模型,研究神经被夹伤以后小鼠的行走轨迹, 神经肌肉形态变化及电生理等相关指标, 比较研究C57BL/6小鼠与B6-St小鼠外围神经的再生能力,探讨Brachyury基因与周围神经再生的关系。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 清洁级B6-St小鼠为实验组,C57BL/6小鼠为对照组,每组各10只,体质量(20±2) g,雌雄各半,由南通大学实验动物中心提供[SCXK(苏)2014-0001]。本实验所有动物操作均符合实验动物福利要求,并通过南通大学实验动物伦理委员会审查。
1.1.2 主要仪器与试剂 Leica DMR正置研究级荧光显微镜、冷冻切片机(Leica CM1900), 购自德国Leica公司; MYTO肌电图诱发电位仪,购自意大利Esaote 公司; 戊巴比妥钠(Cat. No.: P3761-25g), 购自美国Sigma公司; 伊红(Cat. No.: E607321)和苏木素(Cat. No.: E607317), 购自生工生物(上海)有限公司。
1.2 方法
1.2.1 制备坐骨神经夹伤模型 术前1 d下午起小鼠禁食。手术当日按体质量随机分组,质量分数1.5%戊巴比妥钠麻,0.1 mL/20 g 体质量,腹腔注射。深度麻醉后,小鼠大腿左股部手术区域备皮,参考蒋茂荣等[4]方法制备坐骨神经夹伤模型。
1.2.2 足迹实验 手术后在外部条件相同的环境中小鼠恢复适应一段时间后进行足迹实验, 检测小鼠术后8 d、12 d、16 d恢复情况, 按照常规足迹试验测量并记录足印长度(PL)、足趾宽度(TS)、中间足趾宽度(IT)。坐骨神经功能指数(sciatic function index, SFI)以0为正常值, -100为神经完全断离的指标。SFI =38.3×[(EPL-NPL)/NPL]+109.5×[(ETSNTS)/NTS]+13.3×[(EIT-NIT)/NIT]-8.8, 公式中E表示伤侧足, N表示正常足。
1.2.3 电生理检测 术后3周,对所有小鼠称重并记录小鼠体质量,质量分数1.5%戊巴比妥钠麻(方法同上),深度麻醉后,经过外科手术暴露出小鼠坐骨神经,分离出坐骨神经,将记录电极刺入腓肠肌,干扰电夹住小鼠膝部皮肤,刺激电极置于夹伤近处、远端坐骨神经干,电刺激,检测复合动作电位(CMAPs),测量振幅和潜伏期。
1.2.4 取材及样品处理 术后21 d,按照常规方法灌注固定。每组取2只小鼠并通过手术取下夹伤的坐骨神经,坐骨神经要求完整不能有破损,浸入预冷质量分数4%甲醛4 ℃后固定,取出双侧完整腓肠肌,滤纸吸干其外表水分,称量腓肠肌湿重,计算腓肠肌湿重比。
1.2.5 腓肠肌形态观察 肠肌标本经质量分数4%甲醛固定后,流水冲洗过夜; 酒精梯度脱水; 二甲苯透明; 浸蜡; 包埋; 石蜡切片; 按照常规的方法进行HE染色,光学显微镜下观察拍照保存。观察腓肠肌细胞大小,是否有肌肉萎缩现象。
1.2.6 腓肠肌细胞形态计量分析 在6个染色完好的切面中随机选取3个视野清晰的图片, 用铅笔标注清楚细胞测量每个样品在各个视野肌纤维的横切面积(CSA), 并且数出视野内共有多少细胞, 求平均值。
1.2.7 数据统计 计量数据用表示, 用STATA7软件分析, 组间比较采用单因素方差分析(one-way ANOVA)方法,P<0.05为差异有统计学意义。
2 结果
2.1 B6-St小鼠与C57BL/6小鼠SFI比较
由表1可见, 夹伤手术后8 d、12 d、16 d两组小鼠SFI值不断增加, 神经呈缓慢恢复趋势, 组内不同时间点神经功能恢复差异有统计学意义(P<0.05),但两组小鼠间差异无统计学意义(P>0.05)。

表 1 两组小鼠SFI比较Table 1 Comparison of sciatic function index of sciatic nerve between the two group mice
2.2 B6-St小鼠与C57BL/6小鼠坐骨神经电生理学比较
术后21 d, 对坐骨神经夹伤处电刺激时,两组小鼠近侧端和远侧端的CMAPs呈规律的波幅变化(图1),C57BL/6小鼠与B6-St小鼠CMAPs振幅分别为(4.35±3.29) mV和(4.62±2.77) mV(P>0.05)。
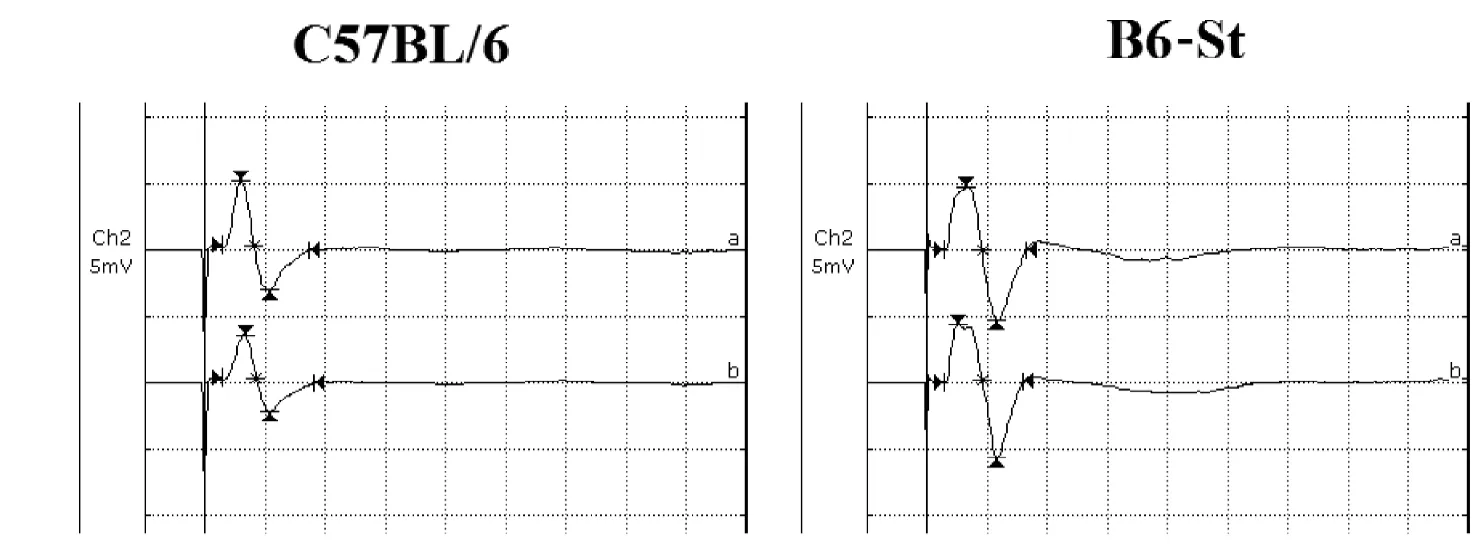
图 1 电刺激对坐骨神经夹伤小鼠CMAPs的影响Figure 1 Effect of electrical stimulation on compound muscle action potentials (CMAPs) of sciatic nerve injury mice
2.3 B6-St小鼠与C57BL/6小鼠腓肠肌湿重比比较
术后21 d, C57BL/6小鼠与B6-St小鼠腓肠肌湿重比分别为446.31±48.35和467.18±60.51(P>0.05)提示神经损伤后,肌肉有失神经肌萎缩现象,两组小鼠肌肉萎缩程度相似。
2.4 B6-St小鼠与C57BL/6小鼠腓肠肌肌纤维横截面积的比较
病理切片观察显示, 两组小鼠肌肉横切面几乎接近圆形, 大小相比较也都比较接近,没有忽大忽小的细胞形态。肌纤维分布较为均匀,细胞核和质位置分布明显,位于肌细胞膜下方靠近边缘位置(图2); 这两组小鼠腓肠肌肌纤维CSA均为450 μm2左右(P>0.05)。
3 讨论
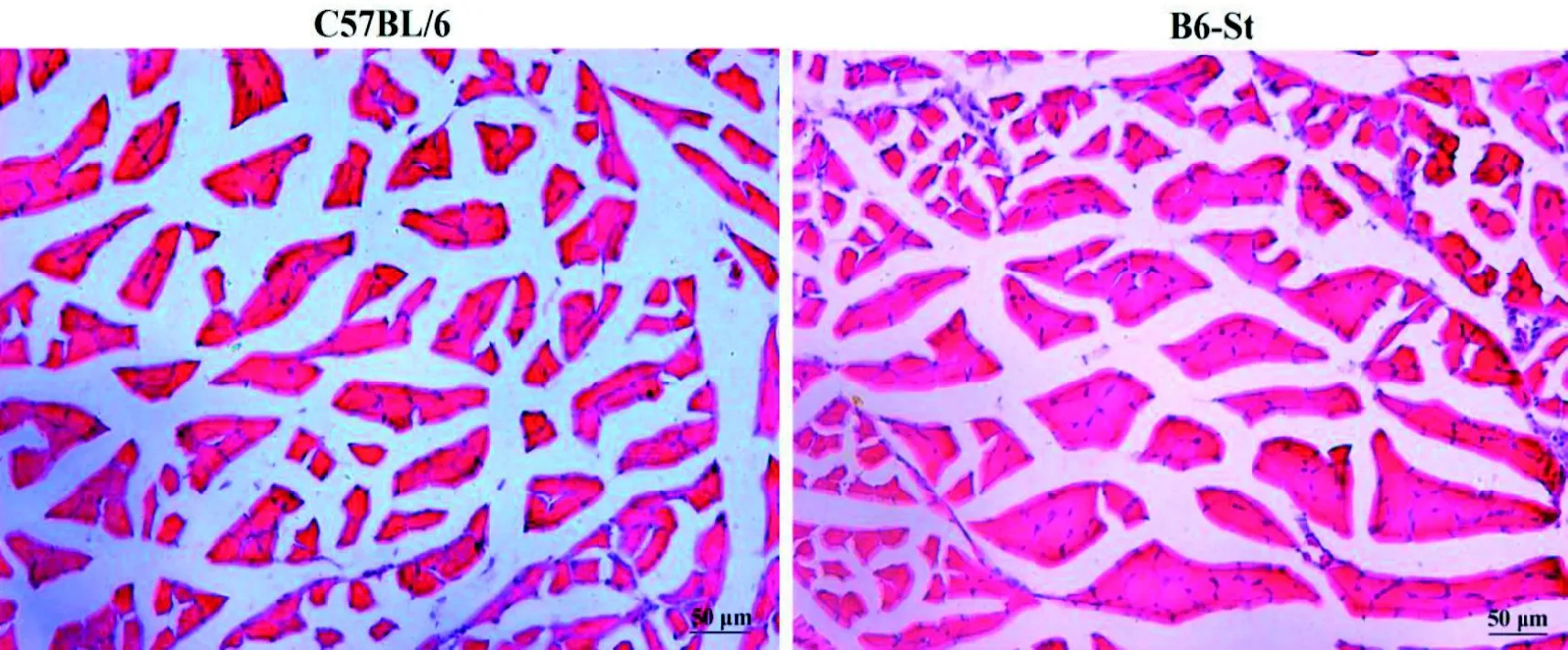
图 2 两组小鼠腓肠肌HE染色Figure 2 The HE staining of gastrocnemius muscle in two group mice
短尾小鼠(B6-St)是通过ENU诱变获得的稳定遗传突变系小鼠,该小鼠17号染色体Brachyury基因突变, 小鼠出生后仅有1cm左右的尾牙[5]。B6-St小鼠表型遗传稳定,突变基因及位点确定,是研究遗传性疾病和基因功能的极好载体。人类Brachyury基因定位于染色体6q27区域,编码一种属于T-box转录因子家族成员的Brachyury蛋白,Brachyury蛋白的转录活性在中胚层发育和脊索的形成过程中发挥着关键作用。Brachyury突变体的胚胎干细胞从原条向外迁移的能力受损,在细胞黏附中起促进作用[6]。小鼠脊柱异常,脊髓向外发出许多周围神经,而对于周围神经的再生是否有一定的关联,尚未有关报道。而且B6-St小鼠脊髓灰质的前角运动神经元数目较少,低密度的神经元可能延缓损伤神经的修复,通过比较这两种小鼠的差异,探讨可以快速修复受损神经的方法。
SFI是评估坐骨神经再生及功能恢复的一个重要参考指标,可反映下肢夹伤后肌肉恢复情况及下肢各肌肉的协调功能[7]。小鼠夹伤后分别在8d、12 d、16 d时实验,测量损伤测和正常测的足印长度、足趾宽度、中间足趾宽度,数据统计得到SFI。结果显示,两组小鼠SFI值随着术后恢复时间的延长而逐渐增加,神经功能逐渐转好,两组恢复成度基本趋于一致。
电生理技术通过检测神经传导过程中的动作电位,深入研究神经传导及功能的重要研究方法,常用于评定周围运动神经传导功能[8]。而B6-St小鼠与C57BL/6小鼠夹伤后CMAPs无明显差异,CMAPs的振幅与神经纤维支配靶肌的神经纤维数成正比,是神经传导功能恢复的重要参考,而两组CMAPs值差异无统计学意义,坐骨神经传导功能恢复组间差异无统计学意义。
由于周围神经对靶结构发挥一定营养支持作用,在神经夹伤后,靶结构在失去支配后会出现肌肉萎缩[9]。腓肠肌湿重比是体现失神经支配腓肠肌萎缩程度的重要指标,通过腓肠肌肌肉湿重比实验数据可知夹伤坐骨神经后,肌肉出现明显的萎缩症状,而两组小鼠之间肌肉湿重比无明显差异,肌肉萎缩程度相类似。
综上所述,B6-St小鼠与C57BL/6小鼠坐骨神经夹伤后周围神经各项功能相似,Brachyury基因突变后对小鼠外周神经的再生作用不明显,但是该基因对脊髓的发育调控尚需要进一步的研究。
参考文献:
[1] Jiang M, Zhuge X, Yang Y, et al. The promotion of peripheral nerve regeneration by chitooligosaccharides in the rat nerve crush injury model[J]. Neurosci Lett, 2009, 454(3):239.
[2] 邵义祥, 陈兵, 张成香, 等. ENU诱导获得一种短尾小鼠及其突变基因的初步定位[J]. 动物学杂志, 2005, 40(1):8-13.
[3] 王生存, 缪进, 刘春, 等. 短尾小鼠脊柱发育形态与病理生理学研究[J]. 交通医学, 2012, 26(6):527-529.
[4] 蒋茂荣, 诸葛晓旻, 丁斐. 壳寡糖促进小鼠坐骨神经再生的实验研究[J]. 苏州大学学报: 医学版, 2010, 30(1):4-6.
[5] Wu B, Shao Y, Chen B, et al. Identification of a novel mouse brachyury (T) allele causing a short tail mutation in mice[J].Cell Biochem Biophys, 2010, 58(3):129-135.
[6] Conlon FL, Smith JC. Interference with Brachyury function inhibits convergent extension, causes apoptosis, and reveals separate requirements in the FGF and activin signalling pathways[J]. Dev Biol, 1999, 213:85-100.
[7] Fekrazad R, Mortezai O, Pedram M, et al. Transected sciatic nerve repair by diode laser protein soldering[J]. J Photochem Photobiol B, 2017, 173:441-447.
[8] Sun X, Zhang Z, Liu N. Absence of split hand in the flail arm variant of ALS[J]. Neurophysiol Clin, 2016, 46(2):149-152.
[9] 邵晨昕, 吴欣, 刘梅, 等. Myostatin在小鼠腓肠肌失神经支配萎缩过程中的表达[J]. 解剖学杂志, 2006, 29(2):146-149.

