补骨脂酚对口腔鳞状细胞癌增殖、迁移和凋亡的影响及其机制
王路明,左艳萍
(1西安医学院第二附属医院口腔科,西安 710038;2西安医学院口腔医学系;*通讯作者,E-mail:wlmxayxy@126.com)
口腔癌是全球第六大常见恶性肿瘤,每年新增病例约1.1万例,其早期淋巴结转移率高[1]。口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是口腔癌最常见的病理类型[2],由于OSCC侵袭性强,对多种化疗药物具有抗药性,5年生存率低于60%[3]。因此,亟需寻找新的有效治疗策略。
补骨脂酚(Bakuchiol,BAK)是一种从补骨脂种子中分离得到的单萜苯酚。研究证实,补骨脂酚具有抑制多种肿瘤细胞增殖和转移的作用,如乳腺癌[4]、胃癌[5]、皮肤癌[6]、肺腺癌[7]等,但补骨脂酚是否能够抑制OSCC的增殖和转移及其具体分子机制尚无相关研究报道。沉默信息调节因子1(silent information regulator 1,SIRT1)是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖性的组蛋白脱乙酰化酶。充分证据显示,激活SIRT1分子能明显抑制口腔鳞状细胞癌的发生发展[8]。近年来研究发现,补骨脂酚可以通过激活SIRT1信号通路缓解缺血再灌注损伤[9]。然而,补骨脂酚是否通过激活SIRT1抑制口腔鳞状细胞癌尚无报道。本研究旨在观察补骨脂酚对口腔鳞状细胞癌细胞增殖、凋亡及迁移能力的影响,并探究SIRT1信号通路是否介导补骨脂酚对OSCC的作用。
1 材料和方法
1.1 主要试剂
补骨脂酚、EX527、DAPI(Sigma公司,美国);抗Bax、Bcl-2、Caspase-3、β-actin抗体(CST公司,美国);抗Ac-FOXO1抗体(Santa Cruz公司,美国);抗SIRT1抗体(Abcam公司,美国);TUNEL试剂盒(Roche公司,瑞士);BCA蛋白定量试剂盒(Pierce公司,美国);CCK-8试剂盒(Dojindo公司,日本)。
1.2 细胞培养
OSCC细胞系购自美国模式培养物集存库(ATCC)。OSCC细胞系培养条件为:10% Gibco胎牛血清的DMEM、5% CO2、37 ℃恒温无菌孵箱。待细胞覆盖培养瓶底面80%时进行消化传代培养。补骨脂酚和EX527均稀释至含0.1%DMSO的无血清DMEM中以备使用。
1.3 实验分组及处理
将OSCC细胞分为4组,正常OSCC细胞(control)组;补骨脂酚处理(BAK)组:补骨脂酚处理OSCC细胞24 h;补骨脂酚+SIRT1抑制剂处理(BAK+EX527)组:EX527(100 μmol/L)预处理OSCC细胞12 h,继而补骨脂酚处理24 h;SIRT1抑制剂处理(EX527)组:EX527(100 μmol/L)预处理OSCC细胞12 h。
1.4 细胞活力测定
参照文献[10]的方法,用CCK-8试剂盒检测EX527和不同浓度BAK(1,2,5,10 μmol/L)对OSCC细胞活力的影响。具体步骤:将细胞接种于96孔板中,无菌培养箱(5%CO2、37 ℃)12 h;用常温的PBS清洗细胞3次,以去除培养液;向培养板内加入100 μl DMEM和10 μl CCK-8溶液;继续培养2 h;用酶标仪检测450 nm处吸光度值。
1.5 细胞凋亡率检测
采用原位末断转移酶标记法(TUNEL法)检测各组细胞的凋亡比例。具体操作为:各组实验处理结束,用预冷的PBS清洗细胞3次,以去除悬浮细胞、杂物和培养液;将细胞置于4%多聚甲醛内固定15 min,4 ℃;脱水石蜡包埋;切片厚度5 μmol/L;每张切片加50 μl TUNEL染液,置于37 ℃避光环境下反应60 min;PBS清洗3次,每次5 min;用DAPI在避光情况下染核10 min;PBS清洗3次,每次5 min;激光共聚焦显微镜拍照。凋亡率=TUNEL染色阳性细胞核/全部细胞核×100%。
1.6 细胞迁移能力检测
将OSCC细胞培养于6孔板中,待细胞基本覆盖6孔板底面后,用同一无菌枪头进行划痕;用无菌的PBS清洗细胞3次,去除划痕处细胞,继而用无血清DMEM处理细胞24 h,拍照;用Image J软件计算划痕处细胞间距。
1.7 细胞Bax、Bcl-2、Caspase-3、SIRT1、Ac-FOXO1蛋白表达测定
各组细胞药物处理后提取细胞蛋白。用BCA蛋白定量试剂盒检测各组样品蛋白浓度。在电泳加样孔内加入等量蛋白质(40 μg),10%Bis/Tris凝胶分离蛋白,并用湿转法将蛋白转移到PVDF膜上。用TBST(150 mmol/L NaCl,50 mmol/L Tris,0.1% Tween-20,pH 7.5)稀释的5%脱脂牛奶封闭PVDF膜2 h,孵育抗SIRT1(1 ∶1 000稀释)、Ac-FOXO1(1 ∶500稀释)、Bcl-2(1 ∶1 000稀释)、Bax(1 ∶1 000稀释)、Caspase-3(1 ∶1 000稀释)和β-actin(1 ∶5 000稀释)抗体,4 ℃过夜;用TBST洗涤3次;室温孵育对应的二抗(1 ∶5 000稀释)1.5 h;用TBST洗涤3次。使用BioRad成像系统检测蛋白质条带并使用Image Lab软件定量。
1.8 统计学分析
2 结果
2.1 补骨脂酚浓度依赖性地抑制OSCC细胞活力
与control组细胞相比,补骨脂酚处理(1,2,5,10 μmol/L)可明显降低OSCC细胞活力,且其作用呈现剂量依赖性。补骨脂酚给药剂量为5 μmol/L时作用最强(见图1)。因此选取该剂量进行下一步的作用及机制研究。
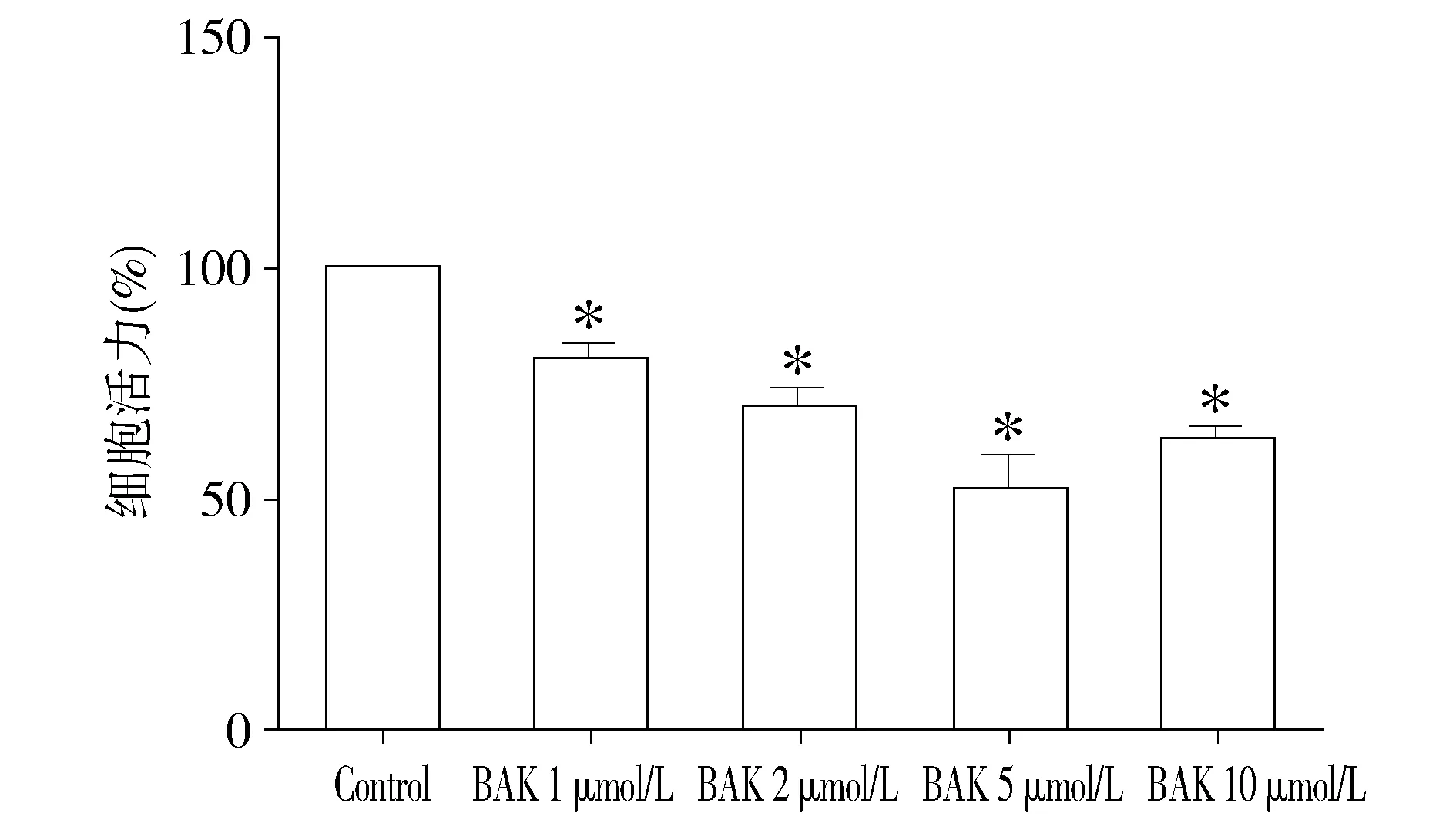
与control组相比,*P<0.05图1 不同剂量补骨脂酚对OSCC细胞活力的影响 (n=6)Figure 1 The effects of different doses of bakuchiol on the cell viability of OSCC cells (n=6)
2.2 补骨脂酚对OSCC细胞SIRT1信号通路的影响
检测各组细胞内SIRT1表达结果表明,补骨脂酚处理组细胞的SIRT1表达水平较正常OSCC细胞明显增高(增高约202.03%),而SIRT1下游分子FOXO1的乙酰化水平(Ac-FOXO1)明显降低(降低约43.12%,P<0.05)。与BAK组相比,BAK+EX527组细胞内SIRT1的表达量明显降低(降低约28.11%),而Ac-FOXO1的表达量明显增高(增高约167.25%,P<0.05,见图2)。
2.3 补骨脂酚和EX527对OSCC细胞增殖和凋亡的影响
TUNEL染色法检测了各组细胞的凋亡情况,各组典型TUNEL染色结果见图3。与control组相比,补骨脂酚处理组OSCC细胞的凋亡率明显增加(P<0.05)。而EX527阻断SIRT1信号通路后细胞凋亡率与BAK组相比明显降低(P<0.05,见图4A)。此外,Western blot检测了凋亡相关蛋白(Bax、Bcl-2、Caspase-3)的表达情况。结果显示,与control组相比,BAK可明显上调OSCC细胞内促凋亡分子Bax和Caspase-3的表达,下调抗凋亡分子Bcl-2的表达(P<0.05)。而与BAK组相比,EX527可明显下调OSCC细胞内促凋亡分子Bax和Caspase-3的表达,上调抗凋亡分子Bcl-2的表达(P<0.05,见图4B-E)。CCK法检测各组细胞的细胞活力,结果显示,BAK可明显抑制OSCC细胞活力(P<0.05)。而与BAK组相比,BAK+EX527组细胞的细胞活力明显增高(P<0.05,见图4F)。

与control组相比,*P<0.05;与BAK组相比,#P<0.05图2 补骨脂酚对OSCC细胞中SIRT1信号通路的影响 (n=6)Figure 2 The effects of bakuchiol on the SIRT1 signaling pathway in OSCC cells (n=6)
2.4 补骨脂酚和EX527对OSCC细胞迁移的影响
通过划痕实验检测了各组细胞的迁移能力。各组细胞划痕实验光镜结果见图5。与control组相比,补骨脂酚处理组OSCC细胞的细胞间距明显增加(P<0.05),即补骨脂酚可以抑制OSCC迁移。而BAK+EX527组细胞间距与BAK组相比明显降低(P<0.05),提示EX527可削弱补骨脂酚抑制OSCC细胞迁移的作用。单纯给予EX527对于细胞迁移能力无明显影响(见图6)。
3 讨论
补骨脂酚是从补骨脂种子中分离得到的单萜苯酚。以往研究发现,补骨脂酚对于多种肿瘤的发生发展有明确的治疗作用。Li等[4]证实,补骨脂酚可以通过诱导细胞S期阻滞和细胞凋亡从而发挥抗乳腺癌的作用。Lin等[5]证实,补骨脂酚可以通过诱导细胞凋亡和G1期阻滞,从而抑制SGC-7901胃癌细胞的增殖。Kim等[6]研究发现,补骨脂酚可以通过调节Hck、Blk和p38 MAPK,进而发挥抗皮肤癌的作用。但是补骨脂酚是否能够抵抗口腔鳞状细胞癌的进展和转归尚无相关报道。本研究首次证实,补骨脂酚能够明显抑制OSCC细胞的增殖和迁移,并诱导其发生凋亡。
SIRT1是一种组蛋白脱乙酰化酶,其活性主要取决于烟酰胺腺嘌呤二核苷酸(NAD+),大量研究证实SIRT1与肿瘤的发生发展密切相关。能量限制可通过提高SIRT1水平抑制结肠癌细胞增殖和肿瘤形成[11]。Buhrmann等[12]发现白藜芦醇可通过靶向激活SIRT1和抑制NF-κB活化抑制结肠癌的发生。紫草素可通过激活FOXO3a/EGR1/SIRT1信号通路,诱发肺癌细胞凋亡,从而抑制肺癌的发生发展[13]。但也有文献报道,激活SIRT1可促进肿瘤的形成。二甲双胍可以通过抑制SIRT1表达来增强化疗药物和氧化应激对癌细胞的杀伤能力[14]。在晚期前列腺癌组织中SIRT1的表达量较早期癌组织明显增高,而过量表达的SIRT1分子对于前列腺癌的进展发挥了重要作用[15]。17β-雌二醇和雌激素受体特异性配体可通过结合雌激素受体上调SIRT1的表达,进而激活EGFR/ERK/c-fos/AP-1信号通路,最终促进乳腺癌细胞的增殖和裸鼠肿瘤细胞移植瘤的形成[16]。过表达SIRT1分子可导致恶性卵巢上皮细胞癌化疗药物抵抗和预后不良[17]。通过总结国内外多项研究发现,SIRT1发挥抗肿瘤作用抑或促肿瘤作用主要决定于肿瘤类型[18]。在OSCC中,充分证据显示,过表达SIRT1可在体外抑制OSCC细胞迁移,并在体内限制其转移。此外,在转移性OSCC细胞中,上调SIRT1可显著抑制其迁移和侵袭能力,同时增加E-钙黏蛋白的表达,降低间充质标记物的表达[8]。本研究证实,补骨脂酚处理可以明显增加肿瘤细胞内SIRT1的表达量,且SIRT1下游分子FOXO1的乙酰化水平明显降低,提示补骨脂酚也可明显增强SIRT1的去乙酰化酶活性。补骨脂酚提高SIRT1分子表达及活性的同时,也增加了OSCC细胞的凋亡率、上调了OSCC细胞中促凋亡分子Bax和Caspase-3的表达量、下调了抗凋亡分子Bcl-2的表达量、以及抑制了肿瘤细胞的迁移。而抑制SIRT1信号通路后,补骨脂酚上述作用明显削弱。

图3 各组OSCC细胞凋亡的TUNEL染色Figure 3 Apoptosis of OSCC cells in each group by TUNEL
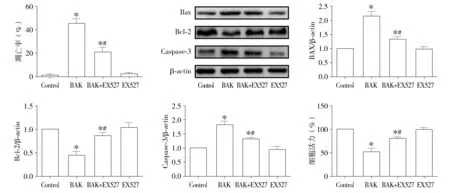
与control组相比,*P<0.05;与BAK组相比,#P<0.05图4 补骨脂酚和EX527对OSCC细胞增殖和凋亡的影响 (n=6)Figure 4 The effects of bakuchiol and EX527 on the apoptosis and proliferation of OSCC cells (n=6)
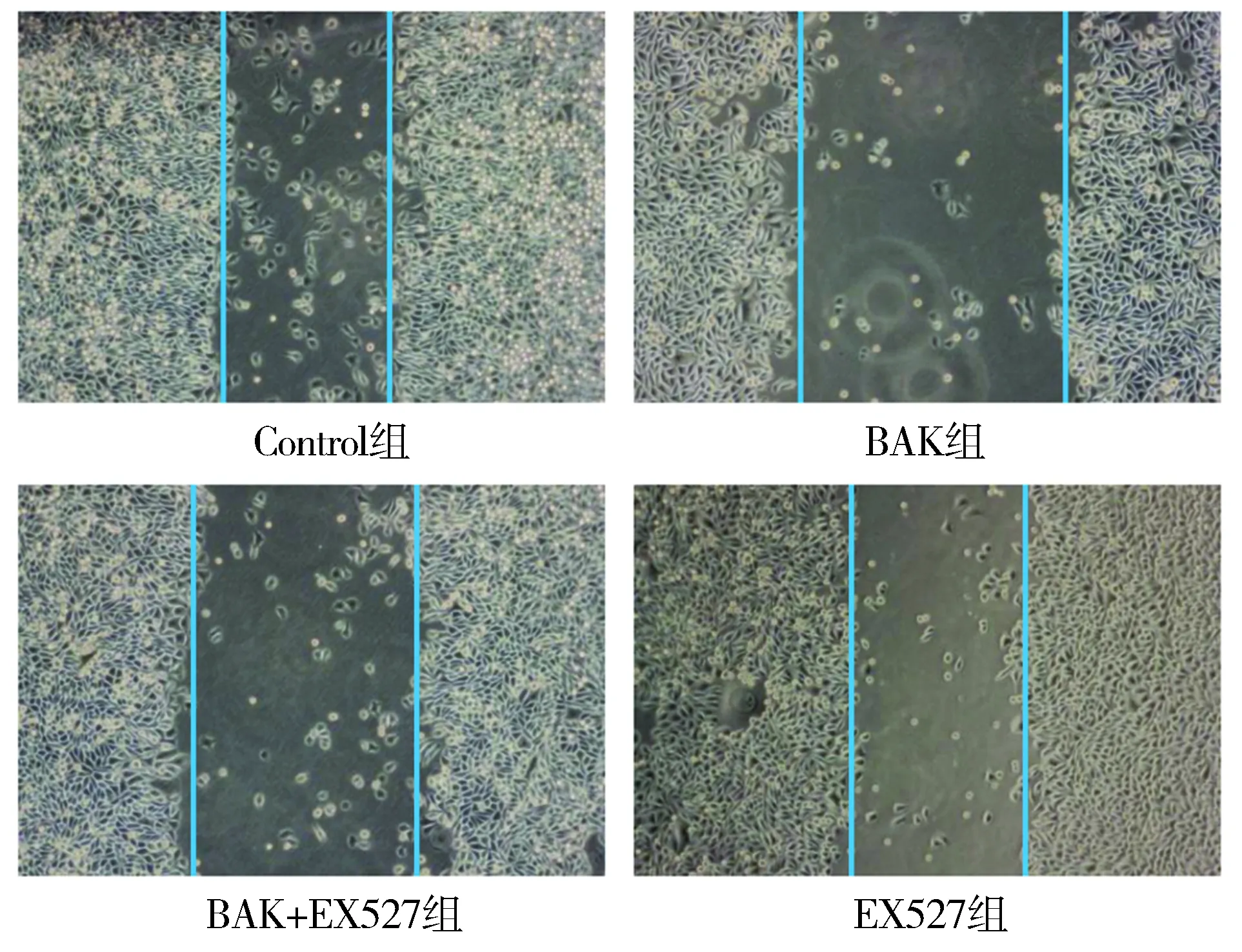
图5 各组OSCC细胞划痕实验结果(光镜×200)Figure 5 Results of the OSCC cell wound healing in each group (×200)
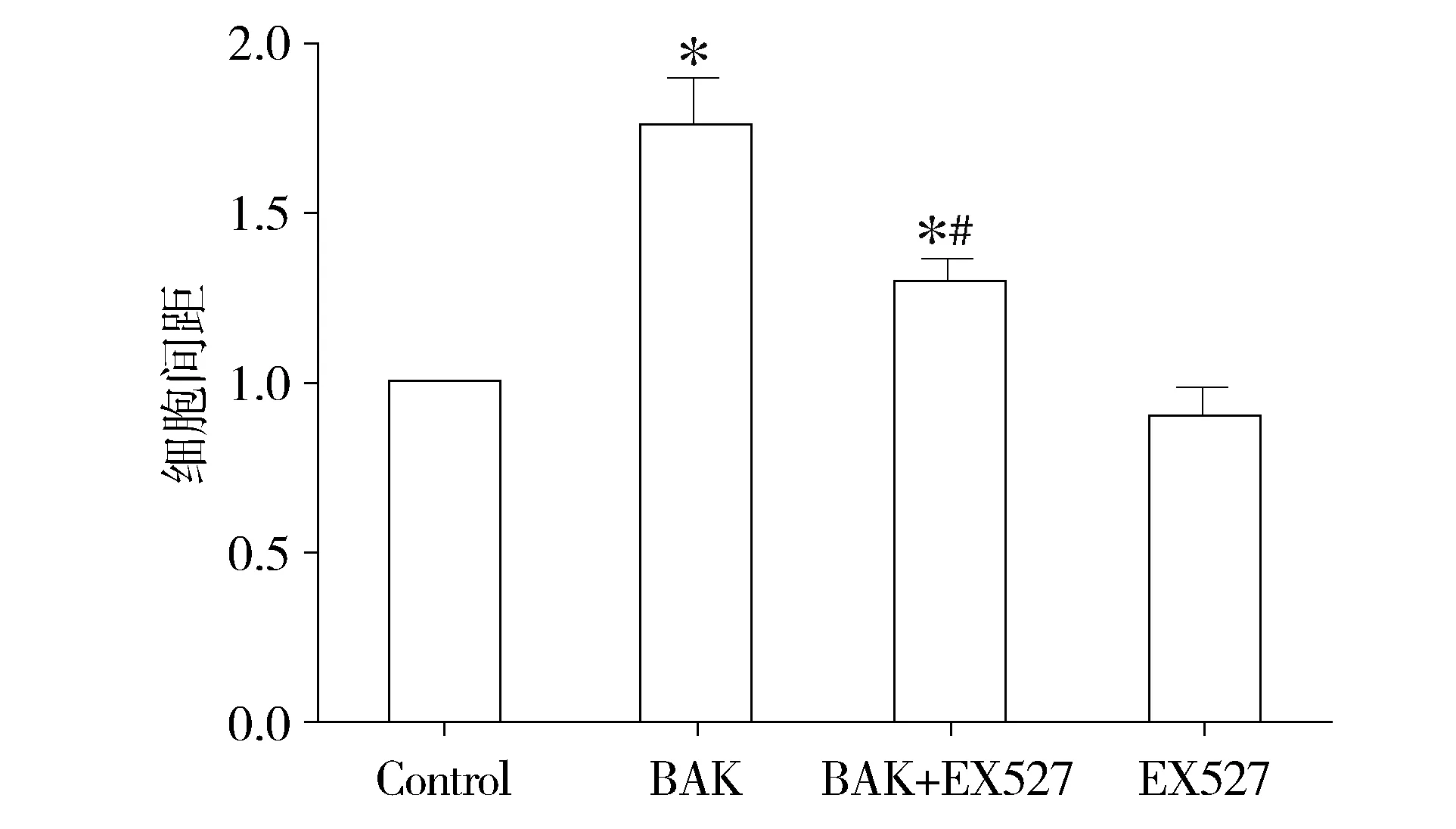
与control组相比,*P<0.05;与BAK组相比,#P<0.05图6 补骨脂酚和EX527对OSCC细胞迁移的影响 (n=6)Figure 6 Effects of bakuchiol and EX527 on the migration of OSCC cells (n=6)
综上所述,本研究首次证实补骨脂酚是抵抗OSCC细胞增殖和迁移的新的有效治疗药物,且其抗肿瘤作用的发挥主要由SIRT1信号通路介导。该研究为临床上应用补骨脂酚治疗OSCC提供了新的理论依据。
参考文献:
[1] Tan WJ, Chia CS, Tan HK,etal. Prognostic significance of invasion depth in oral tongue squamous cell carcinoma[J]. ORL J Otorhinolaryngol Relat Spec, 2012, 74(5):264-270.
[2] Wang Y, Lu HL, Liu YD,etal. Cryptotanshinone sensitizes antitumor effect of paclitaxel on tongue squamous cell carcinoma growth by inhibiting the JAK/STAT3 signaling pathway[J]. Biomed Pharmacother,2017,95:1388-1396.
[3] Bello IO, Soini Y, Salo T. Prognostic evaluation of oral tongue cancer: means, markers and perspectives (I)[J]. Oral Oncol, 2010, 46(9):630-635.
[4] Li L, Chen X, Liu CC,etal. Phytoestrogen bakuchiol exhibits in vitro and in vivo anti-breast cancer effects by inducing S phase arrest and apoptosis[J]. Front Pharmacol, 2016, 7:128.
[5] Lin J, Yao HJ, Li RY. Bakuchiol inhibits cell proliferation and induces apoptosis and cell cycle arrest in SGC-7901 human gastric cancer cells[J]. J Buon, 2016, 21(4):889-894.
[6] Kim JE, Kim JH, Lee Y,etal. Bakuchiol suppresses proliferation of skin cancer cells by directly targeting Hck, Blk, and p38 MAP kinase[J]. Oncotarget, 2016, 7(12):14616-14627.
[7] Chen Z, Jin K, Gao L,etal. Anti-tumor effects of bakuchiol, an analogue of resveratrol, on human lung adenocarcinoma A549 cell line[J]. Eur J Pharmacol, 2010, 643(2-3):170-179.
[8] Chen IC, Chiang WF, Huang HH,etal. Role of SIRT1 in regulation of epithelial-to-mesenchymal transition in oral squamous cell carcinoma metastasis[J]. Mol Cancer, 2014, 13:254.
[9] Feng J, Yang Y, Zhou Y,etal. Bakuchiol attenuates myocardial ischemia reperfusion injury by maintaining mitochondrial function: the role of silent information regulator 1[J]. Apoptosis, 2016, 21(5):532-545.
[10] Zhai M, Li B, Duan W,etal. Melatonin ameliorates myocardial ischemia reperfusion injury through SIRT3-dependent regulation of oxidative stress and apoptosis[J]. J Pineal Res, 2017, 63(2):e12419.
[11] Firestein R, Blander G, Michan S,etal. The SIRT1 deacetylase suppresses intestinal tumorigenesis and colon cancer growth[J]. PLoS One, 2008, 3(4):e2020.
[12] Buhrmann C, Shayan P, Popper B,etal. Sirt1 is required for resveratrol-mediated chemopreventive effects in colorectal cancer cells[J]. Nutrients, 2016, 8(3):145.
[13] Jeung YJ, Kim HG, Ahn J,etal. Shikonin induces apoptosis of lung cancer cells via activation of FOXO3a/EGR1/SIRT1 signaling antagonized by p300[J]. Biochim Biophys Acta, 2016, 1863(11):2584-2593.
[14] Do MT, Kim HG, Choi JH,etal. Metformin induces microRNA-34a to downregulate the Sirt1/Pgc-1alpha/Nrf2 pathway, leading to increased susceptibility of wild-type p53 cancer cells to oxidative stress and therapeutic agents[J]. Free Radic Biol Med, 2014, 74:21-34.
[15] Lovaas JD, Zhu L, Chiao CY,etal. SIRT1 enhances matrix metalloproteinase-2 expression and tumor cell invasion in prostate cancer cells[J]. Prostate, 2013, 73(5):522-530.
[16] Santolla MF, Avino S, Pellegrino M,etal. SIRT1 is involved in oncogenic signaling mediated by GPER in breast cancer[J]. Cell Death Dis, 2015, 6:e1834.
[17] Shuang T, Wang M, Zhou Y,etal. Over-expression of Sirt1 contributes to chemoresistance and indicates poor prognosis in serous epithelial ovarian cancer (EOC)[J]. Med Oncol, 2015, 32(12):260.
[18] Brooks CL, Gu W. How does SIRT1 affect metabolism, senescence and cancer?[J]. Nat Rev Cancer, 2009, 9(2):123-128.

