腌腊肉中优良乳酸菌的筛选鉴定及初步应用
胡美忠,郁建生,*,郁建平
(1.铜仁职业技术学院,贵州铜仁554300;2.贵州梵净山农业高科技股份有限公司,贵州铜仁554300;3.贵州大学生命科学学院,贵州贵阳550025)
发酵肉指原料肉中人工加入有益微生物或者利 用自然存在的有益微生物发酵,在有益微生物的作用下发生复杂的物理化学变化,使肉呈现出独特风味的一类肉制品[1-2],如火腿,香肠、酸鱼、酸肉等肉制品。这些肉制品营养丰富、风味独特、保质期长,是风靡全球的一类肉制品,深受广大消费者的欢迎。
发酵肉中的微生物种类有乳酸菌、葡萄球菌、酵母菌和霉菌[3],大部分乳酸菌是一类公认安全的微生物(generally recognized as safe,GRAS),通常认为乳酸菌具有有助消化、产生人体所需的微生物和生长因子、维持肠道健康、增强免疫等益生性。人类利用乳酸菌来生产发酵食品的历史已经有数千年,如奶酪、酸奶、酸肉、酸菜等,乳酸菌是发酵肉的常见菌种,在发酵肉中乳酸菌能防止发酵肉在发酵成熟过程中病原腐败菌的侵袭、有利于提升发酵肉质地等功效[4-6]。筛选肉制品发酵剂菌株,乳酸菌菌种是一个重要的内容,许多乳酸菌优良菌株从发酵肉中分离出来,如分离自腌肉的Enterococcus sp.18,分离自火腿的Leuconostoc sp.20[7],分离自熏制鲑鱼的 Lactobacillus sakei R1333[8]。本文探讨了从腌腊肉分离纯化鉴定具有优良发酵性能的乳酸菌,初步探讨了乳酸菌发酵制作牛肉干的品质。
1 材料与方法
1.1 材料
1.1.1 样品及培养基
贵州省铜仁市周边不同农户家采用传统方式制备的腌腊肉,共采集5份。
MRS培养基、牛肉干蛋白胨培养基(Nutrient A-gar)、平板计数培养基(plate count agar,PCA):北京奥博星。
1.1.2 主要仪器
ZHJH-C1214C垂直流超净工作台:上海智城分析仪器制造有限公司;TU-1901可见分光光度计:北京普析通用仪器有限责任公司;DELTA 320 p H计:上海闵胜科技有限公司;BPH-9042恒温培养箱:上海一恒科学仪器有限公司;HVE-50全自动高压灭菌锅:华粤集团有限公司。
1.2 方法
1.2.1 样品的采集
无菌样品袋装置腌制腊肉,标记编号,置于4℃冰箱保存待用。
1.2.2 乳酸菌分离
采集的腌制腊肉样品,无菌条件下切成碎片,称取25 g碎片加入225 mL无菌生理盐水,震荡5 min,吸取100 μL样品液涂布于添加了1%碳酸钙的MRS培养基,37℃下培养2 d~3 d,随机挑取形态、大小不一致,有溶钙圈的菌落重新划线培养,重复1次~2次得到纯培养菌落,做革兰氏染色和过氧化氢酶测试,选择革兰氏阳性、过氧化氢酶阳性菌株,采用甘油保藏法置于-70℃冰箱保藏待用(取1 mL纯培养菌液与1 mL 40%~50%甘油均匀混合于2 mL无菌螺纹管中)。
1.2.3 乳酸菌发酵性能筛选
1.2.3.1 24 h产酸能力测试
筛选得到的乳酸菌菌株活化,得种子液,种子液按1%比例接种于100 mL MRS培养基,37℃静置培养24 h后测定各菌株菌液的pH值(重复3次,取平均值)。
1.2.3.2 15℃下生长能力测试
筛选得到的乳酸菌菌株活化,得种子液,种子液按1%比例接种于100 mL MRS培养基,15℃静置培养48 h后,以空白MRS培养基为对照,测定各菌株菌液的OD600(重复3次,取平均值)。
1.2.3.3 6.5%氯化钠耐受能力测试
筛选得到的乳酸菌菌株活化,得种子液,种子液按1%比例接种于100 mL添加了6.5%氯化钠的MRS培养基,37℃静置培养24 h后,以空白MRS培养基为对照,测定各菌株菌液的OD600(重复3次,取平均值)。
1.2.3.4 150 mg/L亚硝酸钠耐受能力测试
筛选得到的乳酸菌菌株活化,得种子液,种子液按1%比例接种于100 mL添加了150 mg/L亚硝酸钠的MRS培养基,37℃静置培养24 h后,以空白MRS培养基为对照,分别测定各菌株菌液的OD600(重复3次,取平均值)。
1.2.3.5 发酵葡萄糖产气能力测试
含0.8%琼脂的MRS培养基,装入无菌试管,用对数期的菌种穿刺接种,再在上倾倒2 cm 2%琼脂封住,37℃培养48 h,观察产生气泡情况(试管内出现气泡或者顶起2%的琼脂,说明产气)。
1.2.3.6 产黏液能力测试
筛选得到的乳酸菌菌株划线培养于MRS培养基,37℃静置培养48 h后,用接种环挑取菌落观察是否出现黏液。
1.2.3.7 产蛋白酶能力测试
蛋白酶活性测定方法使用琼脂板法[9]。筛选得到的乳酸菌菌株划线培养于MRS培养基,37℃静置培养48 h活化,活化的菌落转接种于含有10%脱脂牛奶的MRS培养基,37℃静置培养72 h后观察菌落周围是否出现蛋白水解圈。
1.2.3.8 产脂肪酶能力测试
筛选得到的乳酸菌菌株划线培养于MRS培养基,37℃静置培养48 h活化,活化的菌落转接种于含有1%三丁酸甘油酯的MRS培养基,37℃静置培养72 h后观察菌落周围是否出现脂肪水解圈。
1.2.4 乳酸菌产广谱抑菌能力细菌素的筛选
筛选得到的乳酸菌菌株活化后接种于MRS培养基,37℃下静置培养10 h得种子液,种子液按1%比例接种于100 mL MRS培养基,37℃下静置培养24 h后,菌液6 000 g离心10 min,得上清液,以金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)为指示菌,采用琼脂扩散法测试上清液抑菌活性[10]。具体做法为:指示菌使用NA培养基活化,制备出OD≈1的指示菌菌液,NA固体培养基融化待其温度降至40℃左右后(手持装置NA培养基的瓶子不烫手),按1%比例加入指示菌菌液,混匀,倒平板,待平板凝固,上面放置牛津杯或者打孔器打孔,孔中加入60 μL乳酸菌发酵上清液,37℃下静置培养18 h~24 h,测量抑菌圈直径。检测乳酸菌是否产生广谱抗菌作用细菌素方法流程为:100 mL乳酸菌发酵上清液,冻干,用20 mL无菌水溶解后分成3份样品,样品1用3 mol/L氢氧化钠和乳酸调节pH值至5.5,样品2加入0.5 mL过氧化氢酶(2.5 kU/mL~5 kU/mL)后37℃水浴2 h,样品3作为对照,以金黄色葡萄球菌(ATCC 25923)和细菌大肠杆菌(ATCC 25922)为指示菌,采用琼脂扩散法测试3份样品的抑菌活性,以检测是否发酵液中是否含有广谱抗菌作用细菌素。
1.2.5 乳酸菌的种属鉴定
1.2.5.1 生理生化鉴定
经过筛选,得到1株具有应用于肉制品发酵潜力的菌株,编号为R3-1。根据《伯杰氏系统细菌学手册》[11]和凌代文的《乳酸菌细菌分类鉴定及实验方法》,对R3-1进行生理生化鉴定。
菌株R3-1菌株划线接种于MRS培养基,37℃培养48 h,观察菌落形态、颜色和表面光滑等。菌株R3-1 MRS培养基活化至OD600≈1,取100 μ菌液,加入乳酸菌生化鉴定管(海博,青岛,中国)中,37℃静置培养24 h~48 h观察结果。
1.2.5.2 分子生物学鉴定
菌株R3-1总DNA提取,16S rDNA扩增和测序由金唯智生物科技有限公司完成,测序所得的16S rDNA序列校对后,与NCBI的 GenBank(http://www.ncbi.nlm.nih.gov/BLAST)数据库或者 http://www.ezbiocloud.net进行BLAST分析,根据序列同源性,确定菌株的种属关系确定菌株的种属关系。
1.2.6 植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(s.xylosus)P2关系考察
在从铜仁腌腊肉寻找肉品发酵剂菌株的过程中,除了筛选到优良的植物乳杆菌(Lb.Plantarum)R3-1外,还得到一株具有优良发酵性能木糖葡萄球菌(s.xylosus)P2(数据未列出),两者有可能组成复合肉品发酵剂。在研究的过程中同时发现植物乳杆菌(Lb.Plantarum)R3-1产广谱抑菌作用的细菌素,故考察植物乳杆菌(Lb.Plantarum)R3-1是否对木糖葡萄球菌(s.xylosus)P2有拮抗作用是两者是否能成为复合肉品发酵剂的关键。试验植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(s.xylosus)P2关系采用十字交叉法,植物乳杆菌(Lb.Plantarum)R3-1在PCA培养基上划直线培养,同时,木糖葡萄球菌(s.xylosus)P2划直线培养并与植物乳杆菌(Lb.Plantarum)R3-1线交叉形成十字交叉,37℃培养36 h后观察交叉处是否出现拮抗作用。
1.2.7 复合发酵剂发酵牛肉干初步研究
植物乳杆菌(Lb.Plantarum)R3-1和木糖葡萄球菌(s.xylosus)P2培养后,4℃下6 000 g离心5 min,收集菌体,适量无菌生理盐水悬浮(OD600≈1)。选择上好牛肉切片,煮熟沥干后,1%葡萄糖,5%氯化钠,2%蔗糖和0.1‰硝酸钠腌制4℃牛肉片24 h,植物乳杆菌(Lb.Plantarum)R3-1和木糖葡萄球菌(s.xylosus)P2按体积比1∶1比例混合制作混合发酵剂(109cfu/mL),按牛肉重量10%比例接种复合发酵剂,15℃下发酵120 h后,按1%酱油,1.5%胡椒粉,1%鲜姜,0.01%白胡椒粉,0.05%料酒加入发酵好的牛肉,搅拌均匀后风干(或60℃~70℃烘干),得发酵牛肉干成品。以不加菌和只加乳酸菌同样制作的牛肉干为对照,发酵牛肉干成品请15位人员品尝,采用9分制从颜色、风味、质地、味道和总体接受度打分,比较复合发酵剂的优劣。
2 结果与分析
2.1 乳酸菌的分离纯化
从贵州铜仁采集的5份腌腊肉样品中,共得到26株革兰氏阳性、过氧化酶阴性的乳酸菌菌株。MRS培养基是一种半选择性培养基,可以用来选择性分离乳酸菌。经过MRS筛选得到的菌株,再经过革兰染色和过氧化氢酶鉴定,基本上可以假定为乳酸菌(乳酸菌是革兰氏阳性,过氧化氢酶阴性菌)。
乳酸菌在发酵食品如酸菜、奶酪等发酵食品中丰度很高,不同发酵食品其生境不一样,从而不同的发酵食品所含有的乳酸菌种类及生化性质不同。工业用乳酸菌菌种,为了使其适应工业生产的目标发酵环境,从相应的发酵产品中分离筛选是捷径。故分离筛选用作发酵肉制品发酵剂的乳酸菌菌株,其分离第一来源应是发酵肉制品,比如腌肉、火腿、香肠等。
2.2 乳酸菌的发酵性能筛选
2.2.1 24 h产酸能力测定结果
乳酸菌在24 h产酸能力是衡量乳酸菌菌株品质优劣的一个重要指标,产酸能力越强,说明菌株性能越佳。分离得到的26株乳酸菌菌株产酸能力见图1。

图1 乳酸菌MRS培养基中24 h产酸能力Fig.1 Acid-producing ability of LAB incubated in MRS broth after 24 h
由图1可知,分别用MRS培养基培养24 h后,绝大部分菌株的产酸能力都强,61.5%的菌株能够使培养基的pH值从6.2下降到3.8甚至更低,少部分菌种的培养基pH值从6.2下降至4.1左右,也有3株乳酸菌菌株产酸能力较弱,其培养基的pH值从6.2下降到4.5左右。
2.2.2 15℃生长能力、耐盐能力及耐亚硝酸钠能力测试结果
分离的乳酸菌15℃生长能力、耐盐能力及耐亚硝酸钠能力见图2。

图2 乳酸菌15℃生长能力、耐氯化钠能力及耐亚硝酸钠能力Fig.2 Tolerance to sodium chloride,sodium nitrite and growth conditions at 15℃of LAB
由图2可知,菌株R3-1、R1-1等9株菌在15℃下生长良好,37℃培养48 h后,培养基OD600值超过1,占比42.3%。在6.5%氯化钠耐受试验中,46.2%的乳酸菌菌株在6.5%氯化钠条件下生长良好,37℃培养24 h,培养基OD600可达到1.5甚至更高,其余乳酸菌菌株的生长则受到氯化钠不同抑制。耐亚硝酸钠试验中,只有菌株R1-5显示不耐受150 mg/L的亚硝酸钠,其他乳酸菌菌株在此浓度的亚硝酸钠下均能良好生长。
2.2.3 产黏液、发酵葡萄糖产气、蛋白酶活性及脂肪酶活性结果
产黏液、发酵葡萄糖产气、蛋白酶活性及脂肪酶活性结果见表1。
由表1可知,菌株R3、R23、R12产生黏液,占比为11.3%,发酵葡萄糖产气试验表明菌株R3-2、R4-5、R4-1、R2-6能够发酵葡萄糖产气,占比为15.4%。菌株 R3-1、R1-1、R3、R2-6、R2-表现出蛋白酶活性,占比为19.2%。脂肪酶测试则表明这26株菌均无脂肪酶活性。
在发酵食品中,产酸量对于控制病原性腐败菌和发酵食品口味至关重要[12],但不同种属的乳酸菌产酸能力不同,为了筛选得到产酸能力强的乳酸菌菌株用作发酵剂,24 h产酸能力是一个重要指标,通常用培养基pH降低程度来衡量。
发酵肉发酵成熟时,其环境对细菌来说不友善,通常处于15℃低温,这个温度很多细菌不能生长或者生长缓慢,这些比较极端的环境会抑制大部分细菌的生长繁殖,而作为肉制品工业用发酵剂的菌株则需要在这种环境下迅速生长繁殖,故寻找肉制品乳酸菌发酵剂菌株,需要筛选其对极端环境的耐受能力[13]。
乳酸菌有两种代谢类型,同型发酵和异型发酵。乳酸菌通过同型发酵可以把1分子葡萄糖全部转变为2分子乳酸,如果通过异型发酵,葡萄糖不会全部被转换为乳酸,还会被转换成醋酸、CO2等其他物质。异型发酵会产生气体,会破坏产品质地对产品不利[14],故作为乳酸菌发酵剂菌株,要求其代谢途径为同型发酵,不能发酵葡萄糖产气。
部分乳酸菌代谢过程中会产生黏液,而黏液对肉制品来说会危害质地、颜色甚至口味,对于乳酸菌发酵剂菌株来说,代谢过程不能产生黏液[14]。
少部分乳酸菌能产生蛋白酶,绝大多数乳酸菌没有脂肪酶活性[15]。发酵肉中,乳酸菌的主要贡献是产生有机酸来增加肉制品安全和质地,对于发酵肉风味的贡献几乎可忽略不计。故乳酸菌的蛋白酶和脂肪酶活性不是筛选乳酸菌肉制品发酵剂的重要指标。
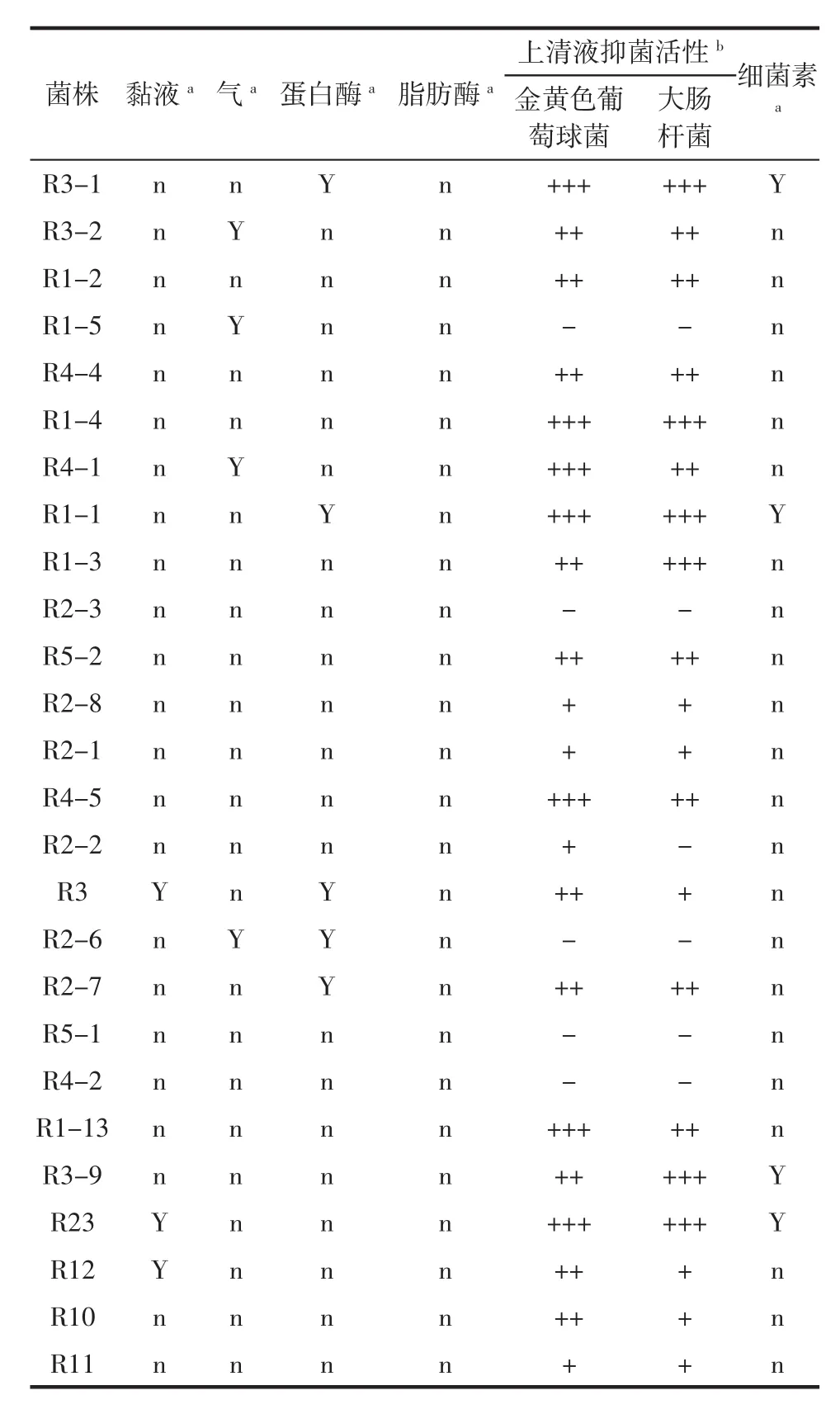
表1 乳酸菌发酵特性Table 1 The fermentation property of LAB
2.3 乳酸菌产广谱抑菌能力细菌素的筛选
乳酸菌作为肉制品发酵剂菌株,乳酸菌主要起到降低pH值,抑制病原微生物的作用,故其培养液的广谱抑菌能力对于乳酸菌发酵剂来说很重要。乳酸菌产生的抑菌物质有很多,比如说有机酸、过氧化氢、细菌素等[7,16]。故测试乳酸菌的抑菌活性及是否产生广谱抗菌作用细菌素对乳酸菌发酵剂来说具有很高的价值。试验结果见表1,由表1可知,在筛选得到的26株乳酸菌中,菌株 R1-5、R2-3、R2-6、R5-1、R4-2 的发酵液对指示菌没有抑制活性,占比为19.2%,其他菌株表现对指示菌不同的抑菌活性。在排除酸抑制、过氧化氢抑制后,只有菌株 R3-1、R1-1、R3-9、R23 表现出产广谱抑菌作用的细菌素,其他则无。
细菌素是由细菌核糖体代谢产生的一种多肽物质,一般来说,对亲缘关系近的菌有抑制作用,但是也有少部分细菌素具有广谱抑菌作用[17-18]。大部分乳酸菌能产生细菌素,少部分乳酸菌能产生具有广谱抑菌作用的细菌素,这部分乳酸菌及其产生的细菌素在发酵食品的防腐中具有重要的作用,能在很大程度上延长食品的货架期,而且细菌素来源于乳酸菌,大部分乳酸菌是公认安全的菌,来源安全。故乳酸菌发酵剂菌株,能产生广谱抗菌作用细菌素的菌株是最佳的,能够延长货架期。
2.4 植物乳杆菌R3-1种属鉴定
2.4.1 生理生化鉴定
菌株R3-1 MRS培养基上为乳白色菌落,培养72 h菌落直径3 mm左右,表面光滑,革兰氏阳性,过氧化氢酶阴性。
乳酸菌生化鉴定试剂盒表明,菌株R3-1能利用纤维二糖、七叶苷、麦芽糖、甘露醇、水杨苷、山梨糖醇、蔗糖、棉子糖、菊粉、乳糖和1%马尿酸。对照《乳酸细菌分类鉴定及实验方法》[19],显示菌株R3-1最可能为植物乳杆菌。
2.4.2 分子生物学鉴定
通过细菌基因组提取试剂盒提取菌株R3-1、R1-1总DNA。利用16s rDNA通用引物进行PCR扩增,得到约1.5 kb的PCR扩增产物,由北京金唯智生物科技有限公司测序,测得所得到的16S rDNA基因序列,在www.ncbi.nlm.nlh.gov网站中使用BLAST在基因库中进行同源性搜索,所得结果中表明菌株R3-1与植物乳杆菌Lactobacillus plantarum strain TMW 1.1623(complete genome) (accession number:CP017379.1),Lactobacillus plantarum strain LP2(complete genome)(accession number: CP020816.1),Lactobacillus plantarum strain CLP0611 (complete genome)(accession number:CP019722.1)相似度100%,结合生理生化试验以及16S rDNA同源性比较结果,鉴定R3-1植物乳杆菌(Lb.Plantarum)。
2.5 植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(S.xylosus)P2 关系
十字交叉法试验证明在交叉处植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(S.xylosus)P2的菌落线生长正常,没有出现抑制现象,各自菌落线与非交叉处没有区别,表明植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(S.xylosus)P2之间不存在拮抗作用,二者可以作为复合发酵剂用作肉品发酵。
在发酵肉制品生产过程中,植物乳杆菌通常和木糖葡萄球菌联合使用[20],然而,在研究中发现植物乳杆菌(Lb.Plantarum)R3-1能产生抑制金黄色葡萄球菌(革兰阳性代表)和大肠杆菌(革兰阴性代表)的细菌素,所以植物乳杆菌(Lb.Plantarum)R3-1是否对木糖葡萄球菌(S.xylosus)P2有拮抗作用是两者能否作为复合发酵剂的关键。试验证明两者可以作为复合发酵剂,可能是因为植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(S.xylosus)P2都分离自同来源的传统腌腊肉,它们之间已经相互适应,可以作为复合发酵剂菌种。
2.6 复合发酵剂发酵牛肉干初步研究
发酵牛肉干试验结果显示,植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(S.xylosus)P2按照体积比1∶1比例组成的复合发酵剂,在牛肉干成品颜色、气味,质地,口味和总体接受度方面比单独使用植物乳杆菌(Lb.Plantarum)R3-1或者不使用发酵剂有显著改善(p<0.05)见表 2。

表2 发酵牛肉干评估Table 2 Sensory evaluation of beef jerky
在发酵肉制品中,乳酸菌的主要贡献为降低pH值,抑制病原腐败菌,改善产品质地延长货架期,而凝固酶阴性的葡萄球菌主要贡献为风味和成品颜色[21]。他们通常组成复合发酵剂在肉制品发酵生产中使用,试验植物乳杆菌(Lb.Plantarum)R3-1与木糖葡萄球菌(S.xylosus)P2表明两者联合使用是一种优秀的复合发酵剂,具有应用于肉品发酵的潜力。
3 结论
从5份腌腊肉中分离得到26株乳酸菌,经过发酵性能筛选,得到一株发酵性能优良,具有应用于肉品乳酸菌发酵剂菌株R3-1,经过生理生化和16S rDNA鉴定为植物乳杆菌(Lb.Plantarum)。植物乳杆菌(Lb.Plantarum)R3-1产酸能力强,耐低温、耐高盐、耐高浓度亚硝酸盐、不产气不产黏液,产广谱抑菌作用细菌素,且对同分离来源的木糖葡萄球菌(S.xylosus)P2没有拮抗作用,两者联合发酵牛肉干试验表明,相对于单独使用植物乳杆菌(Lb.Plantarum)R3-1发酵剂或者不使用发酵剂,两者复合的发酵剂制作的牛肉干成品,在颜色、气味、质地、口感和总体接受度上都有显著改善,表明植物乳杆菌(Lb.Plantarum)R3-1有作为肉制品乳酸菌发酵剂菌株的潜力。
参考文献:
[1]李轻舟,王红育.发酵肉制品研究现状及展望[J].食品科学,2011,32(3):247-251
[2]刘宗敏.发酵肉制品研究现状及发展趋势[J].山东食品发酵,2014(1):50-52
[3]TALON R,LEROY S,LEBERT I.Microbial ecosystems of traditional fermented meat products:The importance of indigenous starters[J].Meat Science,2007,77(1):55-62
[4]BLAIOTTA G,PENNACCHIA C,VILLANI F,et al.Diversity and dynamics of communities of coagulase-negative staphylococci in traditional fermented sausages[J].Journal of Applied Microbiology,2004,97(2):271-284
[5]COTON E,DESMONTS M H,LEROY S,et al.Biodiversity of coagulase-negative Staphylococci in French cheeses,dry fermented sausages,processing environments and clinical samples[J].International Journal of Food Microbiology,2010,137(2/3):221-229
[6]MAINAR M S,STAVROPOULOU D A,LEROY F.Exploring the metabolic heterogeneity of coagulase-negative staphylococci to improve the quality and safety of fermented meats:a review[J].International Journal of Food Microbiology,2016,247(17):24-37
[7]MARTINIS E C P D,FREITAS F Z.Screening of lactic acid bacteria from Brazilian meats for bacteriocin formation[J].FoodControl,2003,14(3):197-200
[8]TODOROV S D,RACHMAN C,FOURRIER A,et al.Characterization of a bacteriocin produced by Lactobacillus sakei R1333 isolated from smoked salmon[J].Anaerobe,2011,17(1):23-31
[9]ESSID I,MEDINI M,HASSOUNA M.Technological and safety properties of Lactobacillus plantarum strains isolated from a Tunisian traditional salted meat[J].Meat Science,2009,81(1):203-208
[10]JAGADEESWARI S,VIDYA P,KUMAR D M,et al.Isolation and characterization of bacteriocin producing Lactobacillus sp.from traditional fermented foods[J].Electronic Journal of Environmental,A-gricultural and Food Chemistry,2010,9(3):575-581
[11]SNEATH P H,MAIR N S,SHARPE M E,et al.Bergey's manual of systematicbacteriology.Volume2[M].Maryland:Williams&Wilkins,1986
[12]PETRUS.Physicochemical characteristics,microbial quality and organoleptic acceptability of Indonesian traditional fermented fresh water fish(Anabas testudineus Bloch)prepared using different concentrations of salt and lime(Citrus aurantifolia swingle)juice[J].International Journal of Biosciences,2015,6(8):157-170
[13]Cocconcelli P S,Fontana C.Characteristics and Applications of Microbial Starters in Meat Fermentations[M].New York:Springer,2008:129-148
[14]BUCKENH SKES H J.Selection criteria for lactic acid bacteria to be used as starter cultures for various food commodities[J].Fems Microbiology Reviews,2010,12(1/3):253-271
[15]DROSINOS E H,PARAMITHIOTIS S,KOLOVOS G,et al.Phenotypic and technological diversity of lactic acid bacteria and staphylococci isolated from traditionally fermented sausages in Southern Greece[J].Food Microbiology,2007,24(3):260-270
[16]DHEWA T.Screening,Production Purification and Potential Use of Bacteriocins From Lactic Acid Bacteria of Meat and Dairy Food Origin[J].International Proceedings of Chemical Biological&Environmenta,2012,39:35-41
[17]SVETOCH E A,ERUSLANOV B V,PERELYGIN V V.Inducer Bacteria,Unique Signal Peptides,and Low-Nutrient Media Stimulate in Vitro Bacteriocin Production by Lactobacillus Spp.and Enterococcus Spp.Strains[J].Journal of Agricultural&Food Chemistry,2010,58(10):6033-6038
[18]MALDONADOBARRAG N A,CABALLEROGUERRERO B,LUCENAPADR S H,et al.Induction of bacteriocin production by coculture is widespread among plantaricin-producing Lactobacillus plantarum strains with different regulatory operons[J].Food Microbiology,2013,33(1):40-47
[19]凌代文,东秀珠.乳酸菌细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999
[20]GRECO M,MAZZETTE R,EPL D S,et al.Evolution and identification of lactic acid bacteria isolated during the ripening of Sardinian sausages[J].Meat science,2005,69(4):733-739
[21]LI P,KONG B,CHEN Q,et al.Formation and identification of nitrosylmyoglobin by Staphylococcus xylosus in raw meat batters:A potential solution for nitrite substitution in meat products[J].Meat Science,2013,93(1):67-72

