PGR与血清肿瘤标记物联合检测在胃癌诊断的临床意义
杨朝美,杨晏
(重庆市第四人民医院 检验科,重庆400014)
胃癌的发生主要考虑与胃黏膜上皮细胞的持续性恶性病变有关,流行病学研究[1]显示,胃癌的发病率可达233~455/10万例左右。长期的临床随访研究显示,胃癌的5年生存率不足35%,中位生存时间不足32个月[2-3]。胃癌的早期诊断对于疾病的治疗具有重要的临床意义,其能够指导临床上胃癌的早期根治性手术,进而改善患者的生存预后。血清学指标的筛查在恶性肿瘤筛查过程中具有重要价值,其检测方便、患者经济负担低、动态随访价值高。I型胃蛋白酶原/胃型胃蛋白酶原比值(PG蛋白酶原比,PGR)是反应幽门腺腺体细胞、胃底部主细胞等腺体细胞功能状体、萎缩及病变的重要参考指标,在恶性肿瘤等异常病变过程中,相关指标可发生显著的变化[4];CEA、CA19-9等广谱肿瘤细胞糖蛋白标志物,在癌细胞的异常增殖过程中可以显著释放,促进循环血中CEA、CA19-9等物质的上调,并可以增加消化道肿瘤细胞的反馈性增殖速度的加快[5]对于相关指标的研究能够为指导胃癌的早期高危筛查提供依据,并能够为胃癌患者的临床预后的随访提供参考。为了进一步评估不同的指标在早期筛查胃癌过程中的价值,选取经胃镜取活组织病理学检查确诊的90例胃癌临床资料,探讨相关指标的高表达趋势及其血清学联合诊断价值,报告如下。
1 资料与方法
1.1 一般资料
选取经胃镜取活组织病理学检查确诊的胃癌90例(胃癌组)和健康自愿者90例(对照组),收集时间2017年1月—2017年6月。
⑴ 胃癌组:男48例,女42例;年龄39~77岁,平均(53.4±13.8)岁;体质量指数(BMI)(23.1±2.4)kg/m2;TNM分期:I期41例,II期28例,III期21例;⑵ 对照组:男51例,女39例;年龄41~72岁,平均(55.0±10.6)岁;BMI(22.9±2.1) kg/m2。两组患者的年龄、性别、BMI比较,差异均无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴ 胃癌的诊断标准参考中华医学会胃癌规范化诊治指南2012年版(试行)[6];⑵ 患者年龄19~79岁;⑶ 患者术前经胃镜或者超声胃镜 检查,并经活组织病理学检查确诊为胃癌;⑷ 对照组来源与我院体检中心的健康自愿者;⑸ 患者的各项基础资料完整。
1.2.2 排除标准 ⑴ 胰腺癌、胆管癌等肿瘤疾病患者;⑵ 肝肾功能疾病;⑶ 伴有感染性疾病;⑷ 伴有自身免疫性疾病;⑸ 肠穿孔、肠梗阻患者。
1.3 指标检测方法
在患者入院后的6~8 h内采集空腹静脉血约5 mL并分作2份,1份自然抗凝后以3 000r/min离心10 min,取上清液采用酶联免疫吸附法测定血清中CEA、CA19-9水平,检测试剂盒购自北京中杉金桥生物有限公司,具体检测步骤严格按照试剂盒说明书进行操作;另1份置于枸橼酸钠抗凝管内,加入PGI、PGII检测试剂盒后,利用胶体金法检测PGI、PGII水平,试剂盒购自上海奥普生物医药有限公司,具体检测步骤严格按照试剂盒说明书进行。
1.4 统计学处理
采用SPSS 16.0统计软件,采用均数±标准差(±s)进行统计描述,组间比较采用两组独立样本t检验,绘制ROC曲线并计算对应临界值下的特异度、灵敏度、误诊率、漏诊率;P<0.05表示差异具有统计学意义。
2 结 果
2.1 两组血清PGR、CEA、CA19-9、PGI、PGII水平比较
胃癌组患者的血清PGR、CEA、CA19-9、PGII水平均显著的高于对照组(P<0.05),胃癌组患者血清PGI水平低于对照组(P<0.05)(表1)。
表1 两组血清PGR、CEA、CA19-9水平比较(±s)

表1 两组血清PGR、CEA、CA19-9水平比较(±s)
组别 n CEA(ng/mL) CA19-9(IU/mL) PGI(μg/L) PGII(μg/L) PGR胃癌组 90 31.9±24.7 48.4±20.5 77.8±21.7 29.6±12.0 2.63±1.09对照组 90 2.8±1.6 7.3±2.9 103.4±34.9 13.5±9.4 7.66±2.14 t 11.153 18.832 5.91 10.02 19.87 P<0.001 <0.001 <0.001 <0.001 <0.001
2.2 不同TNM分期患者血清PGR、CEA、CA19-9水平比较
不同TNM分期的胃癌组患者的血清PGR、CEA、CA19-9、PGI、PGII水平组间比较,差异均有统计学意义(P<0.05)(表2)。
表2 不同TNM分期 患者血清PGR、CEA、CA19-9水平比较(±s)

表2 不同TNM分期 患者血清PGR、CEA、CA19-9水平比较(±s)
TNM分期 n CEA(ng/mL) CA19-9(IU/mL) PGI(μg/L) PGII(μg/L) PGR I期 41 24.5±14.0 39.1±18.4 89.4±18.3 21.3±9.7 4.20±1.04 II期 28 32.1±17.7 46.8±17.3 79.0±20.0 27.4±9.5 2.88±1.01 III期 21 38.7±20.0 66.9±19.0 46.1±19.5 38.1±11.4 1.21±0.87 F 32.084 41.967 38.817 35.092 63.309 P<0.001 <0.001 <0.001 <0.001 <0.001
2.3 病理学特征的胃癌患者的血清PGR、CEA、CA19-9水平比较
T3+T4浸润型胃癌患者的血清CEA、CA19-9水平显著的高于T1+T2期浸润型患者和局限型患者(P<0.05),PGR则显著的低于T1+T2期浸润型患者和局限型患者(P<0.05);T1+T2期浸润型胃癌患者的PGR、CEA、CA19-9、 PGI、PGII水平与局限型患者比较,差异均无统计学意义(P>0.05)(表3)。
表3 病理学特征的胃癌患者的血清PGR、CEA、CA19-9水平比较(±s)
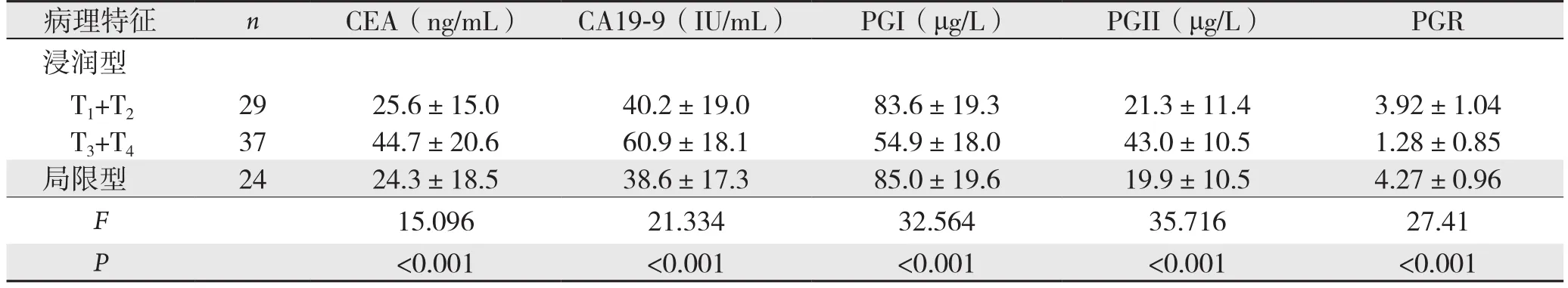
表3 病理学特征的胃癌患者的血清PGR、CEA、CA19-9水平比较(±s)
病理特征 n CEA(ng/mL) CA19-9(IU/mL) PGI(μg/L) PGII(μg/L) PGR浸润型T1+T2 29 25.6±15.0 40.2±19.0 83.6±19.3 21.3±11.4 3.92±1.04 T3+T4 37 44.7±20.6 60.9±18.1 54.9±18.0 43.0±10.5 1.28±0.85局限型 24 24.3±18.5 38.6±17.3 85.0±19.6 19.9±10.5 4.27±0.96 F 15.096 21.334 32.564 35.716 27.41 P<0.001 <0.001 <0.001 <0.001 <0.001
2.4 血清PGR、CEA、CA19-9联合检测对于鉴别诊断胃癌的临床价值
血清PGR、CEA、CA19-9联合检测诊断胃癌的灵敏度为95.20%、特异度为88.41%、漏诊率为4.80%、误诊率为11.59%、AUC值为0.902(P<0.05)(表4)(图1)。
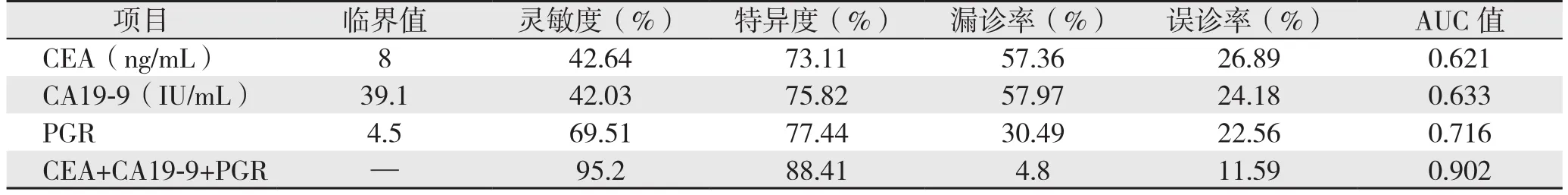
表4 血清PGR、CEA、CA19-9联合检测对于鉴别诊断胃癌的临床价值

图1 血清PGR、CEA、CA19-9联合检测对于鉴别诊断胃癌的ROC曲线图
3 讨 论
胃癌长期临床治疗随访研究显示,疾病的早期诊断在胃癌的整体治疗预后过程中发挥了重要的作用,早期诊断水平的提高,能够提高5%左右的肿瘤病灶完全切除率,为15%以上的胃癌患者提供早期手术的可能[6]。同时对于胃癌发病过程中相关分子生物学机制的研究,不仅可以为临床上胃癌的诊断提供参考,同时可以为胃癌患者治疗后、出院后等高危人群的随访提供参考依据。
CEA主要表达于婴幼儿部分神经组织、平滑肌组织或者其他中胚层组织中,在成人分化成熟的组织中表达浓度较低,近年来发现CEA的表达与恶性肿瘤特别是消化系统肿瘤的发生更具有密切的关系,CEA的高表达主要考虑与癌细胞分裂过程中部分细胞核染色体碎片释放入血有关,同时也考虑与癌细胞破碎分解过程中部分细胞器的分解有关;CA19-9是肿瘤的糖蛋白因子,作为广谱肿瘤分子标志物,其与癌细胞膜表面配体的结合,能够增加癌细胞持续性DNA扩增的风险,导致癌细胞分化障碍、凋亡抑制等病理过程的发生。CA19-9对于肿瘤细胞的浸润能力的改变,能够增加消化道肿瘤细胞对于基底膜屏障的突破作用,增加早期癌细胞的扩散风险;PGI主要由胃底部主细胞分泌,其表达水平的变化能够提示腺体细胞的萎缩、扩增等异常病理状态,PGII不仅由主细胞分泌,同时可以由幽门腺体细胞或者贲门腺体细胞分泌,在发生了胃黏膜上皮细胞异型性改变或者癌变的过程中,腺体细胞内分泌功能明显下降[7-8],PGI明显下降 ,PGII明显的上升,PGI的下降主要考虑与上皮细胞的分泌功能的下降有关,而PGII的上升则考虑与反馈性调控过程的激活有关,同时PGI/PGII比值也可发生显著的变化[9-10]。部分研究主要关注于胃癌患者血清中CEA或者CA19-9等指标的变化探讨,但对于PGI、PGII特别是两者比值的探讨研究较为少见。
本次研究通过肿瘤患者的血清学指标分析可见,CEA或者CA19-9等在胃癌患者血清中存在明显的异常高表达趋势,相关指标的高表达提示不同的广谱肿瘤分子标志物在胃癌患者的早期疾病筛查或者临床预后过程中均可能具有一定的参考价值,从机制上考虑CEA或者CA19-9的异常表达对于胃癌的病情影响可能与下列几个方面的因素有关[11]:⑴ CEA能够促进癌细胞内肿瘤相关信号通路的激活,增加P16或者MAPK等肿瘤相关蛋白的高表达,促进癌细胞分化及调控异常;⑵ CA19-9的高表达能够影响到肿瘤细胞DNA扩增的速度,促进癌细胞凋亡抑制,癌细胞G1/S期细胞比例明显上升,癌细胞持续增殖期的比例明显增多。而对于胃蛋白酶原的相关分析可见,PGI、PGII的高表达趋势同样较为明显,这主要考虑与早期癌细胞异常增殖过程中癌细胞的短暂性腺体功能异常、癌细胞的分解增多、细胞膜碎片的释放增多等有关[12-16],同时也考虑与胃癌肿瘤微环境的改变有关。Gotoda等[17-18]研究者在探讨不同临床分期、治疗预后胃癌患者的血清学随访资料谱后发现,PGI、PGII的波动水平在胃癌早期可达15%~25%左右,但PGI、PGII的波动水平与胃癌患者的病情并不具有显著的线性关系。随着临床分期的进展,血清中CEA或者CA19-9等指标逐渐增高的趋势更为明显,临床分期越晚,肿瘤糖蛋白的释放蓄积效应越为明显[19,20],而PGI、或者PGI/PGII比值的下降也越为明显,这可能与临床分期进展过程中病灶组织对于临近正常胃黏膜上皮细胞的浸润、病灶范围的扩大或者淋巴结浸润等病理过程有关,提示PGI、或者PGI/PGII比值与胃癌患者的病情密切相关。诊断学价值分析可见,PGR、CEA、CA19-9等在早期诊断胃癌的过程中均具有一定的参考价值,而联合三种指标进行诊断可以进一步提高疾病诊断的灵敏度或者特异度,但仍然需要关注其漏诊率的发生,对于病变不典型、相关血清学指标改变不典型的患者,需联合胃镜检查进一步评估胃癌的发生风险。联合诊断的意义在能够避免单一指标的漏诊的发生,提高临床上胃癌患者的筛查水平,从而能够早期指导临床上胃癌的干预和治疗。
综上所述,血清PGR、CEA、CA19-9在胃癌患者的血清中存在一定程度的异常表达,而联合不同的指标进行诊断可以提高早期胃癌的筛查水平。
[1]Terasawa T, Nishida H, Kato K, et al. Prediction of Gastric Cancer Development by Serum Pepsinogen Test and Helicobacter pylori Seropositivity in Eastern Asians: A Systematic Review and Meta-Analysis[J]. PLoS One, 2014, 9(10):e109783. doi: 10.1371/journal.pone.0109783.
[2]霍东林. 老年胃癌患者外科治疗与预后的临床特点分析[J]. 中国民康医学, 2017, 29(14):85–87.Huo DL. Analysis of clinical characteristics and prognosis of surgical treatment of elderly gastric cancer patients[J]. Medical Journal of Chinese People's Health, 2017, 29(14):85–87.
[3]寇梦瑛, 王朝阳, 俸敏, 等. 老年与中青年胃癌临床病理特征和预后影响因素的差异[J]. 广东医学, 2015, 36(17):2691–2695.Guan MY, Wang CY, Feng M, et al. Differences of clinicopathologic characteristics and prognostic influential factors of gastric cancer in elderly patients and middle, young aged patients[J]. Guangdong Medical Journal, 2015, 36(17):2691–2695.
[4]贺艳. 血清胃蛋白酶原亚群及胃液胃蛋白酶水平与胃癌临床病理特征的关系[J]. 中国临床研究, 2015, 28(7):893–895.doi:10.13429/j.cnki.cjcr.2015.07.020.He Y. Relationship of serum pepsinogen subtypes and gastric juice pepsinogen level to clinicopathologic characteristics of gastric cancer[J]. Chinese Journal of Clinical Research, 2015, 28(7):893–895. doi:10.13429/j.cnki.cjcr.2015.07.020.
[5]赵连爽, 云科, 董西华. 胃癌患者血清中CA72–4、CEA和CA19–9水平及其与病理特征的相关性[J]. 中国医科大学学报, 2014,43(3):259–262.Zhao LS, Yun K, Dong XH. The Correlation between CA72–4,CEA and CA19–9 Expression in Patients with Gastric Carcinoma and Pathological Features[J]. Journal of China Medical University,2014, 43(3):259–262.
[6]中华人民共和国国家卫生和计划生育委员会. 胃癌规范化诊疗指南(试行)[J]. 中国医学前沿杂志: 电子版, 2013, (8):56–63.doi:10.3969/j.issn.1674–7372.2013.08.012.The guide of National Health Planning Commission for standard diagnosis and treatment of gastric cancer (trial use)[J]. Chinese Journal of the Frontiers of Medical Science: Electronic Version,2013, (8):56–63. doi:10.3969/j.issn.1674–7372.2013.08.012.
[7]陈思曾, 穆建成. 老年人胃癌淋巴结转移率与病理及临床预后的关系[J]. 中华老年医学杂志, 2015, 34(10):1088–1090.doi:10.3760/cma.j.issn.0254–9026.2015.10.010.Chen SZ, Mo JC. Relationship among metastatic ratio of lymph node and pathology or its prognosis in elderly gastric cancer[J].Chinese Journal of Geriatrics, 2015, 34(10):1088–1090.doi:10.3760/cma.j.issn.0254–9026.2015.10.010.
[8]谭银利, 陈和安, 刘飞. 外周血胃蛋白酶原I与胃泌素-17及可溶性人白细胞抗原-G检测对胃癌的诊断价值[J]. 中国临床药理学杂志, 2017, 33(10):945–947. doi:10.13699/j.cnki.1001–6821.2017.10.022.Tan YL, Chen HA, Liu F. Diagnosis value of serum pepsinogen I,gastrin-17, soluble human leukocyte antigen detection in gastric cancer[J]. The Chinese Journal of Clinical Pharmacology, 2017,33(10):945–947. doi:10.13699/j.cnki.1001–6821.2017.10.022.
[9]Huang Y, Yu J, Kang W, et al. Signif i cance of Serum Pepsinogens as a Biomarker for Gastric Cancer and Atrophic Gastritis Screening:A Systematic Review and Meta-Analysis[J]. PLoS One, 2015,10(11):e0142080. doi: 10.1371/journal.pone.0142080.
[10]刘德地, 张磊, 王亚雷, 等. 血清胃蛋白酶原、促胃液素-17和幽门螺杆菌抗体对胃癌前状态筛查能力的评价[J]. 安徽医科大学学报, 2017, 52(10):1563–1567. doi:10.19405/j.cnki.issn1000–1492.2017.10.033.Liu DD, Zhang L, Wang YL, et al. Evaluation of serum pepsinogen,gastrin-17 and Helicobacter pylori antibody in screening gastric precancerous state[J]. Acta Universitatis Medicinalis Anhui, 2017, 52(10):1563–1567. doi:10.19405/j.cnki.issn1000–1492.2017.10.033.
[11]刘烈辉, 李捷壮. 血清胃蛋白酶原联合高危人群胃镜检查诊断幽门螺旋杆菌感染相关胃癌的价值[J]. 中国老年学杂志, 2015,35(12):3392–3393. doi:10.3969/j.issn.1005–9202.2015.12.097.Liu LH, Li JZ. Value of serum pepsinogen combined with gastroscopic examination of high risk patients in diagnosis of H-pylori infection-related gastric cancer[J]. Chinese Journal of Gerontology, 2015, 35(12):3392–3393. doi:10.3969/j.issn.1005–9202.2015.12.097.
[12]周旭军, 邓斌, 关秀军. 血清CEA、CA125、CA19–9和CA72–4联合检测在胃癌诊断及治疗中的意义[J]. 现代仪器与医疗, 2015,21(3):95–97. doi:10.11876/mimt201503035.Zhou XJ, Deng B, Guan JX. Significance of combined detection of serum CEA, CA125, CA19-29 and CA 72-4 in diagnosis and treatment of gastric cancer[J]. Modern Instruments & Mediccal Treatment, 2015, 21(3):95–97. doi:10.11876/mimt201503035.
[13]吴继华. 胃蛋白酶原I、II测定在胃癌早期诊断中的研究[J]. 标记免疫分析与临床, 2011, 18(5):291–293. doi:10.3969/j.issn.1006–1703.2011.05.002.Wu JH. Clinical Value of the Detection of Pepsinogen Levels in Early Diagnosis of Gastric Cancer[J]. Labeled Immunoassays and Clinical Medicine, 2011, 18(5):291–293. doi:10.3969/j.issn.1006–1703.2011.05.002.
[14]谢津璧, 万坚, 张慧, 等. 血清胃蛋白酶原在胃癌及胃溃疡筛查中的临床意义[J]. 世界华人消化杂志, 2014, 22(31):4820–4824.Xie JB, Wan J, Zhang H, et al. Clinical significance of serum pepsingens in screening of gastric cancer and gastric ulcer[J]. World Chinese Journal of Digestology, 2014, 22(31):4820–4824.
[15]Kiso M, Yoshihara M, Ito M, et al. Characteristics of gastric cancer in negative test of serum anti-Helicobacter pylori antibody and pepsinogen test: a multicenter study[J]. Gastric Cancer, 2017,20(5):764–771. doi: 10.1007/s10120–016–0682–5.
[16]De Re V, Orzes E, Canzonieri V, et al. Pepsinogens to Distinguish Patients With Gastric Intestinal Metaplasia and Helicobacter pylori Infection Among Populations at Risk for Gastric Cancer[J]. Clin Transl Gastroenterol, 2016, 7(7):e183. doi: 10.1038/ctg.2016.42.
[17]Gotoda T, Ishikawa H, Ohnishi H, et al. Randomized controlled trial comparing gastric cancer screening by gastrointestinal X-ray with serology for Helicobacter pylori and pepsinogens followed by gastrointestinal endoscopy[J]. Gastric Cancer, 2015, 18(3):605–611.doi: 10.1007/s10120–014–0408–5.
[18]Ikeda F, Shikata K, Hata J, et al. Combination of Helicobacter pylori Antibody and Serum Pepsinogen as a Good Predictive Tool of Gastric Cancer Incidence: 20-Year Prospective Data From the Hisayama Study[J]. J Epidemiol, 2016, 26(12):629–636.
[19]Hamashima C, Sasazuki S, Inoue M, et al. Receiver operating characteristic analysis of prediction for gastric cancer development using serum pepsinogen and Helicobacter pylori antibody tests[J].BMC Cancer, 2017, 17(1):183. doi: 10.1186/s12885–017–3173–0.
[20]Kumar S, Kumari N, Mittal R D, et al. Pepsinogen-II 100 bp ins/del gene polymorphism and its elevated circulating levels are associated with gastric cancer, particularly with Helicobacter pylori infection and intestinal metaplasia[J]. Gastric Cancer, 2016, 19(3):808–816.doi: 10.1007/s10120–015–0550–8.

