腹腔镜辅助胃癌根治术的临床应用效果及对患者血清学指标的影响
马俊文,马文, 韩瑞东
(宁夏医科大学总医院 胃肠外科, 宁夏 银川 750004)
当前,胃癌已成为一种高发、常见的恶性肿瘤。在整个人体癌症构成中,其发病率位居次席[1],而病死率则居首位[2],严重影响人们健康及生命安全。在临床上,传统治疗胃癌的手段以开腹胃癌根治术为主,且疗效显著,能够有效挽救患者生命,延长其生存期。但传统外科手术对患者进行开腹,能够造成严重机体损伤,并诱发多种术后并发症,导致患者术后感染及出现炎症反应率较高高、康复速度较慢[3-4]。腹腔镜手术由于其具有对机体创伤轻、操作简便、并发症少及康复速度快等优点[5],已经成功被应用于各类恶性肿瘤治疗中,但其治疗胃癌具体疗效和最佳方案的选取还需进行更深入研究。本文总结腹腔镜辅助胃癌根除术治疗的114例胃癌患者临床资料,旨在探讨腹腔镜手术在胃癌治疗中的应用及对其生物学指标的影响。
1 资料与方法
1.1 一般资料
选取本院普外科收治的114例胃癌患者作为研究对象,在术前与患者充分沟通的情况下依据患者意愿分为微创组(54例)和开腹组(60例)。
微创组54例中男33例,女21例;年龄36~67岁,平均年龄(56.2±8.1)岁;手术切除类型:远端切除43例,近端切除7例,全胃切除4例;术前TNM分期:Ib期17例,II期30例,IIIa期7例;病灶直径(3.4±1.1)cm。开腹组60例中男38例,女22例;年龄33~69岁,平均年龄(58.4±9.0)岁;手术切除类型:远端切除47例,近端切除8例,全胃切除5例;术前TNM分期:Ib期20例,II期34例,IIIa期6例;病灶直径(3.6±1.0)cm。两组上述基础资料比较差异无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准[6-7]⑴ 所有胃癌患者经过术前超声、胃镜取活组织检查确诊,术后病理学检查证实;⑵ 所有患者均由本院同一组外科手术医师完成手术;⑶ 术前检查患者的心肺功能正常,能够耐受手术;⑷ 术前与患者签订知情同意书,本研究符合医学伦理委员会的基本要求。。
1.2.2 排除标准[8]⑴ 已经发生肝、肺、腹膜、骨等部位远处转移的患者;⑵ 不能耐受手术治疗的患者;⑶ 术后未能接受随访观察的患者。
1.3 手术方法
患者术前接受常规X线胸片和腹部CT 扫描确定肿瘤组织位置及癌灶周组织、脏器癌细胞侵犯程度,检查结束后取仰卧位,全麻后常规气管插管。开腹组患者于腹部取正中位切口,切口由上自剑突至下绕脐直达脐下处约3 cm,入腹腔切除肿瘤及肿瘤旁组织,若患者癌组织转移至淋巴组织,则应切除剑突后行常规淋巴结清扫术。微创组患者切口位置相同,但缩短为由剑突下至肚脐上,置入腹腔镜和气腹机后,充入CO2建立气腹,使用超声刀对手术区域充分暴露,并使用专用微创手术器械缩小切口,同时避开肚脐部位后,切除肿瘤及肿瘤周围组织,进行常规淋巴结清扫,游离、切断迷走神经的前后干。于剑突下6 cm正中线位置取纵行切口,置入切口保护器,切断幽门十二指肠,并于其距幽门下位置3 cm和食管下缘距贲门上段6 cm进行荷包缝合,再将食管切断,采用Roux-en-y吻合术重建消化道,要特别注意闭合空肠远端断口的,同时保证空肠近侧的断端和食管空肠达到充分吻合,吻合口旁放置引流管。清扫淋巴结结束后,两组患者闭合切口,常规包扎,并行抗炎,抗感染治疗。
1.4 观察指标及检测方法
比较两组患者的手术时间、术中出血量、切口长度、淋巴结清扫数目、术后排气时间、住院时间的差异;比较两组患者手术前后外周血癌胚抗原(CEA)、糖类抗原CA19-9、CA125、C反应蛋白(CRP)的变化情况;对比两组患者的手术并发症、术后24个月内肿瘤复发情况。
1.5 血清学指标检测方法
术前、术后抽取患者静脉血5 mL,3 200r/min离心5 min,取上清液滴入干净试管。散射比浊法测定CRP浓度,正常临界值为5 mg/mL,试剂盒购于深圳普门科技有限公司,生化检测分析用日本奥林巴斯AU2700型全自动生化分析仪;电化学发光分析法检测CEA、CA19-9和CAl25表达水平,正常临界值为CEA 5.0 ng/mL,CAl99 38 U/mL,CAl25 36 U/mL[9]。
1.6 统计学处理
数据分析在SAS 9.0软件包中处理,正态分布的计量指标采用均数±标准差(±s)表示,假设检验采用t检验;计数资料假设检验采用χ2检验;P<0.05表示差异有统计学意义。
2 结 果
2.1 微创组与开腹组手术相关指标比较
微创组手术时间显著的长于开腹组,差异有统计学意义(P<0.05);微创组术中出血量、切口长度、排气时间、住院时间均显著的低于开腹组,差异有统计学意义(P<0.05);微创组与开腹组淋巴结清扫数目差异无统计学意义(P>0.05)(表1)。
表1 微创组和开腹组的手术时间等围手术期指标比较(±s)
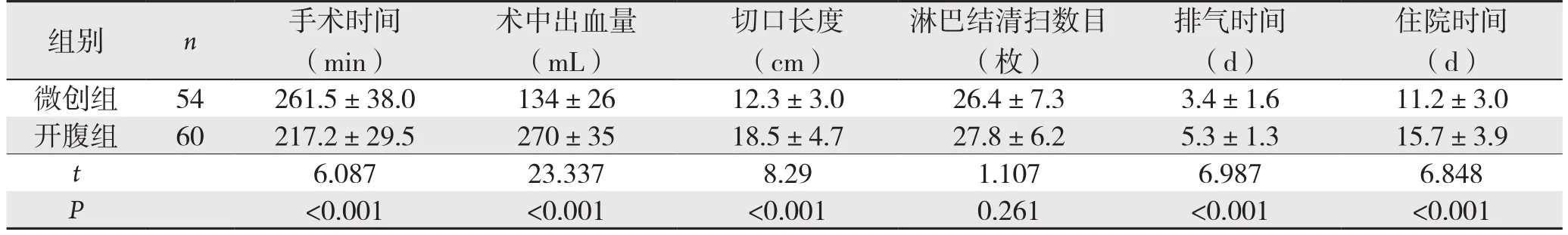
表1 微创组和开腹组的手术时间等围手术期指标比较(±s)
住院时间(d)微创组 54 261.5±38.0 134±26 12.3±3.0 26.4±7.3 3.4±1.6 11.2±3.0开腹组 60 217.2±29.5 270±35 18.5±4.7 27.8±6.2 5.3±1.3 15.7±3.9 t 6.087 23.337 8.29 1.107 6.987 6.848 P<0.001 <0.001 <0.001 0.261 <0.001 <0.001组别 n 手术时间(min)术中出血量(mL)切口长度(cm)淋巴结清扫数目(枚)排气时间(d)
2.2 微创组与开腹组手术前后血清学指标比较
微创组和开腹组患者术前的CEA、CA19-9、C A 1 2 5、C R P测定值差异无统计学意义(P>0.05);术后微创组和开腹组患者的CEA、CA19-9、CA125、CRP测定值均较本组术前显著的降低(P<0.05),术后微创组CEA、CA19-9、CRP测定值均显著低于开腹组(P<0.05)(表2)。
表2 微创组和开腹组的手术前后血清学指标比较(±s)

表2 微创组和开腹组的手术前后血清学指标比较(±s)
组别 n CEA(ng/mL) CA19-9(U/mL) Ca125(U/mL) CRP(mg/L)术前 术后 术前 术后 术前 术后 术前 术后微创组 54 62.3±15.8 9.8±5.2 73.5±19.4 35.2±12.0 57.3±19.5 42.0±11.1 33.0±9.4 16.1±6.2开腹组 60 64.9±17.3 17.6±6.1 71.8±20.0 46.6±13.5 59.1±20.5 44.3±13.7 31.5±10.3 21.8±7.4 t 0.835 7.306 0.46 4.744 0.479 0.978 0.809 4.431 P 0.491 <0.001 0.782 <0.001 0.76 0.287 0.52 <0.001
2.3 微创组与开腹组手术并发症、术后2年复发比较
微创组手术并发症率为12.96%,开腹组为18.33%,组间差异无统计学意义(P>0.05);微创组2年复发率为9.26%,开腹组为6.67%,两组比较差异亦无统计学意义(P>0.05)(表3)。

表3 微创组和开腹组患者手术并发症、术后2年复发比较[n(%)]
3 讨 论
临床上治疗胃癌疗效最佳方式的为手术切除术,其通过将原发肿瘤及其周围肿瘤细胞侵袭的组织进行彻底切除[10],实现对癌灶有效清除,术后再进行化疗及激素药物服用等持续性治疗。但常规手术切除术需通过切开患者腹部而直达胃部恶性肿瘤[11],切口较大,可严重损伤机体组织,易诱发多种术后感染及并发症,此外部分晚期胃癌患者机体生理状态较差,对开腹手术的耐受性较差,因此以小切口为主微创根治术逐渐被应用于胃癌治疗中。
微创小切口根治术治疗胃癌具有诸多优点,其中包括[9,12-13]:⑴ 对患者机体组织创伤程度低,可显著缩短手术时间、减少术中出血量,有效抑制和避免术后感染及多种并发症的发生;⑵ 腹腔及腹腔膜组织能够得到较大保留,患者术后康复速度快,缩短住院时间,降低经济负担;⑶ 术后胃肠功能恢复快,进食时间早,患者生活质量得到有效改善;⑷ 小切口可使得患者术后瘢痕轻微,且可有效降低切口感染,抑制及避免炎症反应。在本文中,通过微创小切口治疗,微创组术中出血量、切口长度、排气时间、住院时间均显著低于开腹组胃癌患者(P<0.05);这表明微创小切口胃癌根治术由于无需大切口手术,可显著降低术中出血量,对机体损伤轻微, 能够极大缓解患者生理和心理痛苦,加快其康复速度、缩短住院时间;同时小切口无需大面积剥离患者胃肠道组织及其周围软组织,可有效保护胃肠功能,使得其能够正常蠕动、排气。
微创小切口胃癌根治术仍具有诸多不足,首先需患者操作过程中避开胃肠组织,增加手术操作难度,使得手术时间无法现在缩短[14];同时术中吻合需顾及胃上食管及下肠道,因此操作难度也很高;而淋巴结清扫时,仍需要大面积损伤淋巴组织[15];该手术对手术医护人员技能和经验要求较高,且手术费用较高,造成短时间内难以广泛应用。本资料中,微创组手术时间显著长于开腹组(P<0.05),微创组与开腹组淋巴结清扫数目差异无统计学意义(P>0.05),结果验证微创小切口胃癌根治术手术操作难度高,可致手术时间延长,而淋巴结清扫尚未得到突破性改革,与常规开腹手术相似。
CEA由消化系统癌组织合成、释放糖蛋白,属于常规广谱性肿瘤标志物之一[16]。CA19-9及CA125均属于恶性肿瘤病理标志物,它们可由癌细胞分泌而造成血清内表达水平显著上升。研究显示,正常人血清内CA19-9表达≤35 U/mL[17],CA125表达≤32 U/mL[18]。CRP是机体非特异性免疫蛋白,正常状态下,人体内CRP表达较低且稳定,而组织损伤、炎症反应及癌症出现时显著增高[19]。本研究两组患者术前的CEA、CA19-9、CA 125、CRP均显著高于正常水平,而术后CEA、CA19-9、CA125、CRP测定值较术前均显著降低(P<0.05),术后微创组CEA、CA19-9、CRP测定值均显著的低于开腹组(P<0.05)。这表明微创小切口胃癌根治术和开腹胃癌根治术均能有效治疗胃癌,降低患者体内肿瘤标志物和炎症因子表达,但微创小切口疗效更优。本研究结果还显示,微创组手术并发症率、2年复发率与开腹组相似,手术治疗效果无统计学差异。
综上所述,微创小切口胃癌根治术治疗胃癌患者效果可靠、安全,能够加快患者术后康复,但治疗费用较高、操作复杂,手术时间相对延长。
[1]邵永胜, 肖新波, 金太欣, 等. 胃癌外科治疗的现状及展望[J]. 临床外科杂志, 2013, 21(10):808–810. doi:10.3969/j.issn.1005–6483.2013.10.030.Shao YS, Xiao XB, Jin TX, et al. Present status and prospect of surgical treatment of gastric cancer[J]. Journal of Clinical Surgery,2013, 21(10):808–810. doi:10.3969/j.issn.1005–6483.2013.10.030.
[2]宋彬, 刘晓彬, 马洪运, 等. 胰腺腺鳞癌80例临床诊治分析[J]. 中华外科杂志, 2014, 52(9):658–661. doi:10.3760/cma.j.issn.0529–5815.2014.09.008.Song B, Liu XB, Ma HY, et al. A clinical series of 80 patients with adenosquamous carcinoma of pancreas[J]. Chinese Journal of Surgery, 2014, 52(9):658–661. doi:10.3760/cma.j.issn.0529–5815.2014.09.008.
[3]李树伟. 微创小切口胃癌根治术治疗胃癌临床疗效分析[J]. 河北医学, 2013, 19(12):1809–1812. doi:10.3969/j.issn.1006–6233.2013.12.020.Li SW. Clinical Efficacy of the Small Incision Minimally Invasive for Gastric Cancer[J]. Hebei Medicine, 2013, 19(12):1809–1812.doi:10.3969/j.issn.1006–6233.2013.12.020.
[4]余佩武, 罗华星. 胃癌微创外科治疗的现状与进展[J]. 腹腔镜外科杂志, 2012, 17(5):321–324. doi:10.3969/j.issn.1009–6612.2012.05.001.Yu PW, Luo HX. Present status and prospect of minimally invasive surgical treatment of gastric cancer[J]. Journal of Laparoscopic Surgery, 2012, 17(5):321–324. doi:10.3969/j.issn.1009–6612.2012.05.001.
[5]潘宇. 完全腹腔镜全胃切除术近期疗效临床研究[D]. 杭州: 浙江大学, 2015:20–21.Pan Y. Short-term outcomes of Totally Laparoscopic Total Gastrectomy For Gastric Cancer[D]. Hangzhou: Zhejiang University, 2015:20–21.
[6]王然, 陈志康, 文俏程, 等. 胃癌术后早期肠内营养的应用[J]. 中国普通外科杂志, 2015, 24(9):1345–1348. doi:10.3978/j.issn.1005–6947.2015.09.028.Wang R, Chen ZK, Wen QC, et al. The use and efficiency of early enteral nutrition in the postoperative period of patients with gastric cancer[J]. Chinese Journal of General Surgery, 2015, 24(9):1345–1348. doi:10.3978/j.issn.1005–6947.2015.09.028.
[7]高金辉, 李建国, 蔡铭智, 等. 腹腔镜辅助与开腹胃癌根治术的中期疗效比较[J]. 中国微创外科杂志, 2015, 15(7):597–600.doi:10.3969/j.issn.1009–6604.2015.07.005.Gao JH, Li JG, Cai MZ, et al. Comparison of Medium-term Curative Effectiveness Between Laparoscopic Assisted and Open Radical Gastrectomy[J]. Chinese Journal of Minimally Invasive Surgery,2015, 15(7):597–600. doi:10.3969/j.issn.1009–6604.2015.07.005.
[8]叶再元, 王元宇. 胃癌微创外科治疗策略及新进展[J]. 中国医师杂志, 2015, 17(5):641–643. doi:10.3760/cma.j.issn.1008–1372.2015.05.001.Ye ZY, Wang YY. Strategy and recent advances in minimally invasive surgical treatment of gastric cancer[J]. Journal of Chinese Physician, 2015, 17(5):641–643. doi:10.3760/cma.j.issn.1008–1372.2015.05.001.
[9]孙庆章. 保留脾脏的胃癌根治性全胃切除术21例[J]. 中国现代普通外科进展, 2015, 18(5):397–399. doi:10.3969/j.issn.1009–9905.2015.017.Sun QZ. Twenty-one cases of splenic-preservation radical total gastrectomy for gastric cancer[J]. Chinese Journal of Current Advances in General Surgery, 2015, 18(5):397–399. doi:10.3969/j.issn.1009–9905.2015.017.
[10]Xu MQ, Liu CQ, Guo MF, et al. Combined laparoscopicthoracoscopic esophagectomy and intrathoracic esophagogastric anastomsis[J]. Journal of Thoracic Disease, 2013,5(6):895–897.
[11]李俊. 微创小切口胃癌根治术对胃癌的临床疗效[J]. 中国实用医药, 2015, 10(13):41–42. doi:10.14163/j.cnki.11–5547/r.2015.13.026.Li J. Clinical therapeutic effect of minimally invasive small-incision radical resection of gastric cancer[J]. China Practical Medical, 2015,10(13):41–42. doi:10.14163/j.cnki.11–5547/r.2015.13.026.
[12]Xie S, Huang J, Kang G1, et al. Surgical treatment of synchronous gastric and esophageal carcinoma: case report and review of literature[J]. Thorac Cardiovasc Surg Rep, 2013, 2(1):35–37. doi:10.1055/s-0033–1351357.
[13]倪道勇, 周蒙滔. 不同胃癌根治性切除术及重建术式临床效果分析[J]. 中国普通外科杂志, 2015, 24(4):565–569. doi:10.3978/j.issn.1005–6947.2015.04.019.Ni DY, Zhou MT. Clinical analysis of different types of radical gastrectomy and reconstruction for proximal gastric cancer[J].Chinese Journal of General Surgery, 2015, 24(4):565–569.doi:10.3978/j.issn.1005–6947.2015.04.019.
[14]邹镇洪, 牟廷裕, 邓镇威, 等. 完全腹腔镜全胃切除胃癌根治术消化道重建方式的探讨[J]. 中华胃肠外科杂志, 2014, 17(8):844–847. doi:10.3760/cma.j.issn.1671–0274.2014.08.03.Zou ZH, Mou TY, Deng ZW, et al. Exploration of digestive tract reconstruction with totally ;laparoscopic total gastrectomy for gastric cancer [J]. Chinese Journal of Gastrointestinal Surgery, 2014,17(8):844–847. doi:10.3760/cma.j.issn.1671–0274.2014.08.03.
[15]蔡丽生, 蔡铭智, 陈秋贤, 等. 腹腔镜辅助胃癌切除术185例报告[J]. 中国微创外科杂志, 2015, 15(9):789–792. doi:10.3969/j.issn.1009–6604.2015.09.006.Cai LS, Cai MZ, Chen QX, et al. Laparoscopic-assisted Gastrectomy for Gastric Cancer:a Report of 185 Cases[J]. Chinese Journal of Minimally Invasive Surgery, 2015, 15(9):789–792.doi:10.3969/j.issn.1009–6604.2015.09.006.
[16]苏向前, 杨宏. 腹腔镜胃肠外科在优化和创新中不断前行[J].中华胃肠外科杂志, 2014, 17(8):741–746. doi:10.3760/cma.j.issn.1671–0274.2014.08.001.Su XQ, Yang H. Continuous development of laparoscopic surgery for gastrointestinal carcinoma based on process optimization; and technical innovation[J]. Chinese Journal of Gastrointestinal Surgery, 2014, 17(8):741–746. doi:10.3760/cma.j.issn.1671–0274.2014.08.001.
[17]潘宇, 牟一平. 关于腹腔镜胃癌根治术的若干问题[J]. 肿瘤学杂志, 2015, 21(2):86–89. doi:10.11735/j.issn.1671–170X.2015.02.B002.Pan Y, Mou YP. Some Issues on Radical Laparoscopic Gastrectomy[J]. Journal of Chinese Oncology, 2015, 21(2):86–89.doi:10.11735/j.issn.1671–170X.2015.02.B002.
[18]刘凤林, 陈凌. 微创外科在胃肠道肿瘤中的应用[J]. 中华实验外科杂志, 2015, 32(9):2045–2047. doi:10.3760/cma.j.issn.1001–9030.2015.09.004.Liu FL, Chen L. Application of minimally invasive surgery for gastrointestinal tumors[J]. Chinese Journal of Experimental Surgery 2015, 32(9):2045–2047. doi:10.3760/cma.j.issn.1001–9030.2015.09.004.
[19]印义琼, 刘春娟, 张波, 等. 微创小切口胃癌根治术与传统开腹手术的临床对比研究[J]. 现代预防医学, 2012, 39(5):1306–1307.Yin YQ, Liu CJ, Zhang B, et al. Clinical Comparative Study of the Small Incision Minimally Invasive and Traditional Open Surgery for Gastric Cancer[J]. Modern Preventive Medicine, 2012,39(5):1306–1307.

