额叶p-mTOR异常表达与外伤性癫痫发生的相关研究
张艳丽,吐尔逊·沙比尔
外伤性癫痫(Posttraumatic epilepsy,PTE)是继发于创伤性脑损伤(Traumatic brain injury,TBI)后的发作性功能异常。PTE是脑外伤的常见后遗症,在TBI患者中有着较高的发病率和死亡率[1],同时也是临床上难治性癫痫的常见原因。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,p-mTOR)是一种丝氨酸/苏氨酸蛋白激酶,具有复杂的生物学效应,越来越多的证据表明mTOR异常激活可诱导PTE的发生,并在TBI患者及PTE动物模型中mTOR通过磷酸化被激活,活化的mTOR可通过磷酸化下游多种效应分子产生多重病理生理改变从而引起癫痫的进一步发展[2]。既往研究发现人与鼠的mTOR序列一致性高达98%[3]。目前在其他病因引起的癫痫中发现mTOR通路的异常激活,但mTOR信号通路在PTE中的激活情况及与PTE的关系目前还不明确[4-5]。目前PTE的动物模型有铁离子模型、液压打击模型、自由落体模型、控制性皮质撞击模型等,由于铁离子模型接近人类脑外伤后出血的病理及临床改变,成功率高,便于观察及干预性的研究,同时额叶皮质定位操作简单,故本实验通过常用的右额叶注射FeCl2法建立PTE大鼠模型[6],观察额叶皮质mTOR通路相关蛋白p-mTOR(Ser2448)的动态表达,探讨其在PTE中的发病作用,为PTE的防治提供理论基础。
1 材料与方法
1.1 研究对象 健康成年雄性SD大鼠78只,体质量180~220g,分为正常对照组(A组,n=6),生理盐水对照组(B组,n=36)和癫痫模型组(C组,n=36)。
1.2 方法 ①PTE模型的制作:大鼠以10%水合氯醛(350mg/kg)腹腔麻醉,术区备皮后固定于大鼠立体定向仪头架上,消毒,暴露颅骨,生理盐水组和癫痫模型组大鼠右额叶皮质的钻孔坐标为:前囟前2.0mm,中线旁3.0mm,硬膜下2.0mm,然后微量进样器缓慢进针至靶点,分别向靶点缓慢注射10uL的生理盐水或FeCl2(0.1mol/L)[6],FeCl2粉剂由武汉莱康生物提供。速率均为1μL/min,注射后留针5min。麻醉清醒后进行行为学检测,根据 Racine分级判断模型是否成功,0级:无任何癫痫发作;I级:凝视发作;II级:出现规律性点头或湿狗样抖动,伴有或不伴有面部抽动记;III级:一侧前肢震颤 ;IV级:站立、双前肢震颤及持续性点头;V级:前肢震颤加重,失去平衡跌倒而出现全身性强直-阵挛性发作;VI级:发作衰竭导致死亡,出现 4 级或以上发作行为为制模成功[7]。②动物处理:分别于制模后1h、24h、1周、2周、4周,先分别从A、B、C组各取6只,腹腔麻醉(以100g/L水合氯醛300g/kg腹腔麻醉)后,夹闭腹主动脉脉和下腔静脉,经升主动脉插管,灌注生理盐水200ml,再灌注含4%多聚甲醛的0.1mol/L PBS(pH7.4,4℃)300ml,缓慢灌注至肢体完全僵硬、断头完整取脑,矢状切片,福尔马林固定,石蜡包埋,石蜡包埋后切片厚3μm。 二甲苯脱蜡3次,每次2min,然后切片常规脱蜡、水化(环保透明脱蜡液30min→无水乙醇5s→95%乙醇10s→80%乙醇5s→自来水水洗3min→蒸馏水3min)。
1.3 检测指标 ①HE染色:将水化后的切片放入苏木精染色1~2min,蒸馏水冲洗数秒,1%盐酸酒精(70%酒精99ml+浓盐酸1ml)冲洗10~30s,1%氨水酒精(70%酒精99ml+浓氨水1ml)冲洗数秒至30s不等,蒸馏水冲洗3min后使用伊红染色40s,最后蒸馏水冲洗至无色。②免疫组化染色:组织切片后60℃烘片10h后二甲苯脱蜡2次,梯度乙醇脱水,蒸馏水冲洗净,PBS漂洗;将玻片浸入3%过氧化氢溶液中,PBS漂洗;滴加一抗,兔抗人p-mTOR(Ser2448)单克隆抗体由美国Cell Signaling Technology公司提供,4℃孵育过夜,室温中放置后PBS漂洗,滴加聚合物辅助剂,室温孵育,PBS液漂洗;滴加二抗,抗兔通用型免疫组化试剂盒,购于丹麦Dako公司。室温孵育,PBS漂洗;滴加DAB溶液显色,蒸馏水终止反应,棕黄色为染色阳性;苏木素复染后自来水冲洗,依次置于梯度乙醇脱水、二甲苯透明;中性树胶封片,观察结果。半定量分析p-mTOR(Ser2448)在额叶中的平均光密度(Mean Optical Density,MOD)值。
2 结果
2.1 HE染色结果 A组(图1a、b):组织结构清晰,额叶的皮层未见神经元变性。B组(图1c、d):额叶可见螺旋状神经元纤维,胞浆变性、细胞肿胀不明显。C组(图1e、f):额叶皮质可见镂空或网状病灶,细胞层次紊乱,神经元严重变性,细胞核固缩、深染,细胞核仁消失,胶质细胞明显增生,可见噬神经现象。
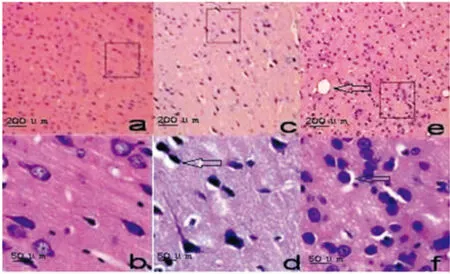
图1 额叶皮层神经元HE染色结果(×400)
图1a、c、e中的方框代表低倍镜下随机选取的视野,图1b、d、f分别为随机视野的高倍镜图像,箭头代表变性的神经元细胞
2.2 免疫组化结果 免疫组化定位p-mTOR(Ser2448)在额叶中主要表达在神经元的细胞质中(p-mTOR抗原与抗体结合后显示为棕色),细胞核及细胞外未见表达。图2显示1周后 A组(图a、b)额叶p-mTOR(Ser2448)表达的免疫组织化学染色,神经元胞质呈浅棕色,提示弱阳性表达; B组(图c、d)细胞染色程度较A组加深,p-mTOR(Ser2448)表达阳性细胞数增加;C组(图e、f)可见细胞结构紊乱,胞质呈明显的棕黄色,提示该蛋白在细胞质中呈强阳性表达。C组和B组比较,1h表达开始升高(t=-1.435,P=0.182),但差异并不显著,1周表达高峰(t=-4.073,P=0.002),2周降低(t=-2.614,P=0.026),4周时再次升高(t=-2.506,P=0.031),差异具有统计学意义(均P<0.05 ),见表1。

图2额叶皮层神经元免疫组化结果a 、c 、e(×200),b、 d 、f(×400)
图2a、c、e中的方框代表低倍镜下随机选取的视野,图2b、d、f分别为随机视野的高倍镜图像,图2d,f箭头所指分别代表p-mTOR弱阳性表达和强阳性表达的神经元

时间B组C组tP1h2.108±0.4002.318±0.498-1.4350.18224h2.427±0.4952.778±0.515-2.9690.0141周2.603±0.5723.133±0.466-4.0730.0022周2.247±0.4882.543±0.505-2.6140.0264周2.345±0.4182.672±0.533-2.5060.031
3 讨论
根据目前已有的研究结果,mTOR信号通路参与了细胞凋亡、吞噬、胶质增生、突触可塑性、神经递质受体、离子通道、轴突芽生等癫痫多种分子水平、细胞水平的病理改变,上游信号通路PI3K/Akt磷酸化后可激活mTOR,mTOR是一种相对保守的非典型丝/苏氨酸蛋白激酶,具有复杂的下游效应,其中与PTE的发生有着重要联系的是p-mTOR C1介导的下游信号通路,包括核糖体S6通路和4EBP1通路,S6属于AGC激酶家族的丝氨酸/苏氨酸激,S6经p-mTOR C1激活后,磷酸化的S6k再将S6磷酸化,这样使得含嘧啶基序序列mRNA的翻译功能增强;4EBPl也是p-mTOR C1的另外一个靶点,当mTOR信号通路激活时,4EBPl会因被p-mTOR C1磷酸化而失活,导致4EBPl从真核细胞翻译因子4E(eIF-4E)释放出来,从而降低4EBPl对蛋白翻译的抑制作用,最终导致额叶神经元兴奋性增高,异常细胞同步放电,最终导致癫痫的发生[8-9]。本课题组通过向大鼠右侧额叶皮质内注射铁离子制造PTE动物模型,该研究中额叶p-mTOR染色MOD最大的细胞主要分布于颗粒细胞层的胞质,同时分子层及多形细胞层也可见散在阳性细胞分布。实验结果显示,p-mTOR在正常大鼠额叶少量表达;本研究结果提示PTE动物模型中存在p-mTOR的表达增高,这与2009年Codeluppi[10]在PTE患者反应性星形胶质细胞中发现mTOR激活的结果相似,考虑可能是由于PTE引起的一系列氧化应激反应导致额叶颗粒细胞进一步反应性增殖,以及氧化应激后导致已经成熟的神经元或胶质细胞增殖分化[11],所以1周时MOD值最高;C组在2周时,p-mTOR的表达下降并接近正常水平,与B组该时间的比较差异具有统计学意义,分析原因可能与1周时产生的神经前体细胞分化为比较成熟的胶质细胞及损伤区神经元、胶质细胞坏死有关,故表达下降,但Sha等[12]研究显示p-mTOR的表达增高仍可持续到2周,原因可能与不同研究者采用不同的动物模型有关,具体机制还有待于进一步深入研究。在本研究中C组4周组p-mTOR表达再次升高,可能与发作性的癫痫发作导致的应激反应引起额叶颗粒细胞进一步反应增殖等因素有关[13]。
通过在大鼠额叶注射FeCl2引起大鼠PTE,并在大鼠额叶齿状回观察到反应性增殖的颗粒细胞,其增殖和分化可能与氧化应激反应导致mTOR通路的异常活化以及发作性癫痫的发生有关联,最终导致神经胶质细胞的过度增生,神经元数量减少、功能异常,海马结构紊乱[14-16];同时在损伤灶周围皮质观察到反应性增生的锥体神经元及胶质细胞,其增殖和分化也可能与FeCl2氧化应激刺激导致mTOR通路的异常活化有关联,导致皮质结构的紊乱,从来诱发癫痫发作[17-18],后期阵发性癫痫的刺激与mTOR通路的激活互为因果关系,相互促进进一步诱发慢性癫痫。同时我们观察到mTOR信号通路的异常激活在1周时最高,2周时降低,4周时又再次升高,和PTE大鼠的平均增加癫痫发作次数改变趋势相似,这种mTOR通路的异常激活可能是导致晚期PTE发作的重要证据[19-20]。然而,反应性增生的神经元及胶质细胞与mTOR的异常激活还需进一步的观察,是否可以使用mTOR通路的抑制剂RPN抑制mTOR的异常表达来治疗PTE还需进一步研究。本研究虽然发现PTE的发病机制可能与mTOR信号通路上额叶区p-mTOR(Ser2448)的表达异常增加有关,但并未涉及颞叶及海马区相关蛋白的研究,故还需要进一步深入探索。
【参考文献】
单因素分析结果表明,导致结肠癌合并肠梗阻患者术后伤口感染显著性相关的因素有体重指数、合并糖尿病、术前化疗、手术时间、术前低蛋白、术后引流管放置时间等(P<0.05),见表3。
[1] Frey LC. Epidemiology of posttraumatic epilepsy: a critical review[J]. Epilepsia, 2003, 44(10): 11-17.
[2] Cho CH. Frontier of epilepsy research-mTOR signaling pathway[J]. Experimental & molecular medicine, 2011, 43(5): 231-274.
[3] Gödel M, Hartleben B, Herbach N, et al. Role of mTOR in podocyte function and diabetic nephropathy in humans and mice[J]. The Journal of clinical investigation, 2011, 121(6): 2197-2209.
[4] Shima A, Nitta N, Suzuki F, et al. Activation of mTOR signaling pathway is secondary to neuronal excitability in a mouse model of mesio‐temporal lobe epilepsy[J]. European Journal of Neuroscience, 2015, 41(7): 976-988.
[5] Bockaert J, Marin P. mTOR in brain physiology and pathologies[J]. Physiological reviews, 2015, 95(4): 1157-1187.
[6] 林元相, 徐如祥, 姜晓丹,等. 皮层注射氯化亚铁建立外伤性癫痫动物模型[J]. 中华神经医学杂志, 2006, 5(4):372-377.
[7] Lüttjohann A, Fabene PF, van Luijtelaar G. A revised Racine's scale for PTZ-induced seizures in rats[J]. Physiology & behavior, 2009, 98(5): 579-586.
[8] Tee AR, Sampson JR, Pal DK, et al. The role of mTOR signalling in neurogenesis, insights from tuberous sclerosis complex[C]//Seminars in cell & developmental biology. Academic Press, 2016, 52(1): 12-20.
[9] Pitkänen A, Lukasiuk K. Mechanisms of epileptogenesis and potential treatment targets[J]. The Lancet Neurology, 2011, 10(2): 173-186.
[10] Codeluppi S, Svensson C I, Hefferan M P, et al. The Rheb-mTOR pathway is upregulated in reactive astrocytes of the injured spinal cord.[J]. Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2009, 29(4):1093-1104.
[11] Althaus A L, Sagher O, Parent J M, et al. Intrinsic neurophysiological properties of hilar ectopic and normotopic dentate granule cells in human temporal lobe epilepsy and a rat model[J]. Journal of neurophysiology, 2015, 113(4): 1184-1194.
[12] Sha L Z, Xing X L, Zhang D, et al. Mapping the spatio-temporal pattern of the mammalian target of rapamycin (mTOR) activation in temporal lobe epilepsy.[J]. Plos One, 2012, 7(6):391-412.
[13] Romá-Mateo C, Aguado C, García-Giménez J L, et al. Oxidative stress, a new hallmark in the pathophysiology of Lafora progressive myoclonus epilepsy[J]. Free Radical Biology and Medicine, 2015, 88 (1): 30-41.
[14] Ostendorf A P, Wong M. mTOR Inhibition in Epilepsy: Rationale and Clinical Perspectives[J]. CNS drugs, 2015, 29(2): 91-99.
[15] Binder D K, Steinhäuser C. Functional changes in astroglial cells in epilepsy[J]. Glia, 2006, 54(5): 358-368.
[16] Lipton J O, Sahin M. The neurology of mTOR[J]. Neuron, 2014, 84(2): 275-291.
[17] Kharatishvili I, Pitkänen A. Posttraumatic epilepsy[J]. Current opinion in neurology, 2010, 23(2): 183-188.
[18] Berdichevsky Y, Dryer A M, Saponjian Y, et al. PI3K-Akt signaling activates mTOR-mediated epileptogenesis in organotypic hippocampal culture model of post-traumatic epilepsy[J]. The Journal of Neuroscience, 2013, 33(21): 9056-9067.
[19] Russo E, Citraro R, Constanti A, et al. The mTOR signaling pathway in the brain: focus on epilepsy and epileptogenesis[J]. Molecular neurobiology, 2012, 46(3): 662-681.
[20] Meng X F, Yu J T, Song J H, et al. Role of the mTOR signaling pathway in epilepsy[J]. Journal of the neurological sciences, 2013, 332(1): 4-15.

