当归补血汤对糖尿病肾病大鼠PERK通路的影响*
沈 鑫,张思泉,张莹雯,柯浩亮,帅 瑜
(武汉大学附属中南医院,武汉 430071)
糖尿病肾病(DN)是糖尿病的一种严重并发症,是导致终末肾衰竭(ESRD)的主要原因之一[1]。近30年来,随着世界范围内糖尿病患者的增加,DN发病率也随之急剧提高[2]。DN发病机制复杂,涉及多种细胞因子和信号转导通路,包括糖代谢紊乱、氧化应激、血流动力学异常、细胞因子参与以及遗传因素等[3]。内质网应激(ERS)是近年来新发现的DN发病机制,被证实与DN关系密切[4-6]。本实验旨在探讨当归补血汤对DN大鼠GRP78-PERK-eIF2α通路的影响,为当归补血汤治疗DN提供新依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级雄性SD大鼠60只,6~8周龄,体质量180~210 g,均购自武汉大学实验动物中心[许可证号:SCXK(鄂)2014-0004]。饲养于武汉大学实验动物中心标准饲养房,室温(22±2)℃,相对湿度60%,每日光照12 h,实验期间不限饮食和饮水,定期更换敷料,连续观察8周。
1.1.2 实验药物 当归补血汤由当归、黄芪按1∶1配比(前期实验提示此为治疗DN最优配比),药物饮片购自湖北省中药材公司,当归、黄芪生药饮片浸水1 h,煮沸40 min,过滤后的药渣再次加水煮沸,重复2次,合并煎煮液,在水浴中浓缩,置4℃冰箱备用,按实验需要再行旋转蒸发浓缩备用。
1.1.3 主要仪器和试剂 超净工作台(苏净安泰),全自动生化分析仪(日本东芝公司),倒置光显微镜(Olympus日本),透射电子显微镜(日立公司),超薄切片机(瑞典Bromma公司),台式离心机(上海安亭科学仪器厂),PCR仪(杭州博日科技),电泳仪(北京市六一仪器厂),链脲佐菌素(STZ,美国Sigma公司,溶于0.1 mol/L,pH=4.3的柠檬酸钠缓冲液中);RIPA总蛋白裂解液、SDS-PAGE凝胶制备试剂盒、BCA蛋白质浓度测定试剂盒、ECL化学发光检测试剂盒(ASPEN)等。
1.2 方法
1.2.1 饲养条件 实验动物饲养于武汉大学实验动物中心标准饲养房,普通饲料和高脂饲料均由实验动物中心提供。室温20℃,相对湿度60%,每日光照12 h,实验前先适应性饲养1周,实验期间不限饮食和饮水,定期更换敷料,连续观察8周。
1.2.2 糖尿病大鼠的分组和造模 大鼠适应性饲养1周后,随机选取10只为对照组(n=10),喂普通饲料;其余大鼠为造模组(n=50)喂以高脂饲料,大鼠均不限饮食和饮水。1周后,将造模组大鼠禁食12h,并给予一次性腹腔注射STZ 30 mg/kg(溶于0.1 mmol/L,pH=4.3的柠檬酸钠缓冲液中),对照组给予相同剂量的柠檬酸钠缓冲液(0.1 mmol/L,pH=4.3)一次性腹腔注射,注射48 h后采足底静脉血,连续3 d测随机血糖,血糖≥16.7 μmol/L视为糖尿病大鼠造模成功[7]。造模组成活且造模成功的大鼠共43只,随机选取40只纳入实验,随机分为模型组[n=10,生理盐水10 mL/(kg·d)],当归补血汤高剂量组[高剂量组,n=10,7.14 g/(kg·d)当归补血汤溶缩液],当归补血汤低剂量组[低剂量组,n=10,1.79 g/(kg·d)当归补血汤溶缩液],格列齐特组[n=10,2.68 mg/(kg·d)格列齐特缓释片],以上药物均通过灌胃方式给药,对照组(N组)给予生理盐水10 mL/(kg·d)灌胃给药,连续灌胃8周后取材。
1.2.3 一般情况及生化指标的检测 观察大鼠的精神、毛色、活动是否灵活、食量、饮水量、尿量等;实验第8周末,用代谢笼收集24 h尿液,记录尿量并于-80℃冰箱保存;所有大鼠禁食12 h,禁水8 h后,称量大鼠体质量,无菌条件下腹腔注射戊巴比妥(50 mg/kg)麻醉大鼠,腹主动脉采血,离心后取血清,全自动生化分析仪测大鼠空腹血糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、肌酐(Scr)、尿素氮(BUN);无菌条件下摘取双肾。
1.2.4 光镜及电镜下观察肾组织 取小鼠肾组织用4%多聚甲醛固定,石蜡包埋,切片,将组织切片按常规方法进行过碘酸雪夫氏染色(PAS)染色,于光镜200倍视野下观察肾脏组织结构变化。另取肾皮质剪碎用1.25%戊二醛固定,用透射电镜观察肾脏超微结构。
1.2.5 免疫组化检测GRP78、PERK、eIF2α蛋白的表达 取小鼠肾组织于4%多聚甲醛溶液固定、石蜡包埋,将石蜡切片脱蜡至水后用EDTA缓冲液中微波修复,置于3%过氧化氢溶液中孵育,甩干后以5%BSA封闭,依次加入稀释的一抗、相应种属的二抗于保湿盒中孵育,滴加配制DAB,显微镜控制显色,中性树胶封固后用显微镜观察拍照。
1.2.6 PCR检测大鼠肾组织中GRP78 mRNA、PERK mRNA、eIF2α mRNA的表达 大鼠 GRP78、PERK、eIF2α 引物由 Invitrogen Biotechnology Co.,LTD.中国公司合成;总RNA的提取按试剂盒说明操作,用紫外分光光度计测量OD值并计算RNA浓度和质量;根据RNA的量,建立一个20 μL的反应体系,在RT-PCR仪器中进行逆转录反应:42℃30 min,80℃ 5 min,4℃冷却,-20℃保存,在 PCR仪上扩增;目的基因扩增用ΔΔCT法计算,A=CT(目的基因,实验样本)-CT(内标基因,实验样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),K=A-B,表达倍数=2-K,采用β-actin为内参,计算GRP78、PERK、eIF2α 的 CT值。
1.2.7 Western blot法检测 GRP78、PERK、eIF2α 蛋白的表达 每组随机选取两只大鼠的肾组织进行蛋白提取,检测蛋白浓度,保证每个样品总蛋白量。每个样品总蛋白上样量均为40 μg,进行制胶与上样,按浓缩胶80 V、分离胶120 V进行恒压电泳,按300 mA恒流转膜,转膜时间根据目的蛋白分子量大小调整,将转好的膜加入封闭液室温封闭1 h,加入已稀释好的一抗4℃过夜(兔属GAPDH,GRP78与5%脱脂牛奶呈 1∶2 000,PERK 与 5%BSA 呈 1∶1 000,eIF2α 与 5%BSA 呈 1∶2 000)用 TBST 洗 3次,每次5 min,加入稀释好的二抗(HRP-Goat anti Rabbit与5%脱脂牛奶呈 1∶10 000),室温孵育 30 min,用TBST在室温摇床上洗4次,每次5 min,暗室中曝光,将胶片进行扫描存档,AlphaEaseFC 4.0软件处理系统分析目标带的光密度值。
1.2.8 统计学方法 采用SPSS 20.0统计分析,计量资料以均数±标准差(x±s)表示,组间用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 对照组大鼠体毛光泽,活动敏捷,饮食量、尿量无明显变化,实验第8周末,体质量均较前增加;大鼠造模成功率为86%(43/50),造模成功后的大鼠体质量较对照组明显减轻,每日饮水量及尿量均多于对照组;造模后第4天可见大鼠皮毛湿黄,活动迟缓,多饮、多食、多尿、体质量下降,至实验第8周末,模型组大鼠上述症状最明显,治疗组上述情况得到不同程度改善,以高剂量组改善最为明显。
2.2 生化指标的检测 与对照组相比,模型组大鼠血糖(GLU)、血脂(TG、TC)、尿素氮(BUN)、肌酐(Scr)及蛋白尿(MAU)均明显升高(P<0.01);与模型组相比,各治疗组的 GLU、TG、TC、BUN、Scr及 MAU均下降(P<0.01 或 P<0.05),3个治疗组中,格列齐特组的GLU下降最显著(P<0.01),高剂量组BUN、Scr、MAU下降最明显(P<0.01),肾功能改善明显。见表 1、表 2。
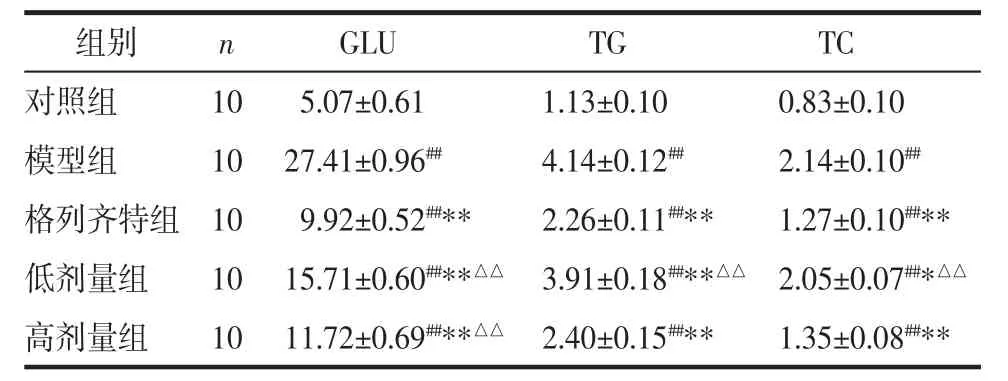
表1 各组大鼠GLU、血脂的检测(x±s)mmol/L
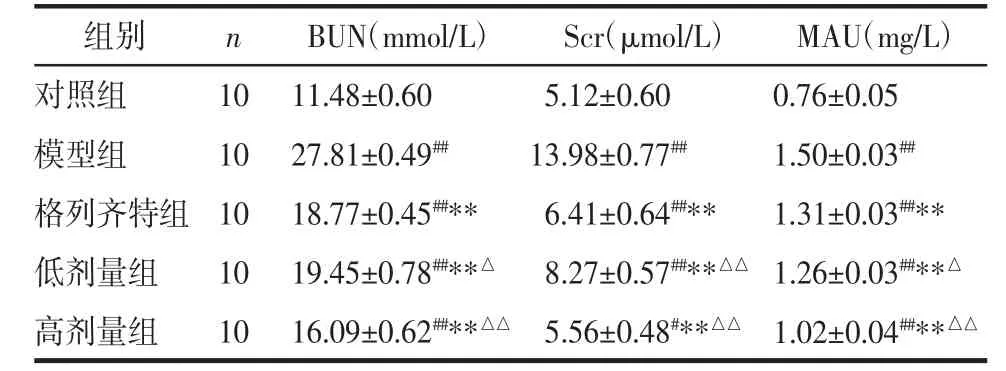
表2 各组大鼠BUN、Scr及MAU的检测(x±s)
2.3 光镜及电镜下肾脏形态结构观察
2.3.1 光镜下肾脏形态结构 对照组大鼠肾组织结构完整。模型组大鼠肾组织严重损伤,可见系膜细胞增生、基质增多,肾小球基底膜(GBM)增厚,PAS染色呈强阳性,部分肾小球可见毛细血管间出现PAS染色阳性的层状结节及节段性透明样变性,提示肾小球硬化,肾小管上皮肿胀,肾小管管腔变窄。格列齐特组和低剂量组可见轻度弥漫性系膜区细胞增生伴GBM增厚,肾小管无明显改变。高剂量组肾结构改善明显,仅见肾小球轻度水肿,无增生性病变,肾小管无明显改变。见图1。
2.3.2 电镜下肾脏形态结构 对照组GBM厚度基本均匀适中,足细胞位于GBM外层,足突结构完整,呈栅栏状整齐排列。模型组GBM增厚,足细胞出现空泡改变,裂隙膜减少,足突融合,部分足细胞从GBM脱落,排列紊乱;肾小管上皮细胞肿胀变性,可见内质网、线粒体和细胞核肿胀。格列齐特组和低剂量组病变减轻,GBM轻度增厚,系膜基质轻度增多。高剂量组病变改善明显。见图2。
2.4 各组 GRP78、PERK、eIF2α的免疫组化结果 GRP78、PERK、eIF2α在对照组中有少量表达,表现为棕黄色颗粒,三者主要定位在肾小管上皮细胞胞浆内;模型组的 GRP78、PERK、eIF2α 表达较对照组明显增多,差异具有统计学意义(P<0.01),三者主要定位于肾小管;高剂量组、低剂量组与格列齐特组的GRP78、PERK、eIF2α表达均明显低于模型组(P<0.01),高剂量组相比于格列齐特组表达更低(P<0.01或P<0.05)。见表3及图3-5。
2.5 各组GRP78、PERK、eIF2α的mRNA表达情况
GRP78、PERK、eIF2α在正常肾组织中有一定量的表达,相比于对照组,模型组大鼠GRP78、PERK、eIF2α的表达显著增高,差异具有统计学意义(P<0.01)。相比于模型组,3个治疗组的 GRP78、PERK、eIF2α的表达均降低,差异具有统计学意义(P<0.01)。相比于格列齐特组,高剂量组的GRP78、PERK、eIF2α的表达更低(P<0.01或 P<0.05)。见表 4。
2.6 Western blot测 GRP78、PERK、eIF2α 的蛋白表达 相比于对照组,模型组大鼠GRP78、PERK、eIF2α的蛋白表达显著增高,差异具有统计学意义(P<0.01);相比于模型组,各治疗组的GRP78、PERK、eIF2α的表达均降低,差异具有统计学意义(P<0.01);相比于格列齐特组,高剂量组的GRP78、PERK、eIF2α的表达更低(P<0.01或 P<0.05),见表 5及图 6。
3 讨论
DN在中医学归为消渴病下消,基本病机为“气血两虚兼血瘀”。当归补血汤中黄芪味甘温,可益气固表,补气升阳;当归味甘辛温,可补血生血行血,两者配伍则阳生阴长,气旺血生,具有补气活血之功效,与其病机契合。现代研究发现,黄芪甲苷(IV)可通过下调PERK-ATF4-CHOP通路发挥抑制足细胞凋亡,保护肾组织,防治DN的作用[8]。且当归与黄芪配伍,当归可增强黄芪中黄芪甲苷在体内的活力,并可使黄芪甲苷达峰时间提前1倍[tmax由(4.00±1.54)h 至(2.00±0.95)h],达峰浓度提高 1 倍[Cmax由(60±7)μg/L 到(146±27)μg/L],加速黄芪甲苷发挥功效的进程[9]。当归补血汤可抑制高糖条件下肾小球细胞膜外基质蛋白表达[10],下调多个靶器官相关蛋白因子(BMP-7、TGF、HPA 等),具有预防和治疗早期DN的作用[11-13]。
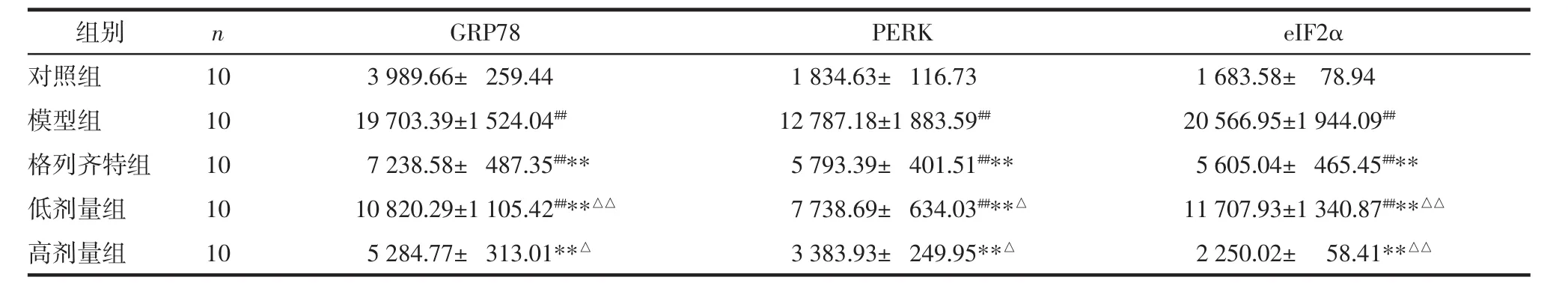
表3 各组GRP78、PERK、eIF2α的蛋白表达情况(x±s)
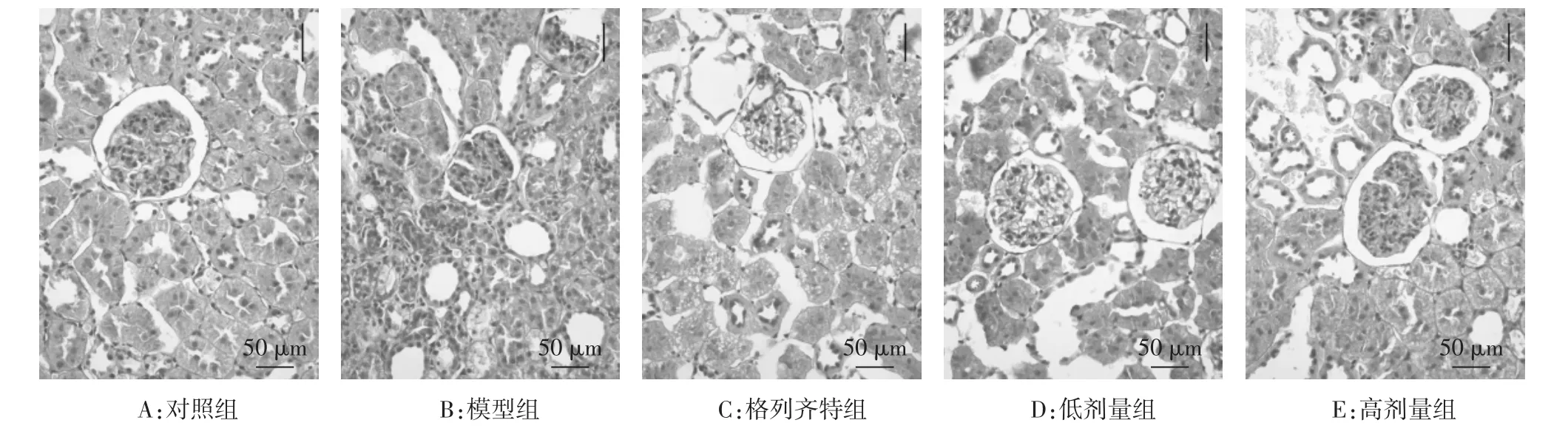
图1 各组大鼠肾组织PAS染色结果(×200)
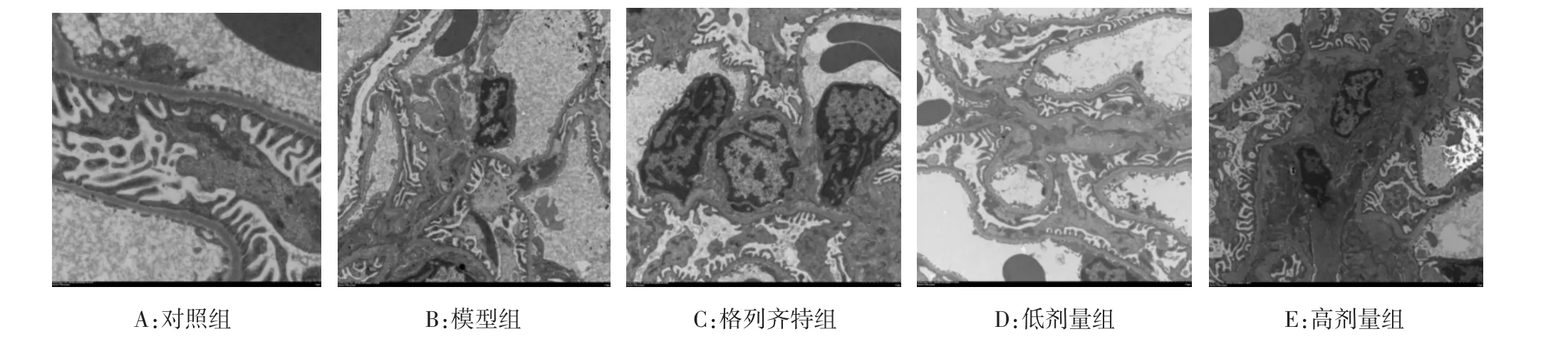
图2 各组大鼠肾组织电镜下观察结果(×2 000)
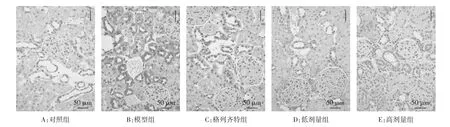
图3 免疫组化检测GRP78蛋白表达结果(×200)
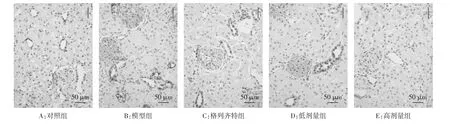
图4 免疫组化检测PERK蛋白表达结果(×200)
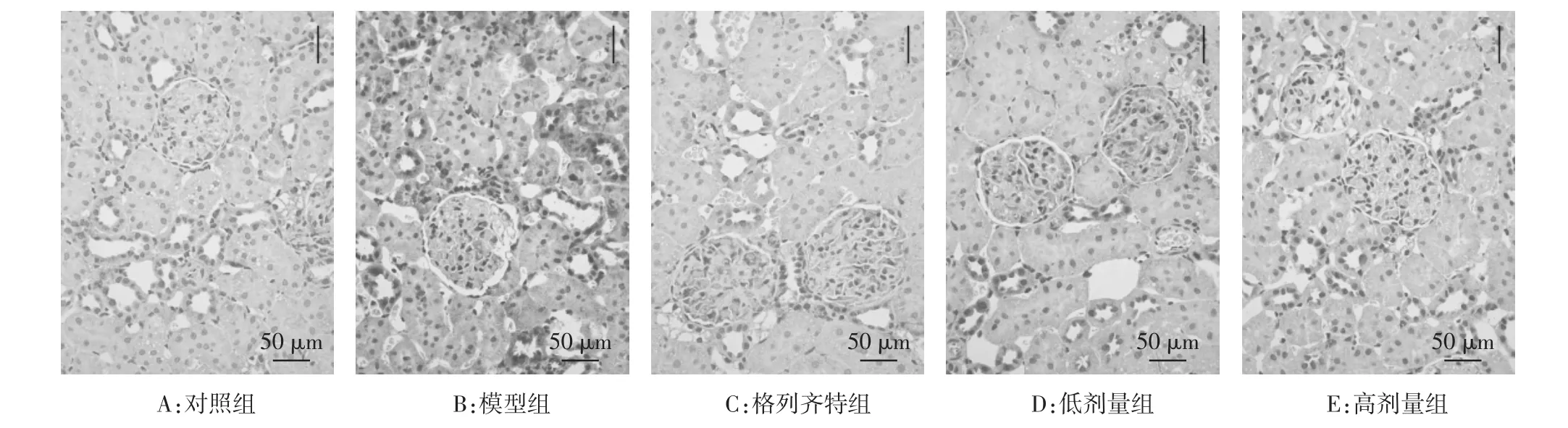
图5 免疫组化检测eIF2α蛋白表达结果(×200)
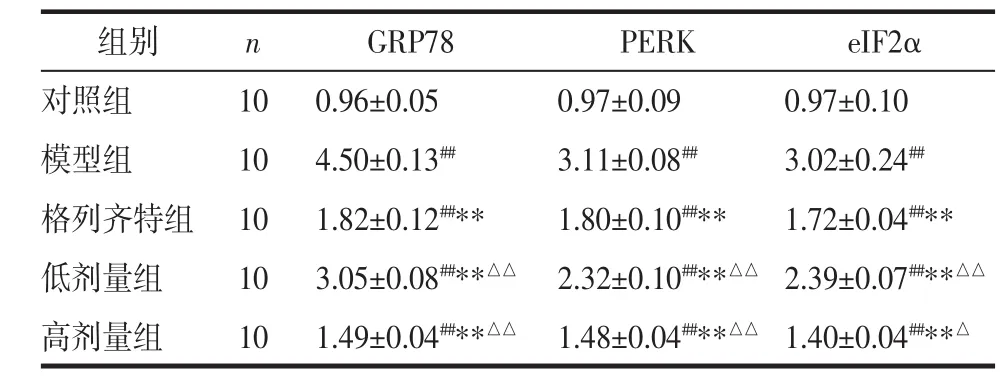
表 4 各组 GRP78、PERK、eIF2α 的 mRNA 表达(x±s)
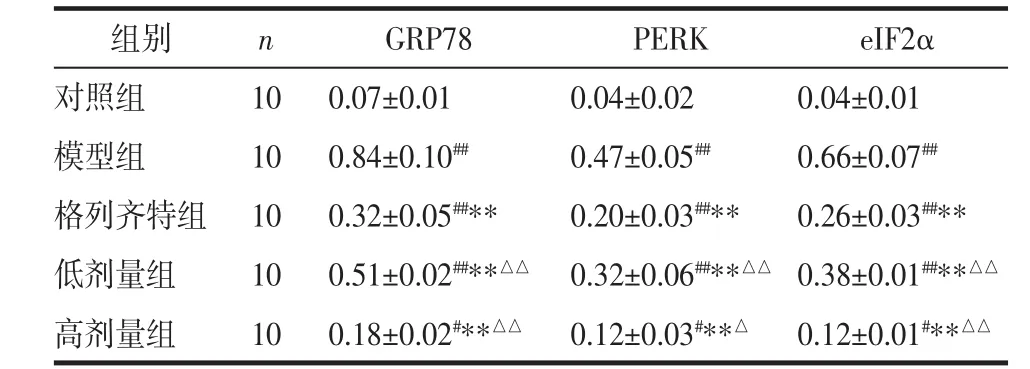
表 5 各组 GRP78、PERK、eIF2α 的蛋白表达(x±s)
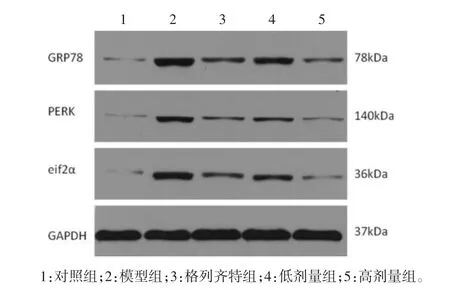
图6 Western-blot电泳条带图
本实验中,当归补血汤和格列齐特均可改善DN大鼠的一般情况,降低血糖、血脂,而且在降低尿蛋白,改善肾功能和肾脏结构损害方面,当归补血汤优于格列齐特。免疫组化、Western Blot及PCR显示模型组大鼠GRP78、PERK、eIF2α的表达明显高于对照组,表明ERS已经激活;当归补血汤治疗组大鼠肾组织中GRP78、PERK、eIF2α的表达相比于模型组明显下降,高剂量组下降更明显。实验表明当归补血汤可抑制PERK通路相关蛋白,缓解ERS,具有保护肾组织结构和肾功能作用,且呈浓度依赖性。
当反常出现后,当自然界以某种方式违反支配常规科学所做的预测后,此时科学共同体成员则会对反常的现象和领域进行一定的研究,以便找出问题所在,通过调整范式来消解这种反常。“发现始于意识到反常,即始于认识到自然界总是以某种方法违反支配常规科学的范式所做的预测。”[2]44由此可见,出现反常现象后,调整范式是关键的一步。范式有能力迫使科学共同体成员去处理这种反常,因此,范式不仅仅是被动的被利用的,它也有主动的一面。科学共同体依赖于范式的时候,范式便由被动的状态变为主动的状态,由静态转变为动态。
实验结果为临床治疗DN提供了新的依据。但仍存在问题需进一步探究,当归补血汤具体作用于PERK通路的机制尚不明确,推测当归补血汤可通过抑制PERK通路进一步抑制eIF2α下游的ATF4、CHOP、Capase12等凋亡相关基因缓解ERS造成的损害,是否激活了下游其他分子通路,还需更深入的研究。
参考文献:
[1] Packham DK,Alves TP,Dwyer JP,et al.Relative incidence of ESRD versus cardiovascular mortality in proteinuric type 2 diabetes and nephropathy:results from the DIAMETRIC(Diabetes Mellitus Treatment for Renal Insufficiency Con-sortium)database[J].Am J Kidney Dis,2012,59(1):75-83.
[2] Finucane MM,Stevens GA,Cowan MJ,et al.National,regional,and global trends in body-mass index since 1980:systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants[J].Lancet,2011,377(9765):557-567.
[3] 李敏州,高彦彬,马鸣飞,等.糖尿病肾病发病机制研究进展[J].中国实验方剂学杂志,2012,18(22):344-349.
[4] Qi W,Mu J,Luo ZF,et al.Attenuation of diabetic nephropathy in diabetes rats induced by streptozotocin by regulating the endoplasmic reticulum stress inflammatory response[J].Metabolism,2011,60(5):594-603.
[6] Ma JH,Wang JJ,Zhang SX.The unfolded protein response and diabetic retinopathy[J].J Diabetes Res,2014:160140-160153.
[7]李玉山,刘丽秋.实验性2型糖尿病肾病大鼠模型研究[J].中国实验诊断学,2009,13(5):574-577.
[8] Chen Y,Gui D,Chen J,et al.Down-regulation of PERKATF4-CHOP pathway by Astragaloside IV is associated with the inhibition of endoplasmic reticulum stress-induced podocyte apoptosis in diabetic rats[J].Cell Physiol Biochem,2014,33(6):1975-1987.
[9] 王文萍,曹琦琛,王华伟,等.当归补血汤不同配伍的药动学研究[J].中国临床药理学与治疗学,2009,14(6):659-663.
[10]Ke HL,Zhang YW,Zhou BF,et al.Effects of Danggui Buxue Tang,a traditional Chinese herbal decoction,on high glucose-induced proliferation and expression of extracellular matrix proteins in glomerular mesangial cells[J].Nat Prod Res,2012,26(11):1022-1026.
[11]任小旦,张莹雯.黄芪、当归及其复方治疗糖尿病肾病的研究进展[J].中华中医药学刊,2015,33(10):2318-2320.
[12]Fan Y,Lee K,Wang N,et al.The Role of endoplasmic reticulum stress in diabetic nephropathy[J].Curr Diab Rep,2017,17(3):17-23.
[13]Cunard R,Sharma K.The endoplasmic reticulum stress response and diabetic kidney disease[J].Am J Physiol Renal Physiol,2011,300(5):F1054-F1061.

