环境条件对果胶/酪蛋白复合物的影响
张璐璐,谭慧林,张春兰,2*
(1.塔里木大学生命科学学院,新疆阿拉尔 843300;2.南疆特色农产品深加工兵团重点实验室,新疆阿拉尔 843300;3.新疆阿克苏地区食品安全检测中心,新疆阿克苏 843000)
蛋白质和多糖是食品中的重要组成部分,通过分子相互作用,产生化学协同和物理空间协同,形成食品的高级结构,进而决定食品的质构、稳定和感官,并显著影响其营养和功能性[1-3]。蛋白质与多糖在一定温度、湿度条件下发生的美拉德反应,会使食品产生特有的色香味,同时美拉德反应产物——蛋白质多糖共价复合物在制备食品级乳液体系中也发挥着特有的作用。在食品体系中,更为常见的是蛋白质与多糖的非共价相互作用,例如静电相互作用、疏水作用等。蛋白质和多糖形成的静电复合物、凝胶在功能性成分的保护、递送方面,以及Pickering乳液的乳化等方面发挥巨大潜力[4-8]。带正电的蛋白质与带负电荷的多糖形成的静电复合物的粒径大小以及稳定性会受到多种因素的影响,例如蛋白质与多糖的结构、两者在食品体系中的混合比例、总浓度、pH值及各种加工条件(如超声、加热、剪切等),都会对它们的相互作用产生影响。酪蛋白和果胶是食品中常用的食品添加剂,酪蛋白是牛奶、羊奶中的主要蛋白质,具有较高的营养价值,故在食品中使用广泛。果胶一般从柑橘皮、苹果皮、葡萄皮等植物细胞中提取,食品中主要是利用其凝胶性生产胶冻、果酱和软糖,也可用作乳化稳定剂和增稠剂。因此本试验选择食品中较常用的果胶和酪蛋白为对象,研究食品体系中的pH值、浓度、混合比例以及热处理对其相互作用的影响。对果胶、酪蛋白相互作用进行研究,将对改进食品结构、设计新型食品有重要的实际应用价值。
1 材料与方法
1.1 仪器与试剂
PHS-3C型酸度计,上海仪电科学仪器股份有限公司;
JA5003电子天平,上海箐海仪器有限公司;
HH-501恒温水浴锅,江苏金怡仪器科技有限公司;
752紫外可见分光光度计,上海箐海仪器有限公司;
UM-4T系列磁力搅拌器,北京优晟联合有限公司;
酪蛋白、果胶为阿拉丁试剂有限公司生产;
磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸叠氮化钠等均为国药集团化学试剂有限公司生产。
1.2 试验方法
1.2.1 溶液的配制
1%酪蛋白原液的配制:称取1.0g酪蛋白倒入烧杯中加入10mL0.1mol/L的NaOH使酪蛋白溶解,加pH为7的10mmol/L磷酸盐缓冲液至100mL,置于磁力搅拌器上用1500r/min搅拌2h,静置过夜待用。
1%果胶原液的配制:称取1.0g果胶溶解在pH为7磷酸盐缓冲液100mL中,在磁力搅拌器上用1500r/min搅拌2h,静置过夜待用。
1.2.2 pH对果胶/酪蛋白复合的影响
将1%的果胶和酪蛋白分别稀释成0.2%,以果胶:酪蛋白 =1:1(V:V)调 pH 为 3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,以蒸馏水为空白,在600nm下测定体系的透光率。然后在85℃恒温水浴锅中加热15min,再在600nm下测定体系的透光率。
1.2.3 浓度对果胶/酪蛋白复合的影响
选择果胶、酪蛋白的浓度分别为0.1%、0.2%、0.3%、0.4%、0.5%,将两者以1:1的比例混合,调节pH为4.0,以蒸馏水为空白,在600nm下测定体系的透光率。在85℃水浴锅加热15min,再在600nm测定体系的透光率。
1.2.4 果胶/酪蛋白的比例对复合的影响
选择果胶、酪蛋白的浓度均为0.2%,将果胶:酪蛋白分别以 3:1、2:1、1:1、1:2、1:3 混合,调节 pH 为 4.0,以蒸馏水为空白,在600nm下测定体系的透光率。然后在85℃水浴锅加热15min,在600nm测定体系的透光率。
1.2.5 加热温度对果胶/酪蛋白复合的影响
选择0.2%果胶/酪蛋白1:1混合,调pH为4.0,在温度分别为 55℃、65℃、75℃、85℃、95℃水浴加热 15min,再采用分光光度计,以蒸馏水为空白,在600nm测定体系的透光率。
1.2.6 测定指标与方法
根据测得的透光率按照下式计算浊度。
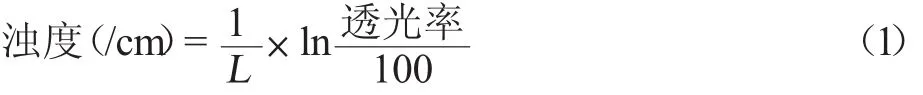
式中,L为比色皿内径宽度,cm。
2 结果与分析
2.1 pH值对果胶/酪蛋白复合的影响

图1 不同pH值对果胶/酪蛋白复合的影响Fig.1 The effect of pH on pectin/casein complex
从图1可以看出,体系在pH3.0~4.5加热后浊度明显上升,这可能是因为酪蛋白的pI在4.5左右,在pH3.0~4.5时,酪蛋白带正电,果胶带负电,两者发生了强烈的静电相互作用;pH在4.5~8加热后浊度明显下降,此时果胶与酪蛋白以共溶的形式存在,具有较高的透明度。相比未加热的体系,85℃加热15min后的浊度在pH3.0~5.5范围内均高于未加热的,这可能是加热使蛋白质变性,进一步加剧了酪蛋白与果胶的聚合。因此我们选择pH在4.0进行进一步的研究。
2.2 浓度对果胶/酪蛋白复合的影响
从图2的数据中可以看出,随着浓度的增加,果胶/酪蛋白混合体系的浊度也在不断上升,表明形成的聚集物也在增加。相比未加热的体系,果胶/酪蛋白溶液加热后均有更高的浊度。这主要是由于在较强的静电相互作用下(pH=4.0)使得果胶与酪蛋白分子强烈结合,进行加热后更促进果胶/酪蛋白形成微凝胶网络结构,因此加热过的混合体系比未加热的浊度要高。而且实验中还发现当浓度过大时甚至会出现果胶/酪蛋白的絮凝、沉淀现象。

图2 不同浓度对果胶/酪蛋白复合的影响Fig.2 The effect of concentration on pectin/casein complex
2.3 果胶与酪蛋白的比例对复合的影响

图3 不同比例的果胶/酪蛋白对其复合的影响Fig.3 The effect of ratio on pectin/casein complex
图3显示了不同比例的果胶/酪蛋白对其复合的影响,从图3中可以看出,在果胶/酪蛋白的比例为1:1时,混合体系的透明度较低,浊度较高。在pH=4.0时,酪蛋白质子化后带正电荷,果胶与酪蛋白在静电驱动下形成复合物。聚集状态达到最佳,聚合物也是最多的时候,所以果胶:酪蛋白=3:1和2:1时,体系的浊度较低,这可能是因为当果胶含量多时,负电荷过多,没有足够的酪蛋白与果胶结合,也可能过多果胶的存在,阻碍了酪蛋白与果胶的聚合;而当酪蛋白含量多时,酪蛋白带正电,与之结合的果胶不够,酪蛋白剩余,所以在果胶:酪蛋白=1:3时浊度也较高。
2.4 加热温度对果胶/酪蛋白复合的影响
热处理是对蛋白质影响较大的处理方法[9]。影响的程度取决于热处理的时间、温度以及有无氧化还原性物质存在等因素。图4(见下页)显示了温度对果胶/酪蛋白复合的影响,从图4中可以看出随温度的升高,果胶/酪蛋白复合物的浊度也从0.44/cm增大到0.59/cm,这可能是因为温度越高,越接近蛋白质的变性温度,使蛋白质从天然状态逐渐转变为变性状态,蛋白质的结构发生一定的变化,产生了聚集。经过加热后,果胶/酪蛋白复合物形成的作用力除了静电相互作用外,可能还有氢键结合、共价结合等作用。

图4 温度对果胶/酪蛋白复合的影响Fig.4 The effect of temperature on pectin/casein complex
2.5 果胶/酪蛋白复合物表征
使用Nano-ZS粒度仪测定复合物的粒径。首先,复合物用相应pH值的磷酸盐缓冲液稀释100倍后再测定粒径,多分散性指数(Polydispersity Index,PDI),以及乳液电位(ζ-potential)。
2.5.1 pH对果胶/酪蛋白复合物电位的影响
选择0.2%的果胶/酪蛋白1:1混合,调pH在3~8之间,在85℃恒温水浴锅加热15min,再测复合物的电位,进行比较分析。
图5显示了果胶/酪蛋白复合物的电位,在图中可以看出,随着pH(3.0~8.0)的增大,果胶/酪蛋白复合物的电位从-10.2mV降低到-48.6mV。即使是在较低的pH下,复合物依然带有负电,这说明在此条件下酪蛋白的正电荷与果胶的负电荷发生了电荷中和,酪蛋白的正电荷全部被果胶的负电荷所中和。在高pH条件下,酪蛋白与果胶都带有负电荷,两者之间强烈的静电相斥作用使得酪蛋白与果胶分子以共溶的形式存在。

图5 果胶/酪蛋白复合物的电位Fig.5 The charge of pectin/casein complex
2.5.2 pH对果胶/酪蛋白复合物粒径、PDI的影响
选择0.2%的果胶/酪蛋白1:1混合,调pH在3~8之间,在85℃恒温水浴锅加热15min,再测复合物的粒径以及PDI,进行比较分析。

图6 纳米粒子的粒径以及PDIFig.6 The size and PDI of pectin/casein complex
从图6中看出果胶/酪蛋白复合物在pH 6.0~8.0时粒径比较大,约在450nm左右,在此条件下果胶与酪蛋白带有相同的负电荷,两者不能发生聚集形成小粒径的纳米凝胶。从图中可以看出在此范围的PDI值也较大,粒径分布较分散;而在pH 3.0~5.5范围内粒径较小,均在300nm以下,其中在pH 5.0时,复合物的粒径最小,为162nm。在pH 4.0和4.5时,复合物的粒径约240nm,PDI分别为0.19和0.17,说明其粒径分布较集中。
3 结论
果胶/酪蛋白在pH 3.0~5.5范围内的浊度均高于未加热的;随着浓度(0.1%~0.5%)的增加,果胶/酪蛋白复合物的浊度增大,当浓度过大时会出现絮凝现象;果胶/酪蛋白为3:1和2:1时,体系的浊度较低,在果胶:酪蛋白=1:1时浊度较高;随温度的升高(55~95℃),果胶/酪蛋白复合物的浊度也从0.44/cm增大到0.59/cm,温度越高,越接近蛋白质的变性温度,使蛋白质的结构发生一定的变化,产生了聚集。
随着pH的增大,果胶/酪蛋白复合物的电位从-10.2mV降低到-48.6mV。果胶/酪蛋白复合物在pH 6.0~8.0粒径比较大,约在450nm左右。而在pH 3.0~5.5范围内粒径较小,均在300nm以下,都是单峰,其粒径分布较集中,说明形成了纳米凝胶。由此可以看出,本文通过对果胶/酪蛋白纳米粒子的形成条件进行研究,从而达到对复合物浊度、粒径精准调控的目的,也为合理控制食品体系中蛋白质与多糖的相互作用提供了依据。
参考文献:
[1] 操义平.多糖/蛋白质混合体系复杂相行为的研究[D].湖北工业大学,2016.
[2] 许威,李斌.多糖/蛋白质复合体系相转变及其在食品中的应用[J].食品科技,2017,42(1):76-80.
[3] 魏冬旭,江连洲,王辰,等.pH值对大豆11S球蛋白结构和表面疏水性的影响[J].食品科学,2015,11:1-5.
[4] 杨飞,王君,蓝强,等.Pickering乳状液的研究进展 [J].化学进展,2009,21(7/8):1418-1426.
[5] BAKHTRAMINSHAH.基于壳聚糖纳米粒子稳定Pickering乳液的制备、表征与姜黄素包埋[D].武汉:华中农业大学,2015.
[6] 柴智.纳米营养载体中食品多糖与蛋白质复合壁材的协同稳定及控释[D].中国农业大学,2015.
[7] 孙翠霞,刘夫国,杨伟,等.固体颗粒稳定Pickering乳液的研究进展[J].中国食品添加剂,2015,(04):166-172.
[8] 李海明,杨盛,韦何雯,等.食品级Pickering乳液的研究进展[J].食品科学,2015,(19):265-270.
[9] 陈振家,施小迪,杜昱蒙,等.不同热处理大豆分离蛋白凝胶冻藏特性[J].农业工程学报,2016,32(11):283-289.

