由诺欣妥专利无效来看联合用药型技术的专利布局
王菲
诺欣妥(LCZ696,沙库巴曲缬沙坦钠片)是诺华公司开发的用于射血分数降低的慢性心力衰竭的组合药物,为沙库巴曲(sacubitril)和缬沙坦(valsartan)以1:1比例形成的三钠半五水超分子络合物1的口服制剂。该药物于2015年7月获FDA批准上市,有分析机构预测其全球销售额将高达100亿美元2。如此广阔的销售前景,使得诺欣妥仿制药市场成了中国药企的竞争高地。目前,恒瑞医药、江苏豪森、正大天晴、信立泰、万邦医药、四环制药、先声药业、复星医药、千金湘江药业等10余家公司均关注过沙库巴曲/缬沙坦(盐)组合药物的研制3。2018年,诺欣妥在华获批上市不足一年的时间里,其核心专利之一ZL201110029600.7(CN102091330B),即包含(i)缬沙坦或其盐和(ii)沙库巴曲或其盐的药物组合物却遭遇滑铁卢,被中国专利复审委员会宣告全部无效。
药物从上市到达销售峰值一般需要4-8年甚至更长时间,诺欣妥于2017年7月才获CFDA批准上市,中国市场尚未成熟铺开,核心专利若被无效,意味着首家仿制企业将获得绝佳的市场窗口期,谁获得了首仿资格,谁就是潜在的市场赢家。作为原研企业的诺华公司,围绕诺欣妥也进行了大量的专利布局,这其中又有何策略,又能为我国药企能提供哪些借鉴?
一、诺华诺欣妥专利布局
LCZ696为沙库巴曲(sacubitril)和缬沙坦(valsartan)以1:1比例形成的三钠半五水超分子络合物,该药物用于慢性心力衰竭。FDA的Orange book共列出了6件美国专利(US7468390B2、US8101659B2、US8404744B2、US8796331B2、US8877938B2、US9388134B2),其对应两个专利族(WO2003/059345A1和WO2007/056546A1)。WO2003/059345A1主要涉及包含沙库巴曲和缬沙坦的药物组合物,WO2007/056546A1则包括了沙库巴曲和缬沙坦钠三钠半五水超分子络合物。
事实上,诺华围绕诺欣妥所进行的专利布局,远不止这两件。截至2018年2月诺华公司围绕诺欣妥至少申请了23项PCT专利申请(截止2018年2月8日公开的数据)(参见图1),布局的主题包括药物组合物、复合物(络合物)、制剂、沙库巴曲类似物、沙库巴曲盐、其他联合、医药用途以及沙库巴曲中间体(参见图1)。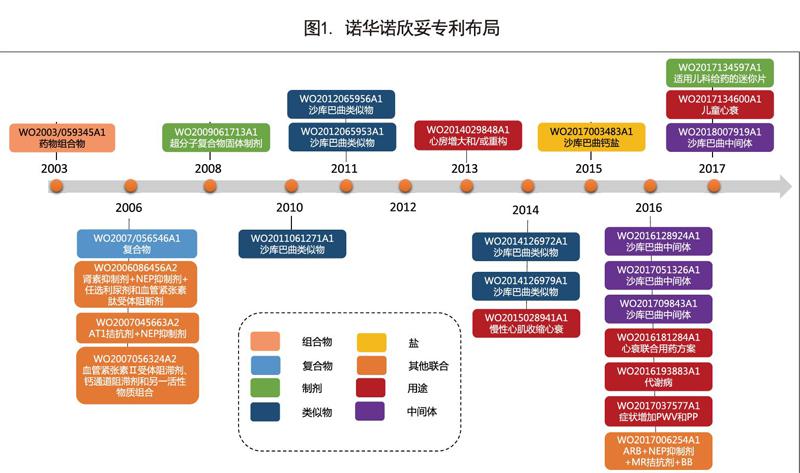
在这些专利申请中有一部分是紧密围绕着诺欣妥产品所构建的,例如核心专利药物组合物(WO2003/059345A1)、沙库巴曲和缬沙坦钠三钠半五水超分子络合物(WO2007/056546A1)、超分子复合物的固体制剂(WO2009/061713A1)、诺欣妥核心适应症心衰在机理(心房增大和/或重构)、症状(增加PWV和PP)、细分病种(慢性心肌收缩心衰)以及给药方案方面的用途(WO2014029848A1、WO2017037577A1、WO2015028941A1和WO2016181284A1)。
而更多的申请则是外围专利,这些外围专利主要包括三类:第一类为围绕着诺欣妥扩展患者和由此开发的新剂型,如WO2017134600A1涉及库巴曲和缬沙坦联合治疗儿童心衰,而WO2017134597A1则涉及通用儿科给药的迷你片,该信息反映出诺华围绕库巴曲和缬沙坦的组合很可能在开发儿科药物。第二类则涉及沙库巴曲类似物(WO2011061271A1、WO2012065956A1、WO2012065953A1、WO2014126972A1以及WO2014126979A1)及沙库巴曲(包括结构类似物)中间体(WO2016128924A1、WO2017051326A1、WO201709843A1以及WO2018007919A1),由第二类专利中解读出的信息为:诺华一直在优化组合药物中的活性成分,沙库巴曲是其主要优化的活性要素。第三类则涉及其他的替代性联合用药,如基于其他AT1拮抗剂与NEP抑制剂的联合用药(WO2006086456A2、WO2007045663A2),基于血管紧张素Ⅱ受体阻滞剂、钙通道阻滞剂和另一活性物质组合(WO2007056324A2),以及ARB+NEP抑制剂+MR拮抗剂+BB的组合(WO2017006254A1)等。第三类专利似乎反映出的是诺华寻求新联合用药的研发探索,然而分析其专利布局的策略,可以发现也不尽然,第三类专利布局自有其特定的目的。
二、如何利用专利进行防御性公开
笔者在进行布局研究中,发现了一个与众不同的专利(WO2007045663A2),该PCT申请除了国际公开文本WO外,没有任何国家的同族。这与诺华公司布局的其他专利(进入多个国家和地区)策略是不同的(不包括近30个月申请的专利)。
WO2007045663A2的权利要求1请求保护一种药物组合物,包含(i)选自坎地沙坦、依普罗沙坦、厄贝沙坦、氯沙坦、沙普利沙坦、他索沙坦、替米沙坦或在任何情况下药学可接受的盐的AT1受体拮抗剂;(ii)NEP抑制剂或其药学可接受的盐,和药学可接受的载体。在权利要求2中则限定了选择多种具体的NEP抑制剂的化合物,而在权利要求3中则具体限定了NEP抑制剂为沙库巴曲或其盐等化合物。仔细对比该专利与核心专利WO2003/059345A1,笔者发现两篇专利不论在权利要求构建还是说明书描述上均十分相似,不同的仅在于该专利中联合NEP抑制剂的AT1抑制剂为坎地沙坦、依普罗沙坦、厄贝沙坦、氯沙坦、沙普利沙坦、他索沙坦、替米沙坦或在任何情况下的药学可接受的盐,而核心专利WO2003/059345A1的AT1抑制剂为缬沙坦。
联合用药类药物,例如钙拮抗剂联合ACEI,ARB联合利尿剂均是将不同抗高血压作用机理的药物联合使用。而诺欣妥则是将具有AT1抑制作用的纈沙坦和NEP抑制剂沙库必曲联合。诺欣妥如此广阔的市场前景会吸引大量的研发者进行me-too药物的研发,其它研发者很容易想到采用其他的AT1受体拮抗剂替代缬沙坦与NEP抑制剂联合使用。
医药行业对于专利的依赖性是极强的,行政审批的鼓励政策赋予药品专利更大的垄断价值,若联合使用的me-too药物组合不能获得专利的保护,医药公司开发该项目的热情将大打折扣,诺华公司通过WO2007045663A2进行防御性公开,其目的就在于防止他人基于更换AT1拮抗剂的思路开发类似的联合药物并获得专利。诺华公司通过防御性公开增大了其它人开发有自主知识产权的me-too,me-better药物的难度,这种行为看似是专利行为,实际则是市场的竞争行为。
然而,防御性公开也是一把双刃剑,这种公开所提高的专利获取的门槛不仅会针对竞争者,也会成为原研药自己改进获取专利权的阻碍。因此,在使用防御性公开这一策略时,需要科学地设置公开的内容,既要使其起到防御性公开的目的,又要使其不至影响自身后续研发成果获得专利保护。
防御性公开专利申请WO2007045663A2(申请日为2006年10月17日)虽然对申请日以前的已知技术的专利获权具有一定杀伤力,但却难以阻止申请日之后发展起来的改进性技术。阿利沙坦酯是氯沙坦的类似物,是信立泰药业开发的1.1类新药,该药物于2012年获的新药证书,信立泰药业正致力于诺欣妥me-better药物阿利沙坦酯与沙库必曲的开发4,并申请了包括阿利沙坦酯/沙库必曲的药物组合物专利。此外,药品注册数据显示:四川青木制药有限公司和成都苑东药业研制了沙库巴曲缬沙坦盐的新共晶体,并向CFDA申请了2.1类新药,中国药企已经从快速跟仿发展到仿创结合;也许未来不久中国医药企业会开发出效果更优的AT2抑制剂联合NEP抑制剂的me-better复合物,走上破防立创的发展之路。
诺欣妥无效事件折射出的是知识产权强保护下,仿制药企业对于抢仿前进行专利挑战达成的普遍共识,同时也反映出中国药企不断提升的专利规则运用能力。中国医药企业很快会开发出效果更优的AT2抑制剂联合NEP抑制剂的me-better复合物,走上破防立创的发展之路。那么,联合用药型技术又该如何进行专利布局呢?
三、联合用药(疗法)如何布局专利
联合用药产品/联合疗法通常是将两种或多种已知的药物/疗法联合使用,实现疗效的叠加或副作用的降低等效果。艾滋病治疗的鸡尾酒疗法是典型的联合用药,如Atripla就是将三种抗病毒药物依非韦伦、恩曲他滨和替诺福韦酯联合使用来治疗艾滋病,鸡尾酒疗法的应用可以减少单一用药产生的抗药性,最大限度地抑制病毒的复制,使被破坏的机体免疫功能部分甚至全部恢复,从而延缓病程进展,延长患者生命,提高生活质量5。组合药物控制心脑血管疾病也是联合用药的典范, 例如辉瑞的药物“多达一”就是将氨氯地平和阿托伐他汀钙联合,实现同时降血压和降胆固醇的作用。
联合用药型药物与单活性化药的专利布局有很多相似之处,其专利布局的主题除了包括化合物、化合物晶型、化合物中间体、化合物制备方法、化合物中间体、药物制剂、制药用途这些常规主题外,还包括其特有的主题,如联合使用的药物组合物、药包、药盒、组合药物以及活性成分形成的络合物(复合物)等。
药物组合物是最为核心的专利,专利族WO2003/059345A1的权利要求1请求保护的就是一种药物组合物,其包含(i)AT1拮抗剂缬沙坦或其药学可接受的盐和(ii)NEP抑制剂或其可药用盐及可药用载体。在从属权利要求中进一步限定NEP抑制剂的种类,例如从属权利要求3中限定了NEP抑制剂可为沙库必曲,除了种类外,药物组合物型专利还会对联合使用的药物的配比关系进行限定,例如限定AT1和NEP抑制剂的比例为1:1。事实上,诺华在WO2003/059345A1的权利要求中并未限定比例关系,也没有在说明书中具体公开比例关系,比例关系的限定是出现在WO2007/056546A1,即1:1的比例作为发明点的特征之一出现在权利要求中。技术信息有梯度有安排的公开有利于产品核心专利的布局。除了药物组合物外,联合用药型药物的主题还常涉及药包、药盒,通常的撰写方式为:一种药盒,所述药盒包括A活性成分和B活性成分。不论是药物组合物也好,药包、药盒、组合药物也罢,在说明书中最好都要解释一下这些术语的范围,如:所述A成分和B成分既可以混合在一起形成单一的给药单元,也可分别独立成为给药单元,分别使用。不要小看这样一句看似无用的话,它能够准确且较大限度地定义保护范围。对于“药物组合物”这一术语,不同人有不同的理解,有人认为就是指活性A和活性B所形成的均一的不可区分的混合物,而有的人则认为药物组合物包括了A、B分别独立包装形成的药物组合。而上述那句话的解释则避免了这种争执,使得权利要求的范围清楚明了。
诺欣妥药物相比于其他联合使用的药物有些不同之处,即活性成分缬沙坦和沙库必曲形成了1:1比例的三钠半五水超分子络合物,正因为如此,诺华围绕该药物还申请了复合物专利:WO2007/056646A1请求保护双重作用的复合物,络合物形式的复合物、超分子络合物形式的复合物,从属权利要求中采用了红外光谱、X-射线粉末衍射图谱信息进行了限定。这是比较特殊的情况,因为不是所有联合使用的药物都会以络合物的形式存在,很多時候A成分和B成分在一起稳定性会下降,需要使用药剂手段将二者分离,此时,基于稳定性考虑所采用的制剂及制剂工艺也可成分联合用药型专利技术的布局点。
说到诺欣妥无效案件,就绕不过一个问题,那就是联合用药的协同作用试验结果的披露,CN102091330B说明书记载:缬沙坦和NEP抑制剂的组合获得了比单独给予缬沙坦、ACE抑制剂或NEP抑制剂所获得的疗效更高的疗效并且出现的血管性水肿低于单独给予血管肽酶抑制剂时所观察到的血管性水肿。除此之外,说明书中还记载:醋酸脱氧皮质酮-盐大鼠(DOCA-盐)和自发性高血压大鼠模型的试验方法、给药方案等,并断言性地记载所获得的结果表明本发明的组合具有意想不到的治疗作用,但并未给出任何试验数据来证实此意想不到的效果。正是因为缺乏用于证明预料不到技术效果的试验数据,ZL201110029600.7(CN102091330B)因为常规的组合物发明不具备创造性被宣告无效。
实验数据和结果对于证明药物效果发挥着决定性作用,实验结论则建立在实验数据的统计分析结果基础之上。专利中虽然公开了动物模型、给药方法、每日剂量、检测指标等实验方法,以及实验结论“所获得的结果表明本发明的组合具有意料不到的治疗作用”,但这些不代表实验数据或结果。医药是数据依赖性极强的实验性学科,没有数据,便没有真相。客观的实验数据是证明完成的标志,已完成的发明的公开换得专利的保护才是公平的。因此,效果证明数据是联合用药型专利获得权利的必要条件。问题在于,什么样的效果实验才是获得授权的良好保障?笔者曾审查过大量的联合药物型专利申请,其中部分联合用药有着完备的实验数据,假设现有技术并未公开活性成分A和B的组合,也没有教导A所属类别的药物和B类药物的联合会出现协同或更优的效果,如果该专利说明书数据所代表的结果是预料不到的,如出现了1+1>2的情况,也就是我们常说的协同效果,那么联合用药的创造性高度较容易被认可;相反若仅是出现了1+1>1的情况,是否能被授权就要细致分析发明的构思了。
专利布局始终都不仅是如何选择保护主题的问题,而是真正基于技术的创新与效果的大幅改进来如何进行有效保护的问题,然而,技术的演进也使得联合用药(疗法)的专利布局需要新的策略,如近期,医药巨头罗氏将携手明星公司凯特,将CAR-T技术与其PD-1抗体联合,双剑合璧以治疗淋巴瘤6。如何对疗法与药物的联合进行专利保护,我们需要更多的思路。

