320排CT单能量去金属伪影技术用于内脏动脉瘤弹簧圈栓塞术后随访的应用研究
侯凯, 吕鹏, 唐启瑛, 陆秀良, 顾君英, 曾蒙苏
随着血管造影及介入技术的发展,经血管腔内弹簧圈栓塞内脏动脉瘤的治疗方法已在临床上得到广泛应用,患者术后主要通过CT血管成像进行随访,但在常规CT图像上由于线束硬化和光子饥饿效应的影响,使得弹簧圈周围产生明显的条带状伪影[1],严重影响对瘤体周围结构的观察和术后疗效的评估。近些年来虽有一些去金属伪影(metal artifact reduction,MAR)技术如能谱CT和双能CT等[2-3]应用于临床,但多数应用仅局限于技术层面的探讨,真正能应用于临床实践的相关研究相对较少。本文主要探讨320排单能量CT的去金属伪影(single energy metal artifact reduction,SEMAR)技术对内脏动脉瘤弹簧圈栓塞术后疗效评估的临床应用价值。
材料与方法
1.研究对象
选择2014年7月-2015年7月复旦大学附属中山医院已行内脏动脉弹簧圈栓塞术的24例患者,男18例,女6例,年龄24~84岁,平均(61±11)岁;其中22例为脾动脉瘤,2例为肝动脉瘤。所有患者均于术后3~6个月在本院行内脏动脉CT血管成像检查。
2.CT检查方法
使用,Toshiba Aquilion ONE 320排CT机。扫描参数:120 kVp,75~375 mAs,0.5 s/r,层厚0.5 mm,视野16 cm×16 cm,矩阵512×512。使用双筒高压注射器经上肢静脉注射非离子型对比剂碘比乐(370 mg I/mL),剂量1.0~1.2 mL/kg,注射流率3~4 mL/s;随后推注20~30 mL生理盐水。在腹腔干水平于腹主动脉腔内设置ROI作为阈值监测点,阈值设定为150 HU,采用自动触发技术,达到阈值后延迟3s启动扫描。扫描完成后每例患者的数据进行两次容积重建,一次使用自适应迭代重建算法,另一次使用迭代重建联合SEMAR算法;标准软组织算法(FC08)。
3.图像分析
由2位高年资放射科医师采用4分法分别评价使用(A组)和未使用AEMAR技术(B组)的CTA重建图像的图像质量,评价结果不一致时,请第三位有经验的更高年资放射科医师评分得出结果。取两组中多个感兴趣相同层面进行评价,评价内容包括:瘤体内对比剂充填和血栓形成情况、动脉瘤体的大小、载瘤动脉和出瘤动脉和正常器官的血供情况。评分标准[4]:1分,伪影完全与组织器官重叠,无法辨认正常结构;2分,伪影与组织器官重叠较多,辨认结构困难;3分,伪影与组织器官重叠较少,辨认结构容易;4分,几乎无伪影干扰,能明确辨认组织器官的结构。去除4例由于放射状伪影完全遮盖动脉瘤瘤体、无法辨别瘤体边缘的病例,测量其余20例患者的使用和未使用去伪影技术图像上瘤体的最大内径。
4.统计学方法
使用SPSS 20.0统计分析软件。对两组图像上瘤体内对比剂充填和血栓形成情况、载瘤动脉和出瘤动脉的显示情况、周围脏器的图像质量和去伪影前后瘤体最大直径的比较,在满足参数检验的条件下采用配对t检验,不满足参数检验条件则采用Wilcoxon符号秩检验。以P<0.05(双侧)为差异有统计学意义。观察者间一致性的评估采用组间相关系数法。
结 果
两组图像上瘤体内对比剂充填和瘤体内血栓形成情况、载瘤动脉、出瘤动脉和周围脏器的显示情况的评分结果见表1、图1~4。去伪影后的图像质量评分明显高于去伪影前,两组间的差异有统计学意义(P<0.01)。去伪影后测得的瘤体直径小于去伪影前,两组间差异有统计学意义(P<0.01)。两位观察者对瘤体、载瘤动脉、出瘤动脉和周围脏器的显示情况的评分结果间一致性良好,组间相关系数均>0.80。
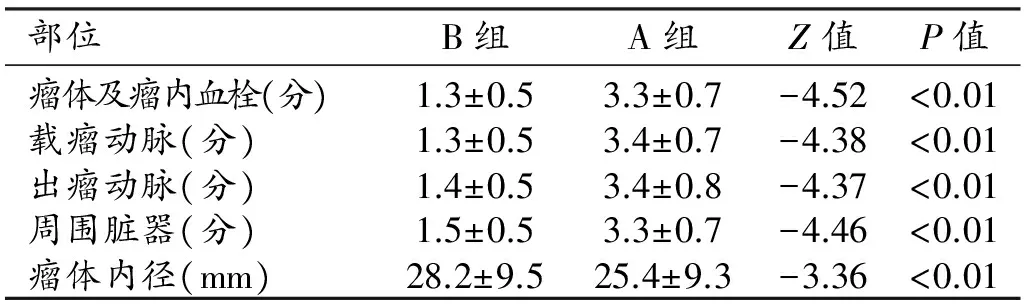
表1 两组图像质量评分及瘤体内径的比较
讨 论
内脏动脉瘤(visceral artery aneurysms,VAAs)的发病率仅次于腹主动脉瘤和髂动脉瘤,为0.09%~2.00%[5-7],瘤体一旦破裂出血,死亡率高达20%~75%[8-9]。目前临床上主要采用经血管腔内弹簧圈栓塞术治疗VAAs[10]。内脏动脉瘤的栓塞术除了将瘤体填塞,关键在于还需将瘤体远近端动脉及其它可能供应瘤体的侧支血管栓塞,才能保证瘤体完全栓塞,降低动脉瘤复发和破裂的发生率。近脾门处脾动脉瘤的栓塞,发生多节段脾脏梗死的风险将升高[11]。对于较大内脏动脉,瘤体填塞多采用是部分填塞法,这种方式有助于血栓形成,故应重点关注入瘤动脉及出瘤动脉的栓塞,若不能完全栓塞,那么残余瘤腔是导致术后VAAs瘤体增大的一个潜在风险[12-13]。

图1 近腹腔干脾动脉瘤弹簧圈栓塞术后6个月CT复查。a) SEMAR技术VR图像,瘤体部位伪影明显减轻,周围血管清晰可辨; b) 未使用SEMAR技术的VR图像,瘤体部位伪影明显,影响对周围血管的观察; c) SEMAR技术横轴面图像,伪影明显减轻,清晰显示瘤体内完全血栓化,瘤体周围血管和脏器均可清晰辨认; d) 未使用SEMAR技术的横轴面图像,有大量伪影,影响对瘤体内和周围组织的观察。 图2 近端脾动脉瘤弹簧圈栓塞术后3个月CT复查。a) SEMAR技术VR图像,瘤体部位未见明显金属伪影,周围血管清晰可辨; b) 未使用SEMAR技术的VR图像,瘤体部位伪影明显,影响对周围血管观察; c) SEMAR技术横轴面图像,未见明显金属伪影,清晰显示瘤体内对比剂充填,瘤体周围血管和脏器可清晰辨认; d) 未使用SEMAR技术的横轴面图像,大量伪影影响对瘤体内和周围组织的观察。
对VAAs进行术后影像学随访是非常必要的,主要观察瘤体内是否完全形成血栓,以及载瘤动脉、出瘤动脉和正常器官的血供情况等。虽然临床上DSA是内脏动脉瘤栓塞术后随访的金标准,但因其为有创检查,且手术时间久、费用高,难于广泛应用[14-15]。目前临床上主要采用CT扫描来替代,其中普通CT扫描最为常用,但由于金属硬化效应产生条带状伪影[1],严重影响对瘤体周围结构的观察和术后效果的评估。虽国外亦有文献报道磁共振血管成像(MRA)技术在内脏动脉弹簧圈栓塞术后随访中有较好的观察效果[16-17],但此技术目前在国内的临床应用较少。
近年来,随着CT各大厂商推出去金属伪影(MAR)技术,包括能谱CT和双能CT等[2-3],使得CT图像上金属周围结构的成像质量得到很大地改善,但关于双能量MAR技术的最优kVp的选择,目前还未达成共识[18]。此外,可能影响双能量MAR技术的有效性的相关因素,如患者的体形、假体构成和双能量采集方法(如双电源,三明治探测器,快速千伏开关)的具体机制尚未完全阐明[18-19]。本文主要探讨东芝320排容积CT推出的迭代算法联合单能量射线金属去伪影技术(SEMAR)在内脏动脉瘤弹簧圈栓塞术后复查中的应用。

图3 近脾门脾动脉瘤弹簧圈栓塞术后3个月CT复查。a) SEMAR技术MIP图像,瘤体部位未见明显金属伪影,周围血管清晰可辨; b) 未使用SEMAR技术的MIP图像,瘤体部位伪影明显,影响对周围血管的观察; c) SEMAR技术横轴面图像,未见明显金属伪影,清晰显示瘤体内对比剂部分充填,瘤体周围血管和脏器可清晰辨认; d) 未使用SEMAR技术的横轴面图像,大量伪影影响对瘤体内和周围组织的观察。 图4 近脾门脾动脉瘤弹簧圈栓塞术后1年CT复查。a) SEMAR技术横轴面图像,可见少量金属伪影,清晰显示瘤体内完全血栓化,瘤体周围血管和脏器可清晰辨认; b) 未使用SEMAR技术的横轴面图像,大量伪影影响对瘤体内和周围组织观察。
传统的减轻金属伪影的方法主要有以下几种:①加大CT扫描的管电压,提高射线的穿透力;②提高扫描的管电流,即增加射线量;③采用薄层扫描技术来减少部分容积效应,并尽量使金属植入物的长轴方向垂直于扫描平面,使之产生最小的横断面积;④在图像重建方面,采用标准平滑的滤过函数,并适当增大窗宽[20]。前三种方法主要利用高千伏、高毫安、长时间曝光方式减轻金属伪影,直接加大患者接受的辐射剂量,而第四种方法相较于最近流行的迭代重建算法,患者接受的kV、mA等参数一般较高。
SEMAR技术的基本思想主要是基于滤波反投影(filtered back projection,FBP)的一种算法[4],首先将金属轨迹分割出来,再用周围未受伪影影响的体素测量值对受伪影影响的部分进行线性内插,然后将其反投影到金属轨迹中,线性整合出物体的完整轮廓,最后用线性基线转换方式使融合的图像更接近原始图像。SEMAR技术在整个金属去伪影过程中多次应用迭代重建算法,迭代重建算法能够在保证图像的质量下,采用低千伏低毫安的扫描参数扫描,大幅降低患者接受的辐射剂量。
本研究显示,SEMAR技术的应用对载瘤动脉、出瘤动脉和正常器官血供情况的显示都有明显改善,其中对瘤体内对比剂分布和血栓形成情况的改善尤为突出。本研究中24例患者的CTA图像在使用了SEMAR技术后,瘤体内均可以观察到对比剂的流入和血栓形成情况;而在未去除伪影的图像中,只有2例患者的瘤体内可以观察到瘤腔内有少量对比剂显影。而且这2例患者都是瘤体较大的脾动脉瘤患者,弹簧圈栓塞手术中只对瘤体进行了部分填塞,在SEMAR重建图像上可以观察到瘤腔内有大量对比剂的流入,同时可以诊断瘤腔再通情况。其余22例患者的未使用SEMAR技术的重建图像上,因弹簧圈产生的大量放射状伪影,很难辨别瘤体内的结构,而且对载瘤动脉和出瘤动脉结构的观察影响也很大。若瘤体靠近脾脏附近,因为瘤体内弹簧圈的大量放射状伪影,影响了对脾脏的观察,无法诊断脾脏是否发生了节段性梗死。而在SEMAR重建图像上,基本消除了弹簧圈产生的放射状伪影,瘤体周围的血管和脏器显示清晰,充分提高了这类患者随访的诊断准确性。
但SEMAR技术也并非对所有患者去金属伪影的效果都能达到满意效果,若内脏动脉瘤瘤体较大,术中填塞的弹簧圈比较多,同样的扫描条件下并不能明显改善去伪影的效果。主要原因可能是射线由于金属衰减过多,探测器接收到的射线过少,导致放射状伪影的残留。此问题需要今后进一步优化CT扫描参数,逐步改进。
本研究中,在未去除伪影的图像上,辨别瘤体边缘结构时存在一定难度,部分病例因弹簧圈数量较多,大量放射状伪影完全遮盖瘤体,导致无法辨别瘤体边缘,因此不能对瘤体直径等进行准确测量。而瘤体部分被伪影干扰的病例也会因为瘤体边缘不清,在测量瘤体最大内径时会误将瘤体边缘的伪影测量在内,导致测量的数据相对于去伪影图像上的测量数据明显偏大。而采用SEMAR技术后,所有患者的瘤体边缘结构可准确辨认,因而能更加准确地测量瘤体内径。尤其是对于随访中发现瘤体内血流再通的患者,做好瘤体内径的随访记录,为日后是否有必要进行二次手术提供重要依据。
本次研究的不足之处主要就是样本量较小,今后还需要通过更多的样本量进行更深入的研究。其次,本研究仅仅是对CTA的两种重建算法获得的内脏动脉瘤弹簧圈栓塞术后图像质量进行比较,虽然使用了SEMAR技术后图像质量有明显改善,但由于本研究缺少DSA检查这一金标准作为对照,SEMAR算法下的影像并不能完全确定内脏动脉瘤弹簧圈栓塞术后随访的各项指标与体内真实情况是否完全一致。因为使用了SEMAR技术的CTA图像上还是存在少量伪影,而且使用了SEMAR算法的图像上还可能存在原始信息的丢失等。
综上所述,东芝320排CT机结合SEMAR技术对于内脏动脉瘤弹簧圈栓塞术后瘤体内对比剂充填和血栓形成情况、载瘤动脉、出瘤动脉和正常器官的血供情况等的评估都具有较高的应用价值。并且SEMAR技术还有一个优势就是它是一种后处理的算法,可以对所有普通容积扫描的数据进行去金属伪影,因此即使在扫描前未了解患者体内是否有金属植入物,也可以在后处理时进行去金属伪影的操作。这一优势大大提高了这项技术的适用范围,比如常规采用容积扫描的冠脉CTA和颅内CTA检查。笔者相信此技术在CT检查过程中对有效去除金属硬化效应具有良好的应用前景。
参考文献:
[1] Barrett JF,Keat N.Artifacts in CT:recognition and avoidance[J].Radiographics,2004,24(6):1679-1691.
[2] 赵艳娥,宁辉,郑玲,等.双能量CT虚拟单能谱成像技术在脑动脉瘤夹闭术后评估中的应用[J].放射学实践,2014,29(9):988-992.
[3] 徐康洁,郭小超,刘建新,等.双能量CT虚拟单能量重建技术显示肝癌TACE术后碘油沉积的价值[J].放射学实践,2016,30(4):321-325.
[4] Gondim TP,Meyer JB,Baumann C,et al.Total hip prosthesis CT with single energy projection based metallic artifact reduction:impact on the visualization of specific periprosthetic soft tissue structures[J].Skeletal Radiol,2014,43(9):1237-1246.
[5] Carmeci C,McClenathan J.Visceral artery aneurysms as seen in a community hospital[J].Am J Surg,2000,179(6):486-489.
[6] Carroccio A,Jacobs TS,Faries P,et al.Endovascular treatment of visceral artery aneurysms[J].Vasc Endovaseular Surg,2007,41(5):373-382.
[7] Kalko Y,Ugurlucan M,Basaran M,et al.Visceral artery aneurysms[J].Heart Surg Forum,2007,10(1):4-9.
[8] Shanley CJ,Shah NL,Messina LM.Common splanchnic artery aneurysms:splenic,hepatic,and celiac[J].Ann Vasc Surg,1996,10(3):315-322.
[9] Wagner WH,Allins AD,Treiman RL,et al.Ruptured visceral artery aneurysms[J].Ann Vasc Surg,1997,11(4):342-347.
[10] Ikeda O,Tamura Y,Nakasone Y,et al.Nonoperative management of unruptured visceral artery aneurysm:treatment by transcatheter coil embolization[J].J Vasc Surg,2008,47(6):1212-1219.
[11] Jia X,Liu XP,Guo W,et al.The endovascular management of splenic artery aneurysms and pseudoaneurysms[J].Vascular,2011,19(5):257-261.
[12] Cho YD,Park JC,Kwon BJ,et al.Endovascular treatment of largely thrombosed saccular aneurysms:follow-up results in ten patients[J].Neuroradiology,2010,52(8):751-758.
[13] Marone EM,Mascia D,Kahlberg A,et al.Is open repair still the gold standard in visceral artery aneurysm management[J].Ann Vasc Surg,2011,25(7):936-946.
[14] Etezadi V,Gandhi RT,Benenati JF,et al.Endovascular treatment of visceral and renal artery aneurysms[J].J Vasc Interv Radiol,2011,22(9):1246-1253.
[15] Tulsyan N,Kashyap VS,Greenberg RK,et al.The endovascular management of visceral artery aneurysms and pseudoaneurysms[J].J Vasc Surg,2007,45(2):276-283.
[16] Koganemaru M,Abe T,Nonoshita M,et al.Follow-up of true visceral artery aneurysm after coil embolization by three-dimensional contrast-enhanced MR angiography[J].Diagn Interv Radiol,2014,20(2):129-135.
[17] Iryo Y,Ikushima I,Hirai T,et al.Evaluation of contrast-enhanced MR angiography in the follow-up of visceral arterial aneurysms after coil embolization[J].Acta Radiologica,2013,54(5):493-497.
[18] Yu L,Christner JA,Leng S,et al.Virtual monochromatic imaging in dual-source dual-energy CT:radiation dose and image quality[J].Med Phys,2011,38(12):6371-6379.
[19] Vrtiska TJ,Takahashi N,Fletcher JG,et al.Genitourinary applications of dual-energy CT[J].AJR,2010,194(6):1434-1442.
[20] Bergin P,Rezaei S,Lau Q,et al.Dermatofibrosarcoma protuberan,magnetic resonance imaging and pathological correlation[J].Australas Radiol,2007,51(Supple 1):S64-S66.

