一种用于铁质文物保护的席夫碱缓蚀剂的制备及应用性能对比研究
王景勇,贾 淼,马菁毓,贾梦秋
(1. 河北省文物保护中心,河北石家庄 050031; 2. 北京化工大学,北京 100029;3. 中国文化遗产研究院,北京 100029)
0 引 言
中国是世界上最早创造并逐步开展铸铁制造技术的国家之一,由于铁更加坚硬锋利,因此逐渐取代青铜器成为至今为止应用最为广泛的金属,但由于铁的性质活泼,极易遭受外界环境的侵蚀[1]。因此不断研究铁器的腐蚀与防护机理,并使用一定的方法对其进行防护,对我国文物保护工作具有重要的意义。
缓蚀剂是一种通过少量的加入就能显著地降低金属腐蚀速度的防腐蚀化学品,具有使用方便、经济有效的特点[2]。目前已经有许多缓蚀剂在文物保护中得到广泛应用,BTA等缓蚀剂在用作铁缓蚀剂时有良好的效果,复配后缓蚀效率更是有所提升,但单独使用时不耐高温,且毒性大[3];咪唑啉类化合物作为一类低毒、高效的缓蚀剂,它能够很好地抑制和减缓金属腐蚀,但其制备过程能耗高、原料利用率低、产率低,且会改变金属表面的颜色[4];钼酸盐是一种常用的的溶液缓蚀剂,钼酸盐的毒性极低,且能够在较高温度下仍旧保持良好的缓蚀效果,还能够有效地预防微生物的滋生,属于环境友好缓蚀剂。同时可通过与铁离子发生作用形成钝化膜从而对抑制孔蚀也有显著的作用[5]。但钼酸盐只有在达到较高浓度时才能有良好的缓蚀效果,浓度较低反而会加速腐蚀反应的发生[6];单宁酸也是常用的铁缓蚀剂,由于单宁分子中有多类具有亲水性、表面活性、络合能力及吸附分散能力等的活性官能团,因而可在水处理过程中作为缓蚀剂、阻垢剂等使用性能较好[7],但对裸钢的缓蚀效果不高主要针对带锈文物的防护,且易在文物表面着色,无法保持文物的原貌[8];而近年兴起的席夫碱缓蚀剂则综合了传统缓蚀剂的优点,由于其分子中含有碳氮双键从而具有良好的缓蚀效果。碳氮双键中既含有电负性高的氮原子可以提供孤对电子,又含有可以提供π键与空轨道的双键结构,极易与金属表面发生吸附反应从而形成防护膜层[9]。席夫碱还含有苯环结构,吸附性能好,优于普通长链结构的缓蚀剂,因而具有良好的缓蚀性能。此外席夫碱毒性低,属于环境友好型缓蚀剂[10]。
本实验通过溶剂法制备了一种席夫碱缓蚀剂,传统的溶剂法制备使用无水甲醇作为提取剂,毒性大。本实验在原有的溶剂法的基础上进行了改进,改用了无水乙醇作为提取溶剂,此外通过复配后缓蚀效率最高达到92.89%,马口铸铁模拟试样的实验结果表明席夫碱缓蚀剂可以很好地对铁质文物提供保护,是一种环保无毒的新型文物缓蚀剂。此外还与钼酸盐缓蚀剂以及Fertan缓蚀剂(主要成分为单宁酸)的性能进行了对比,从而选出性能最优的缓蚀剂应用于文物保护中。
1 试 验
1.1 试验药品及仪器
无水乙醇、乙酸乙酯、丙酮、三乙醇胺、Fertan、硅酸钠、钼酸钠、钼酸铵、磷酸二氢锌、甘氨酸、氢氧化钾、肉桂醛、氢氧化钠、氯化钠、氯化锌等均为分析纯。三口烧瓶、蛇形冷凝管、温度计、电子天平、autolab电化学工作站、VHX-2000型超景深三维显微系统、NEXUS 670FT-IR型红外光谱仪、ZSBB-712型恒温水浴锅、JJ-1型定时搅拌器。
1.2 席夫碱的制备
实验步骤:圆底烧瓶中将甘氨酸、氢氧化钾50℃热溶于无水乙醇,搅拌反应2h,直到烧瓶底部固体不再减少,停止反应,冷却,减压抽滤。将得到的溶液转移至三口瓶中,通入氮气保护。室温滴加肉桂醛,加热至60℃回流1h,室温放置反应30min有白色固体析出,保温反应2h。过滤,丙酮洗涤固体至白色,真空干燥,得肉桂醛氨基酸席夫碱[11]。
合成反应式:

合成最终产物为白色粉末,使用时按比例将其溶于乙醇:乙酸乙酯=1:1的溶剂中。
1.2.1红外分析[12]将产物进行红外分析,谱图见图1。由图1可见,在1585.2cm-1处出现了-C=N-的震荡吸收峰,1450~1600cm-1左右出现了苯环的骨架震动吸收峰,3286.5cm-1处出现了-N-H-的弯曲震动峰,可以证明最终合成的产物为席夫碱。
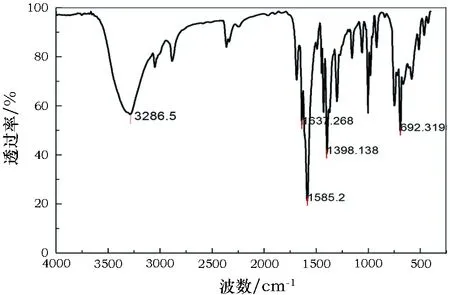
图1 席夫碱的红外光谱Fig.1 IR spectroscopy of Schiff base
1.2.2席夫碱缓蚀剂的复配 与其他缓蚀剂相同,席夫碱与其他缓蚀物质之间存在协同效应,可大大提高缓蚀效果[13]。本实验选取以下三种配方进行复配,刘铮等[14]研究表明席夫碱与钼酸钠之间存在协同效应,且当二者比例为2∶1时性能最好;此外张捍东[15]以钼酸钠为主剂进行了复配,本实验仿照此配方对席夫碱进行复配,并对复配后的缓蚀剂性能进行了电化学检测:
① 席夫碱∶钼酸钠=2∶1,以下简称为1号;
② 席夫碱∶硅酸钠∶磷酸二氢锌∶三乙醇胺=5∶5∶1∶180,以下简称为2号;
③ 席夫碱∶硅酸钠∶磷酸二氢锌∶三乙醇胺=10∶5∶1∶225,以下简称为3号。
1.3 钼酸盐复配缓蚀剂的配制
钼酸盐在单独使用时用量较大,成本较高,因此常将其与其他试剂复配使用[6],既可提高缓蚀效果,又能够降低成本。采用张捍东[15]等以钼酸钠为主剂进行了复配,并与其他缓蚀剂进行了性能对比:
配方:钼酸铵∶硅酸钠∶磷酸二氢锌∶三乙醇胺=5∶5∶1∶225。
1.4 缓蚀剂性能检测
1) 红外分析。利用NEXUS 670FT-IR型红外光谱仪对合成的样品进行定性分析,环境温度为25℃,环境湿度为50%。
2) 表面锈蚀程度分析。①采用盐雾实验对试样进行处理,盐雾试验是一种常见的环境试验,是用来表征试样耐盐雾性能的方法[16],将试验片放置于10%盐雾环境中一个月后观察实验现象;②进行乙醇腐蚀试验。进一步对缓蚀剂的性能进行检测;将乙醇、去离子水按质量比为92.2∶7.8,使用ZnCl2调节溶液氯离子含量为10mg/L,配制成混合溶剂[17]。在文物保护中缓蚀剂、封护剂等使用的溶剂大多为乙醇,乙醇作为极性溶剂,极化率大,导电性高,较易自身进行电离成为电解质溶液,从而加速发生电化学腐蚀[18]。③浸泡实验。采用10%NaCl浸泡铁片48h后观察铁片的腐蚀状况及膜层的破损程度,从而判断缓蚀剂的效果。本实验利用VHX-2000型超景深三维显微系统(放大倍数为100),观察样品表面微观形貌,判断锈蚀程度[19]。
3) 电化学测试。①电化学阻抗谱(EIS),在早期的文献中称为交流阻抗[20],可判断缓蚀剂在金属表面的成膜进程、吸附行为与缓蚀效率等,实现对缓蚀剂的快速评估[21];②极化曲线测试,在电化学反应中,当外加极化电位较大时,电流密度的对数与过电位呈直线关系,将极化曲线外推,即可得到腐蚀电流密度、腐蚀电位等动力学参数。由添加缓蚀剂前后的腐蚀电流密度可以计算得出缓蚀剂的缓蚀率[22]。本实验采用autolab电化学工作站测量马口铸铁缓蚀处理后在3.5%NaCl中的交流阻抗曲线,其中工作电极为试片,辅助电极为铂电极,参比电极为饱和甘汞电极。
2 结果与讨论
2.1 盐雾实验
将马口铸铁试样浸泡缓蚀剂后放置于10%NaCl环境中,一个月后观察到的现象如下图所示。

a) 1号缓蚀剂; b) 2号缓蚀剂; c) 3号缓蚀剂; d) 席夫碱缓蚀剂; e) Fertan缓蚀剂; f) 钼酸盐复配缓蚀剂图2 盐雾试验结果Fig.2 Salt spray test results
从盐雾试验后试验片的腐蚀状态可以观察到,Fertan在铸铁表面形成蓝色薄膜,这影响了文物保护工作中修旧如旧的原则,而其他缓蚀剂均为透明膜层。1号试样表面出现许多点状腐蚀,表明席夫碱缓蚀剂与钼酸盐缓蚀剂复配后耐点蚀能力反而下降,即钼酸盐仅在较高浓度下才能抑制点蚀,否则反而会加快腐蚀的发生[6];2号试样与3号试样均只在几处出现了少量的腐蚀,但3号试样腐蚀面积略小;未经复配的席夫碱缓蚀剂的腐蚀状况优于1号缓蚀剂但与2、3号相比腐蚀区域增多,说明经过2、3号复配方案能够提高席夫碱缓蚀剂的缓蚀效率;此外,Fertan缓蚀剂与钼酸盐缓蚀剂在盐雾试验后表面局部区域均出现了大量腐蚀。盐雾实验表明3号缓蚀剂效果远远优于其他缓蚀剂,可以强烈提高席夫碱的缓蚀效率,从而更好地对金属提供保护。
2.2 乙醇腐蚀实验
乙醇作为极性溶剂,极化率大,导电性高,较易自身进行电离成为电解质溶液,从而加速发生电化学腐蚀[18],且在文物保护中缓蚀剂、封护剂等使用的溶剂大多为乙醇,乙醇溶剂极易侵入文物基体从而对文物的保存状况产生影响。因此研究缓蚀剂在乙醇中的耐蚀性能也尤为重要。将马口铸铁试样浸泡缓蚀剂后,置于乙醇、去离子水比为92.2∶7.8混合,氯离子含量为10mg/L的混合溶剂环境中,一个月后在三维视频显微镜观察到的现象。
实验表明在含一定量氯离子的的乙醇溶液中对腐蚀效果的体现更加明显,其中1、2号试样与纯席夫碱缓蚀剂相比效果稍好,但仍均出现少量锈蚀,3号试样表面依旧无锈蚀生成,钼酸盐缓蚀剂在试验后出现大片锈蚀,Fertan缓蚀剂更是出现了深坑,表明在乙醇氛围下3号缓蚀剂仍旧表现出了良好的缓蚀效果,能够有效抵御氯离子的侵蚀,从而达到保护基体的效果,这与盐雾试验得到的结果一致。

a) 1号缓蚀剂; b) 2号缓蚀剂; c) 3号缓蚀剂; d) 席夫碱缓蚀剂; e) Fertan缓蚀剂; f) 钼酸盐复配缓蚀图3 乙醇腐蚀试验结果Fig.3 Ethanol corrosion test results
2.3 浸泡实验
将马口铸铁试样浸泡缓蚀剂后,置于10%NaCl环境中浸泡48h,在三维视频显微镜下观察,结果如图4所示。

a) 1号缓蚀剂; b) 2号缓蚀剂; c) 3号缓蚀剂; d)席夫碱缓蚀剂; e) Fertan缓蚀剂; f) 钼酸盐复配缓蚀剂图4 浸泡试验结果Fig.4 Immersion test results
浸泡实验结果显示,在NaCl溶液中浸泡后1、2号试样表面膜层有破损,且出现大量向下深入的锈蚀,3号试样表面光亮,未发现膜层破损及锈蚀出现;纯席夫碱缓蚀剂腐蚀状况不明显,但膜层破损略多;Fertan缓蚀剂同样能够看出许多腐蚀痕迹,与之前实验结合表明Fertan缓蚀剂作为一种单宁酸类缓蚀剂在中性溶液中对裸钢的保护效果并不突出[23];钼酸盐缓蚀剂则仅在表面均匀的有一层锈蚀,并未向下深入,这也印证了钼酸盐缓蚀剂耐孔蚀的能力。浸泡实验与前两个实验得到了相同的实验结果。
2.4 交流阻抗实验结果
图5为利用三电极体系,腐蚀介质为3.5%NaCl时测得的阻抗图。

a) 1号缓蚀剂; b) 2号缓蚀剂; c) 3号缓蚀剂; d) 席夫碱缓蚀剂; e) Fertan缓蚀剂; f) 钼酸盐复配缓蚀剂
图5交流阻抗曲线
Fig.5AC impedance curve
交流阻抗测试的结果显示,拟合曲线的半径大小与缓蚀效果一致。由图5可知,Nyquest图呈现半圆的阻抗弧,表明缓蚀剂带有许多络合物基团,它们极易与铸铁基体发生反应从而生成了保护性膜层;席夫碱由于含有C=N双键,再加上含有的-OH极易与金属形成稳定的络合物,能够对金属表面提供很好的保护吸附作用,从而阻止了金属的腐蚀[27]。Fertan缓蚀剂与钼酸盐缓蚀剂同样具有多种亲水性络合物基团,可以预防微生物滋生,保护金属基体免遭侵蚀[8,23]。阻抗弧直径的大小直接反映了电极表面上电荷转移电阻的大小,电阻越大,腐蚀速率越小。从曲线中可以看出, 未经复配的席夫碱缓蚀剂
(d)相比Fertan缓蚀剂(e)以及钼酸盐缓蚀剂(f)已经表现出良好的效果,而经过复配的3号席夫碱缓蚀剂则相比其他缓蚀剂表现出更加优越的效果,阻抗达到原阻抗的两倍,说明经过复配后缓蚀效果大大增强。阻抗由大到小排列顺序为:3号缓蚀剂>席夫碱缓蚀剂>2号缓蚀剂>Fertan缓蚀剂>1号缓蚀剂>钼酸盐复配缓蚀剂,这与之前的腐蚀试验结果一致。
2.5 极化曲线实验结果
图6为利用三电极体系,马口铸铁模拟试验样在常温,3.5%NaCl下时使用不同缓蚀剂时得到的极化曲线,对极化曲线进行拟合得到参数如表1所示。

a) 1号缓蚀剂; b) 2号缓蚀剂; c) 3号缓蚀剂; d) 席夫碱缓蚀剂; e) Fertan缓蚀剂; f) 钼酸盐复配缓蚀剂; g) 空白
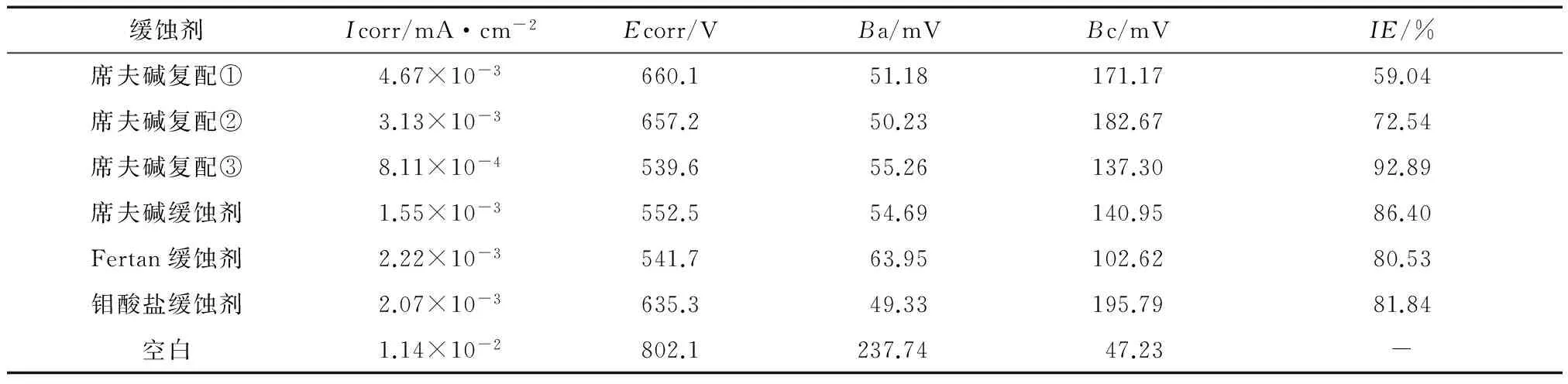
图6 极化曲线结果
利用Tafel外推法得到的缓蚀剂的腐蚀动力学参数见表1。缓蚀效率的计算公式为计算公式为η=(I0-I)/I0×100%,其中I0为空白试样的腐蚀电流密度,I为添加缓蚀剂后试样的腐蚀电流密度。由图6和表1可知,3号缓蚀剂具有最小的电流密度,1号缓蚀剂具有最大的腐蚀电流密度,这也与之前的实验结果一致,证明缓蚀剂的加入使得腐蚀电流显著降低,缓蚀效率由大到小排列为:3号缓蚀剂>席夫碱缓蚀剂>钼酸盐缓蚀剂>Fertan缓蚀剂>2号缓蚀剂>1号缓蚀剂,且3号缓蚀剂的自腐蚀电位高,因此难以被腐蚀。
极化曲线测试的结果显示,最终得到缓蚀剂的腐蚀电流及缓蚀效率,与交流阻抗结果一致,且复配后的席夫碱缓蚀剂的缓蚀效率最高达到了92.89%。
3 结 论
席夫碱是一种新型的缓蚀剂,近几年来才开始在国内兴起,本实验通过改进了传统的溶剂法制备了一种席夫碱缓蚀剂,并对其进行复配,利用协同效应使得缓蚀效率最高达到92.89%。席夫碱缓蚀剂能够保持样品的原有形貌,复配后的席夫碱缓蚀剂的缓蚀效果更是远远超过Fertan缓蚀剂。在应用方面,席夫碱缓蚀剂由于低毒、易操作,且能够很好的保护文物原貌,因此是一种性能良好的新型缓蚀剂。
通过本实验得出了三种缓蚀剂的性能对比,尽管Fertan的缓蚀性能良好,但需要从国外进口,所需周期长,且不利于维持文物的原有形貌;钼酸盐缓蚀剂作为一种传统文物保护缓蚀剂,它耐点蚀,且能维持样品原貌,但缓蚀性能相比Fertan略低;而本实验制备的席夫碱缓蚀剂既能够达到良好的缓蚀效果,又能够很好地保持文物的原始外观,且复配后缓蚀效果优异,大大超越了Fertan缓蚀剂。
综上所述,对于铁质文物的保护修复,目前已有许多防护手段,但采用的防护材料还有很多问题亟待处理,需要进一步研究。
参考文献:
[1] 许淳淳, 何海平. 铁质文物的腐蚀与防护[C]//文物保护与修复纪实—全国考古与文物保护学术会议.2004:176-186.
XU Chun-chun, HE Hai-ping. Corrosion and protection of iron artifacts[C]//Conservation and Remodeling of Cultural Relics-National Conference on Archaeological and Cultural Relics Protection. 2004:176-186.
[2] 张大全, 高立新, 周国定. 国内外缓蚀剂研究开发与展望[J]. 腐蚀与防护, 2009,30(9):604-610.
ZHANG Da-quan, GAO Li-xin, ZHOU Guo-ding. Recent progress and prospect for corrosion inhibitor science and technology[J]. Corrosion & Protection, 2009,30(9):604-610.
[3] 任晓光, 谢云峰, 罗新举,等. 苯并三唑对碳钢的缓蚀性能[J]. 石油炼制与化工, 2007,38(2):65-68.
REN Xiao-guang, XIE Yun-feng, LUO Xin-ju,etal. Corrosion inhibition performance of benzotriazole to carbon steel[J]. Petroleum Processing and Petrochemicals, 2007,38(2):65-68.
[4] 肖利亚, 乔卫红. 咪唑啉类缓蚀剂研究和应用的进展[J]. 腐蚀科学与防护技术, 2009,21(4):397-400.
XIAO Li-ya, QIAO Wei-hong. Development of imidazoline corrosion inhibitor for corrosive media[J]. Corrosion Science & Protection Technology, 2009,21(4):397-400.
[5] 路长青. 钼酸盐的缓蚀机理[J]. 材料保护, 1996(10):22-23.
LU Chang-qing. Corrosion inhibition mechanism of molybdate[J]. Materials Protection, 1996(10):22-23.
[6] 房娟娟, 许 斌. 钼酸盐缓蚀剂研究进展及发展趋势[J]. 山东化工, 2008,37(11):17-26.
FANG Juan-juan, XU Bin. Development and developing direction of molybdate inhibitor[J]. Shandong Chemical Industry, 2008,37(11):17-26.
[7] 成晓敏. 单宁酸的阻垢缓蚀机理与性能研究[D]. 太原:中北大学,2012.
CHENG Xiao-min. Inhibition mechanism and performance of tannic acid inhibition[D]. Taiyuan: North University of China,2012.
[8] 秦小玲, 刘艳红. 植物单宁在水处理中的研究与应用[J]. 工业水处理, 2006,26(3):690-695.
QIN Xiao-ling, LIU Yan-hong. Research and application of vegetable tannin in water treatment[J]. Industrial Water Treatment, 2006,26(3):690-695.
[9] 陈世亮, 刘 峥, 张小鸽. 金属表面席夫碱缓蚀剂自组装膜的制备及性能研究现状[J]. 腐蚀与防护, 2011,32(4):326-330.
CHEN Shi-liang, LIU Zheng, ZHANG Xiao-ge. Research status of preparation and properties of self-assembled monolayers of schiff Base on metal surface[J]. Corrosion & Protection, 2011,32(4):326-330.
[10] 王 强, 周桃玉. 组氨酸席夫碱的合成及其对碳钢的缓蚀性能[J]. 材料保护, 2015,48(2):33-36.
WANG Qiang, ZHOU Tao-yu. Synthesis of L-histidine schiff base and evaluation of its inhibition performance for carbon steel[J]. Materials Protection, 2015,48(2):33-36.
[11] Liu T T, Tseng Y W, Yang T S. Functionalities of conjugated compounds of Γ-aminobutyric acid with salicylaldehyde or cinnamaldehyde[J]. Food Chemistry, 2016,190:1102-1108.
[12] 钟地长. 吡啶-4-甲醛缩氨基硫脲席夫碱(L)Cu(Ⅱ),Ni(Ⅱ),Zn(Ⅱ)配合物的合成及红外表征[J]. 宜春学院学报, 2008,30(2):77-79.
ZHONG Di-chang. Synthesis, IR characterization of Cu(Ⅱ),Ni(Ⅱ),Zn(Ⅱ) complexes based on schiff base ligand derived from pyridine-4-carboxal dehyde thiosemicarbazone[J]. Journal of Yichun College, 2008,30(2):77-79.
[13] Farag A A, Hegazy M A. Synergistic inhibition effect of potassium iodide and novel schiff bases on X65 steel corrosion in 0.5M H2SO4[J]. Corrosion Science, 2013,74(4):168-177.
[14] 刘 峥, 刘二喜, 王国瑞,等. 4种自制席夫碱对混凝土钢筋的缓蚀作用[J]. 建筑材料学报, 2009,12(1):36-40.
LIU Zheng, LIU Er-xi, WANG Guo-rui,etal. Anti-rust function of four kinds of 3,5-dibromo-2-hydroxy-benzaldehyde schiff base homemade[J]. Journal of Building Materials, 2009,12(1):36-40.
[15] 张捍东. 碳钢在盐水体系中的腐蚀研究[J]. 当代化工, 2005,34(4):243-245.
ZHANG Han-dong. Corrosion of carbon steel in salt water system[J]. Contemporary Chemical Industry, 2005,34(4):243-245.
[16] 曹晓东, 孙金忠. 中性盐雾试验中漆膜划痕处起泡探析[J]. 涂料工业, 2006,36(3):55-57.
CAO Xiao-dong, SUN Jin-zhong. Discussion on foaming of film scratch in neutral salt spray test[J].Paint & Coatings Industry, 2006,36(3):55-57.
[17] 李治国, 朱继胜, 冯 慧,等. 乙醇体系对马口铁罐腐蚀影响研究[J]. 全面腐蚀控制, 2005,19(4):28-31.
LI Zhi-guo, ZHU Ji-sheng, FENG Hui,etal. Influence of ethanol system on corrosion of tinplate can[J]. Total Corrosion, 2005,19(4):28-31.
[18] Song G L, Liu M. Corrosion and electrochemical evaluation of an Al-Si-Cu aluminum alloy in ethanol solutions[J]. Corrosion Science, 2013,72(4):73-81.
[19] 陈 旭, 衣守志, 吴家全. 环保型复合缓蚀剂的制备与性能[J]. 天津科技大学学报, 2011,26(5):39-43.
CHEN Xu, YI Shou-zhi, WU Jia-quan. Preparation and properties of environmental compound inhibitor[J]. Journal of Tianjin University of Science & Technology, 2011,26(5):39-43.
[20] Martini E M A, Muller I L. Characterization of the film formed on iron in borate solution by electrochemical impedance spectroscopy[J]. Corrosion Science, 2000,42(3):443-454.
[21] Bobichon C, Degrigny C. An electrochemical study of iron corrosion inhibitors in aqueous polyethylene glycol solutions[J]. Studies in Conservation, 2000,45(3):145-153.
[22] 陶 蕾, 郑书忠, 秦立娟,等. 电化学测试技术在缓蚀剂缓蚀行为研究中的应用[J]. 工业水处理, 2010,30(8):1-5.
TAO Lei, ZHENG Shu-zhong, QIN Li-juan,etal. Application of electrochemical measurement technology in the inhibition behavior research of corrosion inhibitors[J]. Industrial Water Treatment, 2010,30(8):1-5.
[23] Martinez S, Stern I. Thermodynamic characterization of metal dissolution and inhibitor adsorption processes in the low carbon steel /mimosa tannin/sulfuric acid system[J]. Applied Surface Science,2002,199:83-89.
[24] Abdul Ghani A, Bahron H, Harun M K,etal. Corrosion inhibition study of a heterocyclic schiff base derived from isatin[J]. Advanced Materials Research, 2012,554-556:425-429..
[25] Kartsonakis I A, Stanciu S G, Matei A A,etal. A comparative study of corrosion inhibitors on hot-dip galvanized steel[J]. Corrosion Science, 2016,112:289-307.
[26] Qian B, Hou B, Zheng M. The inhibition effect of tannic acid on mild steel corrosion in seawater wet/dry cyclic conditions[J]. Corrosion Science, 2013,72(4):1-9.
[27] 陈玉红, 王庆飞, 崔 敏,等. 席夫碱应用研究新进展[J]. 河北师范大学学报:自然科学版, 2003,27(1):71-74.
CHEN Yu-hong, WANG Qing-fei, CUI Min,etal. New progress in application of schiff base[J]. Journal of Hebei Normal University:Natural Science Edition, 2003,27(1):71-74.

