上调microRNA-543表达对大鼠骨关节炎软骨细胞的保护作用
李 坤, 张育民, 王亚康, 郭建斌
西安交通大学附属红会医院关节外科髋关节病区,西安 710054
骨关节炎(osteoarthritis, OA)是一组由关节边缘处的骨骼变化、关节软骨完整性异常及关节软骨和软骨下骨退化引起的异质性症候群,与多种炎性介质、细胞因子等致病因素密切相关,是老年人群普遍存在的慢性疾病,严重影响患者生活质量,对社会经济也造成了巨大的负担[1-2]。OA的发病机制复杂,软骨细胞在细胞外基质(ECM)中的异常增殖、迁移导致的关节软骨愈合、修复能力异常可能是其主要的致病原因[3],这也是目前最主要的治疗靶标。
微小RNA(microRNA/miRNA/miR)是长度在21~25个核苷酸的内源性非编码小RNA,可通过对靶基因mRNA进行切割或翻译抑制,导致蛋白质表达下调,进而调控细胞增殖、凋亡等多个生物学过程[4]。研究[5-9]表明,一系列的miRNAs(miR-602、miR-608、miR-30、miR-146a、miR-183)可能参与了OA的发生发展,且与基质金属蛋白酶(MMP)或血管细胞黏附分子-1的表达相关。
MiR-543对MMP7有调控作用,可能参与调节软骨细胞ECM的平衡[10],与骨肉瘤肿瘤细胞的糖酵解和增殖亢进有关[11],但目前关于其在OA中的作用及机制尚不明确。因此,本研究基于大鼠OA模型及体外细胞实验探讨miR-543对大鼠OA模型软骨细胞的可能作用及机制,为OA的临床防治提供参考靶标。
1 材料与方法
1.1 主要材料及试剂 DMEM-F12培养液购自美国Gibco公司;胰蛋白酶、青-链霉素、胎牛血清购自浙江天杭生物科技股份有限公司;miR-543 mimics及相应阴性对照、转染试剂购自上海吉玛基因化学科技有限公司;MTT、二甲基亚砜(DMSO)购自美国Sigma公司,TRIzol试剂、RT-PCR试剂盒和反转录试剂盒购自日本TaKaRa公司;BCA蛋白定量试剂盒、鼠双微体基因4(murine double minute 4, MDM4)、蛋白激酶B1(protein kinase B1, PKB1/Akt1)、B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2, Bcl-2)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)单克隆抗体及辣根过氧化物酶标记的二抗均购自美国Abcam公司。
1.2 动物分组及OA模型的建立 30只健康SD大鼠购自济南金丰实验动物有限公司,许可证号:SCXK(鲁)20140006。大鼠常规饲料喂养,随机均分为OA模型组及正常对照组(n=15),正常对照组大鼠不做特殊处理,OA模型组大鼠采用0.5%水合氯醛(0.35 g/100 g)腹腔注射麻醉后切断膝关节内侧副韧带,建立OA模型,术后每天对两组大鼠肌内注射青霉素2×104U/kg,共3 d。1周后,每天驱赶OA模型组及正常对照组大鼠跑步30 min。
1.3 软骨细胞的原代培养及miR-543 mimics的转染 无菌条件下取正常大鼠双侧膝关节软骨,切下组织一部分用于RNA抽提,另一部分置于含双抗的磷酸盐缓冲液清洗,300×g离心10 min,弃上清,20%胎牛血清DMEM-F12培养基37℃、适当湿度、5%CO2培养。转染前1 d,将待转染细胞以2×105/cm2的密度接种于12孔板,待细胞融合达60%~80%时,按Lipofectamine 2000转染试剂盒说明书方法进行转染miR-543 mimics及相应阴性对照(miR-543-NC),验证转染效率后行后续实验。
1.4 MTT法检测软骨细胞增殖能力 取对数生长期待测软骨细胞,96孔板中每孔接种5 000个细胞,每组设6个复孔,同时设立无细胞的空白对照。细胞转染miR-543 mimics后,10 ng/L IL-1β处理24 h,每孔加入5 μg/mL MTT溶液20 μL,孵育4 h后弃上清,加入DMSO 200 μL/孔,振荡10 min,酶标仪读取光密度(D490)值,重复3次。
1.5 Real-time PCR检测软骨细胞凋亡相关基因及炎症因子基因的表达 原代软骨细胞培养于6孔板,不转染/转染miR-543 mimics或miR-543-NC 48 h后,加入10 ng/L IL-1β连续培养24 h,TRIzol法提取细胞总RNA,反转录合成cDNA后行real-time PCR检测待测基因表达水平,严格按说明书进行操作,待测基因及内参序列如表1。反应条件:95℃,3 min;40个PCR循环(95℃,15 s;55℃,20 s;72℃,20 s;83.5℃,15 s);95℃,15 s;60℃,1 min;95℃,15 s。以ABI 7500实时定量PCR系统进行实验,收集荧光信号,绘制熔解曲线,以2-ΔΔCt法进行相对定量分析相关基因的表达水平。
1.6 Western印迹法检测软骨细胞凋亡相关蛋白的表达 原代软骨细胞培养于6孔板,不转染/转染miR-543 mimics或miR-543-NC 48 h后提取待测细胞总蛋白,BCA蛋白定量试剂盒测定蛋白浓度。将各组蛋白与上样缓冲液(loading buffer)充分混合后100℃变性5 min,每孔50 μL加入到十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶上样孔,进行电泳和转膜,5%脱脂奶粉37℃封闭1 h。加入按使用说明稀释后的待测一抗4℃过夜。TBST缓冲溶液清洗后加入辣根过氧化物酶标记的羊抗鼠IgG(1∶1 000稀释)。37℃孵育1 h,TBST缓冲液清洗后以ECL发光液显影,自动凝胶成像系统采集图像,以GAPDH作为内参分析MDM4、Akt1、Bcl-2等蛋白的表达水平。
MDM4:鼠双微体基因4(murine double minute 4); Akt1:蛋白激酶B1(protein kinase B1, PKB1); Bcl-2:B细胞淋巴瘤/白血病-2(B cell lymphoma/leukemia-2); TNF-α:肿瘤坏死因子-α(tumor necrosis factor-α); IL-6:白细胞介素-6(interleukin-6)

2 结 果
2.1 MiR-543在OA模型大鼠软骨组织及IL-1β诱导的软骨细胞中的表达变化 结果(图1)表明:大鼠OA模型组软骨组织miR-543表达较正常对照组明显降低,差异有统计学意义(P<0.05);与未接受IL-1β诱导的软骨细胞相比,IL-1β诱导后的软骨细胞miR-543表达水平降低,差异有统计学意义(P<0.05)。
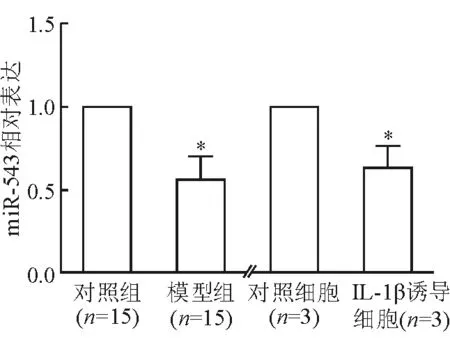
图1 OA模型大鼠软骨组织及IL-1β诱导的软骨细胞中miR-543的表达
2.2 软骨细胞miR-543转染效率验证 结果(图2)表明:miR-543-NC转染组软骨细胞miR-543表达与对照组差异无统计学意义; miR-543-mimics转染组软骨细胞miR-543表达较对照组明显升高(P<0.05)。
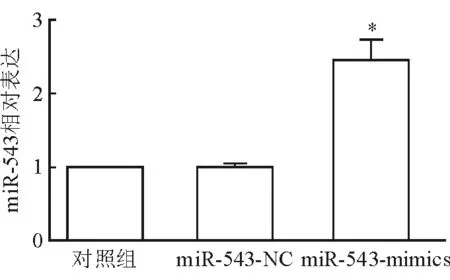
图2 转染后不同组别软骨细胞miR-543的表达
2.3 上调miR-543表达对软骨细胞增殖能力的影响 结果(图3)表明:与正常对照软骨细胞相比,转染miR-543 mimics后软骨细胞增殖率明显提升,差异有统计学意义(P<0.05);与正常对照软骨细胞相比,IL-1β诱导可导致软骨细胞增殖能力下降(P<0.05),转染miR-543 mimics上调miR-543表达后可逆转IL-1β对细胞增殖的抑制作用(P<0.05)。
2.4 上调miR-543表达对骨关节炎软骨细胞凋亡相关基因表达的影响 结果(图4)表明:与正常对照软骨细胞相比,miR-543 mimics转染细胞MDM4
mRNA表达下调,Akt1、Bcl-2 mRNA表达上调,差异有统计学意义(P<0.05);与正常对照软骨细胞相比,IL-1β诱导后细胞MDM4 mRNA表达上调,Akt1、Bcl-2 mRNA表达下调,差异有统计学意义(P<0.05);转染miR-543 mimics可减轻IL-1β诱导的MDM4、Akt1、Bcl-2 mRNA 表达变化(P<0.05)。
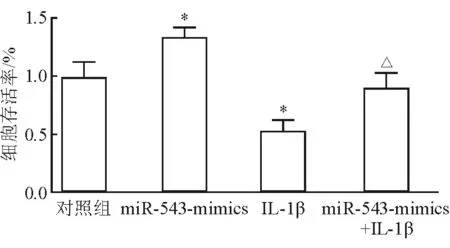
图3 上调miR-543表达对软骨细胞增殖能力的影响
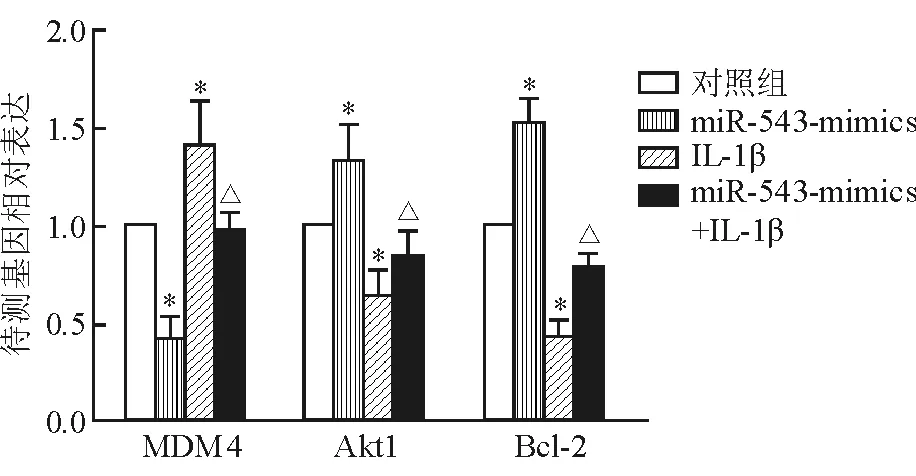
图4 上调miR-543表达对软骨细胞MDM4、Akt1、Bcl-2 mRNA表达的影响
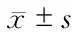
2.5 上调miR-543表达对IL-1β诱导的软骨细胞炎症相关基因表达的影响 结果(图5)表明:与正常对照组相比,IL-1β诱导后软骨细胞炎症因子TNF-α、IL-6 mRNA表达上调(P<0.05);转染miR-543 mimics上调miR-543表达可减轻IL-1β诱导的TNF-α、IL-6 mRNA表达变化(P<0.05)。
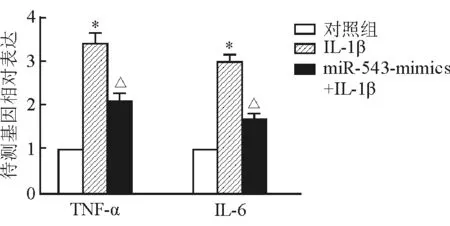
图5 上调miR-543表达对软骨细胞炎症相关基因表达的影响
2.6 上调miR-543表达对骨关节炎软骨细胞凋亡相关蛋白表达的影响 结果(图6)表明:与正常对照组相比,转染miR-543 mimics软骨细胞MDM4表达下降,Akt1、Bcl-2表达上升(P<0.05);与正常对照组相比,IL-1β诱导后软骨细胞MDM4表达上升,Akt1、Bcl-2表达下降(P<0.05);转染miR-543 mimics上调miR-543表达可减少IL-1β诱导的MDM4、Akt1、Bcl-2蛋白表达的变化。
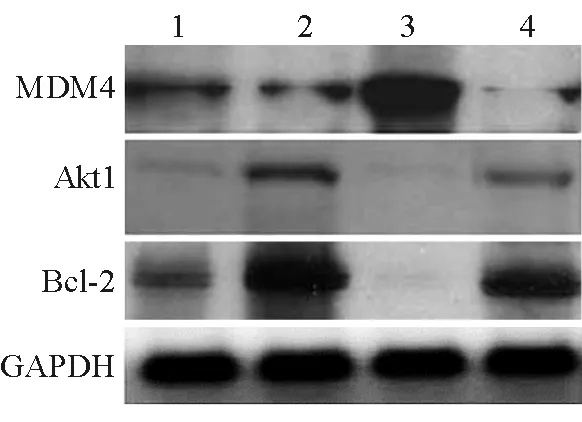
图6 上调miR-543表达对骨关节炎软骨细胞凋亡相关蛋白表达的影响
1:对照组; 2: miR-543-mimics; 3: IL-1β; 4: miR-543-mimics+IL-1β
3 讨 论
本研究结果表明miR-543在骨软骨炎大鼠软骨组织中表达明显下降,提示miR-543正常表达可能对维持软骨细胞的正常生理功能有重要意义。MiR-543功能获得性实验发现,miR-543可促进软骨细胞增殖(P<0.05),减轻IL-1β诱导的增殖抑制作用(P<0.05),提示miR-543表达抑制可能是OA的分子生物学病因之一,miR-543表达水平的监测对于OA的发生及病情评估有潜在的临床价值。外源性miR-543补充对于缓解骨关节炎发展具有积极意义。
软骨细胞异常凋亡是骨关节炎进展的重要原因之一,MDM4可定位于凋亡的关键细胞器线粒体,激活TP53线粒体凋亡途径,还可结合并抑制抗凋亡蛋白Bcl-2功能,促进细胞色素C的释放,产生促凋亡作用[12]。Akt1则可调控mTOR信号通路,减少细胞凋亡[13]。MiR-543过表达的软骨细胞与对照细胞相比,MDM4表达降低,Bcl-2、Akt1表达升高。在IL-1β诱导下,miR-543表达可减少促凋亡蛋白MDM4的释放,提高凋亡抵抗蛋白Bcl-2、Akt1的水平。在后续研究中,还需借助生物信息学分析及荧光素酶报告实验研究证实miR-543对MDM4、Akt1、Bcl-2是否存在直接的调控作用。
OA发病过程中,炎症因子的过表达与OA的严重程度密切相关,大量炎症因子释放不仅会造成软骨细胞损伤,还可影响软骨细胞分化、诱导ECM降解[14-15]。IL-1β诱导软骨细胞时,发现炎症因子TNF-α、IL-6表达明显上升(P<0.05),提示IL-1β可造成软骨细胞炎症损伤,而miR-543过表达时,TNF-α、IL-6表达被抑制(P<0.05),提示miR-543可能还有减轻炎症损伤的作用。
综上所述,OA大鼠软骨组织与正常软骨组织相比miR-543表达明显下调。过表达miR-543可促进软骨细胞增殖,下调MDM4蛋白表达,上调Akt1、Bcl-2蛋白表达,导致炎症因子TNF-α、IL-6表达降低,可拮抗IL-1β诱导的增殖抑制、促凋亡蛋白上调、抗凋亡蛋白下调、促炎症因子产生作用,具有潜在的临床应用价值。
[ 1 ] DAMMAN W, LIU R, KROON F P, et al.Do comorbidities play a role in hand osteoarthritis disease burden? Data from the hand osteoarthritis in secondary care cohort[J].J Rheumatol,2017, 44(11):1659-1666.
[ 2 ] 陈 亮,杨晓凌.骨关节炎患者血清中炎性因子IL-1β、IL-6和COX-2的表达[J].中国临床医学,2016,23(1):61-62.
[ 3 ] BADAWY M, FENSTAD A M, BARTZ-JOHANNESSEN C A, et al. Hospital volume and the risk of revision in Oxford unicompartmental knee arthroplasty in the Nordic countries -an observational study of 14,496 cases[J].BMC Musculoskelet Disord, 2017,18(1):388.
[ 4 ] SHAH R, YERI A S, DAS A, et al. Small RNA-seq during acute maximal exercise reveal RNAs involved in vascular inflammation and cardiometabolic health: brief report[J]. Am J Physiol Heart Circ Physiol, 2017,313(6):H1162-H1167.
[ 5 ] BEYER C, ZAMPETAKI A, LIN N Y, et al.Signature of circulating microRNAs in osteoarthritis[J]. Ann Rheum Dis, 2015,74(3):e18.
[ 6 ] AKHTAR N, MAKKI M S, HAQQI T M.MicroRNA-602 and microRNA-608 regulate sonic hedgehog expression via target sites in the coding region in human chondrocytes[J].Arthritis Rheumatol, 2015,67(2):423-434.
[ 7 ] LI L, YANG C, LIU X, et al. Elevated expression of microRNA-30b in osteoarthritis and its role in ERG regulation of chondrocyte[J]. Biomed Pharmacother, 2015,76:94-99.
[ 8 ] YAMASAKI K, NAKASA T, MIYAKI S, et al. Expression of MicroRNA-146a in osteoarthritis cartilage[J]. Arthritis Rheum, 2009,60(4):1035-1041.
[ 9 ] LI X, KROIN J S, KC R, et al. Altered spinal microRNA-146a and the microRNA-183 cluster contribute to osteoarthritic pain in knee joints[J]. J Bone Miner Res, 2013,28(12):2512-2522.
[10] SONG N, LIU H, MA X, et al. Placental growth factor promotes metastases of ovarian cancer through MiR-543-regulated MMP7[J]. Cell Physiol Biochem, 2015,37(3):1104-1112.
[11] ZHANG M, LYGRISSE K, WANG J. Role of microRNA in osteoarthritis[J]. J Arthritis, 2017,6(2).pii:239.
[12] MANCINI F, PIERONI L, MONTELEONE V, et al. MDM4/HIPK2/p53 cytoplasmic assembly uncovers coordinated repression of molecules with anti-apoptotic activity during early DNA damage response[J].Oncogene, 2016,35(2):228-240.
[13] TANG H, CHEN J, FRAIDENBURG D R, et al. Deficiency of Akt1, but not Akt2, attenuates the development of pulmonary hypertension[J].Am J Physiol Lung Cell Mol Physiol, 2015,308(2): L208-L220.
[14] DA SILVA M R, LINHARES D, VASCONCELOS D M, et al.Neuroimmune expression in hip osteoarthritis: a systematic review[J].BMC Musculoskelet Disord, 2017,18(1):394.
[15] MA C H, WU C H, JOU I M, et al. PKR activation causes inflammation and MMP-13 secretion in human degenerated articular chondrocytes[J].Redox Biol, 2018,14:72-81.

