桑白皮多酚的抗氧化和对UV辐射致成纤维细胞光老化的修复作用
吴永祥
吴丽萍1
王卫东2
金泰完3
(1.黄山学院生命与环境科学学院,安徽 黄山 245041;2.黄山峰源生物科技有限公司,安徽 黄山 245600;3.安东国立大学食品科学与生物技术学院,韩国 安东 760749)
皮肤光老化(Photoaging)是指由于皮肤长期暴露在外界有害因素(日晒、烟尘、化学物质等)之下使得皮肤过早地出现衰老现象的一类疾病,其中紫外线是最为主要的诱因[1]。UV辐射会引起成纤维细胞生物学特征的改变,表现为皮肤粗糙、增厚、过多的色素沉着及出现深皱纹[2-3]。长期过量的UV辐射甚至会引起皮肤癌变,严重损害人体健康[4]。研究[5-6]表明,许多植物提取精华和中草药中的化学物质可有效防治皮肤光老化。
桑白皮是桑科植物桑(MorusalbaL.)的干燥根皮,为中国传统常用中药材,主产于安徽、四川、贵州、湖南等地。桑白皮多酚是桑白皮的次生代谢产物,主要包括Diels-Alder型加合物和黄酮类化合物等[7]。桑白皮多酚具有多种生物活性,包括抗氧化[8]、抗病毒[9]、镇痛抗炎[10]、降血糖[11]及改善胰岛素抵抗[12]等。本课题组前期研究[13]发现桑白皮多酚提取物具有抑制α-淀粉酶、α-葡萄糖苷酶、胰脂肪酶及3T3-L1脂肪细胞分化的作用。虽然桑白皮多酚药理作用的研究较多[10-13],但关于桑白皮多酚对UV辐射致皮肤光老化修复作用的研究仍然缺乏。
本试验拟以桑白皮多酚为原料,首先研究CMP的抗氧化能力,在以成纤维HS68细胞为研究对象,探讨CMP对UV辐射致成纤维细胞光老化的修复作用,并阐明其作用机制,为抗光老化功能性食品的开发利用提供理论基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
桑白皮:安徽亳州药材市场;
成纤维HS68细胞:美国模式培养物集存库(American Type Culture Collection, ATCC);
单宁酸(tannic acid, TA)、Folin-Ciocalteu试剂、BHA、ABTS、DPPH、MTT:分析纯,美国Sigma公司;
PIP试剂盒:日本TaKaRa公司;
胎牛血清、DMEM培养液等:美国Gibco公司。
1.1.2 主要仪器设备
全波长酶标仪:SpectraMax-190型,美国Molecular Devices公司;
CO2恒温培养箱:NU-8500型,美国Thermo公司;
超净工作台:DL-CJ-1N型,北京东联哈尔仪器制造有限公司;
立式压力蒸汽灭菌器:LDZF-75KB-III型,上海申安医疗器械厂;
实时荧光定量PCR仪:ECOTM型,美国Illumina公司。
1.2 试验方法
1.2.1 桑白皮多酚提取物的制备 将桑白皮粉碎成粉末,按照料液比1∶10 (g/mL)与70%的乙醇溶液进行混合,室温条件下振荡提取3次,每次4 h,过滤后收集上清液,用旋转蒸发仪浓缩至适量。取提取液加在处理好的大孔吸附树脂柱上,用蒸馏水洗脱,再依次使用不同纯度的乙醇冲洗,收集洗脱液,减压浓缩回收溶剂,冷冻干燥得桑白皮多酚提取物。
1.2.2 多酚含量的测定 采用Folin-Ciocalteu法[14-15],以单宁酸作为标准品。绘制吸光值Y-质量浓度X的标准曲线Y=0.001X-0.005,R2=0.999。根据标准曲线,计算桑白皮多酚的含量(mg TA/g)。
1.2.3 抗氧化活性的测定
(1) ABTS自由基清除能力:参考文献[16]。
(2) DPPH自由基清除能力:参考文献[17~18]。
1.2.4 成纤维细胞的培养及细胞光老化模型的建立 成纤维HS68细胞置于(+)DMEM培养基(含100 U/mL 青链霉素、10%胎牛血清),在37 ℃、5% CO2且相对饱和湿度的细胞培养箱中培养。取对数生长期的HS68细胞,以1×105个/mL 接种于24孔板中,每孔500 μL。贴壁培养24 h后,弃培养基,用PBS清洗2次,并铺上500 μL的PBS,置于紫外线灯下辐射。辐射条件:辐射剂量20 mJ/cm2,时间90 s,细胞距离光源20 cm[19]。空白对照组不给予UV辐射。弃PBS,加入DMEM培养基(含100 U/mL 青链霉素、但不含10%胎牛血清)培养。
1.2.5 试验分组 将成纤维HS68细胞设置为空白对照组(无UV辐射及CMP处理)、UV模型组(给予UV辐射,无CMP处理)、CMP试验组(给予UV辐射及CMP处理),各组均设4个复孔。CMP处理浓度为1,2,5 μg/mL。
1.2.6 细胞增殖活性的测定 接种于24孔板中的HS68细胞,给不同浓度CMP(1,2,5 μg/mL)处理48 h后,每孔加入50 μL的MTT染色液,继续置于细胞培养箱中培养,3 h 后弃上清液,每孔加入500 μL二甲基亚砜溶液,室温避光震荡20 min,于570 nm波长处读取OD值[20]。
1.2.7 PIP含量的测定 将接种于24孔板中的HS68细胞用不同浓度CMP(1,2,5 μg/mL)处理48 h后,收集细胞上清液,采用ELISA法测定细胞培养液中PIP含量,操作方法参考PIP试剂盒说明书。
1.2.8 MMP-1、PIP mRNA表达水平的测定 取HS68细胞以1×105个/mL接种于60 mm的细胞培养皿中,经不同浓度CMP(1,2,5 μg/mL)处理48 h后,用Trizol法提取总RNA,按照PrimeScriptTMRT试剂盒合成cDNAs。加入SYBR Green、引物及cDNA模板,进行实时荧光定量PCR反应。引物设计:MMP-1正义引物为5’-GGT GAT GAA GCA GCC CAG-3’,MMP-1反义引物为5’-CAG TAG AAT GGG AGA GTC-3’;PIP正义引物为5’-GAA CGC GTG TCA TCC CTT GT-3’,PIP反义引物为5’-GAA CGA GGT AGT CTT TCA GCA ACA-3’;β-actin正义引物为5’-GTT GGA CCT GAC AGA CTA CCT CA-3’,β-actin反义引物为5’-GTT GCC AAT AGT GAT GAC CT-3’。
1.3 统计学分析
2 结果与分析
2.1 桑白皮多酚对ABTS自由基的清除作用
由图1可知,CMP具有显著清除ABTS自由基的能力,且清除率随着质量浓度的增大先逐渐增强最后趋于恒定;BHA在1~10 μg/mL时,清除率随着质量浓度的增加而增大,且呈线性相关。CMP和BHA对ABTS自由基清除作用的IC50值分别为1.49,11.25 μg/mL,表明CMP对ABTS自由基清除能力显著强于阳性对照BHA(P<0.05)。故桑白皮多酚具有显著的ABTS自由基清除能力,而多酚类物质是其主要的活性成分。

图1 桑白皮多酚对ABTS自由基的清除作用Figure 1 ABTS free radical scavenging ability of polyphenol from Cortex Mori
2.2 桑白皮多酚对DPPH自由基的清除作用
图2表明,在1~10 μg/mL时,CMP和BHA对DPPH自由基清除能力随着浓度的增加而增强,呈明显的浓度依赖性,且差异显著(P<0.05)。CMP和BHA清除DPPH自由基的IC50值分别为8.94,11.03 μg/mL,说明桑白皮多酚对DPPH自由基清除能力大于人工合成抗氧化剂BHA。以上结果显示,桑白皮多酚对DPPH和ABTS自由基清除能力的变化规律具有较好的一致性,说明多酚类物质是桑白皮的主要抗氧化活性成分。

图2 桑白皮多酚对DPPH自由基的清除作用Figure 2 DPPH free radical scavenging ability of polyphenol from Cortex Mori
2.3 桑白皮多酚对细胞增殖作用的影响
由图3可知,成纤维HS68细胞经UV辐射后,细胞存活率明显降低,与空白对照组比较具有显著性差异(P<0.05),表明体外HS68细胞光老化模型建立成功。与UV模型组[(60.90±0.46)%]相比,不同浓度CMP(1,2,5 μg/mL)作用48 h后,其细胞存活率分别为(64.78±1.84)%,(70.89±2.20)%,(75.76±0.68)%,呈剂量依赖性增加,且具有统计学意义(P<0.05)。说明桑白皮多酚能提高光老化成纤维细胞的增殖活性,对细胞损伤具有一定的修复作用。后续试验细胞PIP分泌水平及MMP-1、PIP的mRNA表达的测定均采用此浓度的添加量进行研究。

不同小写字母表示差异显著,P<0.05图3 桑白皮多酚对细胞增殖作用的影响Figure 3 Effect of polyphenol from Cortex Mori on cell proliferation
2.4 桑白皮多酚对细胞PIP含量的影响
由图4可知,PIP标准品的质量浓度(Y)与OD值(X)间的标准曲线为Y=47.12X2+106.4X-1.914(R2=0.999),说明方程拟合有效。由图5可知,成纤维HS68细胞经过UV辐射后,其PIP的含量发生了变化。与空白对照组[(624.09±10.93) ng/mL]相比,UV模型组PIP含量明显降低,达到了(497.58±17.38) ng/mL,存在着显著性差异(P<0.05)。与UV模型组相比,CMP可以显著提高UV辐射后细胞中的PIP含量,随着CMP浓度的增加,PIP含量呈浓度依赖性提高,且有统计学差异(P<0.05)。PIP含量的降低,可导致皮肤中胶原蛋白合成的减少,从而出现皱缩细纹等衰老症状[21]。本试验结果表明,桑白皮多酚增加了UV辐射后成纤维细胞中PIP的含量,具有潜在的抗光老化作用。

图4 PIP标准曲线Figure 4 Standard curve of PIP
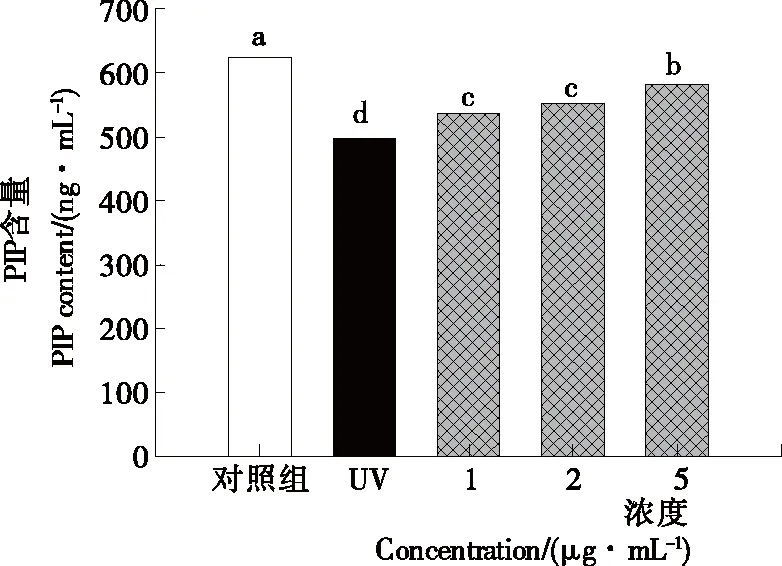
不同小写字母表示差异显著,P<0.05图5 桑白皮多酚对细胞PIP含量的影响Figure 5 Effect of polyphenol from Cortex Mori on PIP content
2.5 桑白皮多酚对细胞MMP-1、PIP mRNA表达的影响
由表1可知,与空白对照组相比,UV模型组在给予UV辐射后,细胞中MMP-1的mRNA表达水平显著升高,PIP的mRNA 表达水平显著降低。空白对照组中MMP-1、PIP的mRNA表达水平分别为(0.08±0.00),(1.00±0.00),而UV模型组分别为(1.00±0.00),(0.33±0.01),两者存在着显著性差异(P<0.05)。与UV模型组相比,CMP能够显著下调UV辐射损伤细胞内MMP-1的mRNA表达量,提高PIP的mRNA水平,且有统计学差异(P<0.05)。研究[22]证明,MMP-1过度表达时,将会抑制PIP的正常表达,破坏皮肤胶原纤维和弹性纤维的正常结构,从而导致皮肤光老化。结果表明,桑白皮多酚通过调控MMP-1和PIP的mRNA表达,起到光老化修复作用。
表1桑白皮多酚对细胞MMP-1、PIP mRNA表达的影响†
Table 1 Effect of polyphenol fromCortexMorion MMP-1, PIP mRNA expressions
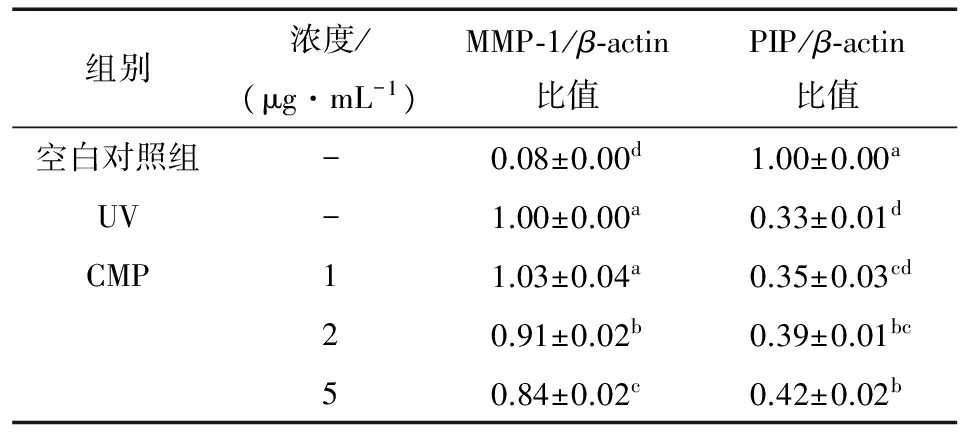
组别浓度/(μg·mL-1)MMP⁃1/β⁃actin比值PIP/β⁃actin比值空白对照组-0.08±0.00d1.00±0.00aUV-1.00±0.00a0.33±0.01dCMP11.03±0.04a0.35±0.03cd20.91±0.02b0.39±0.01bc50.84±0.02c0.42±0.02b
† 同列不同上标字母表示在统计学上具有显著差异(P<0.05)。
3 结论
本研究揭示了桑白皮多酚能有效抵抗UV诱导的皮肤光老化,其作用机制可能与有效清除自由基,抑制细胞内MMP-1表达及调控PIP合成有关。下一步将对桑白皮多酚做进一步的分离纯化,以明确桑白皮多酚抗皮肤光老化的主要活性成分。
[1] 高擎, 金鑫, 葛亚中, 等.组方提取物A的抗光化功效及其机理研究[J].现代食品科技, 2016, 32(8): 100-106.
[2] CHOI J W, LEE J, PARK Y I.7,8-Dihydroxyflavone attenu-ates TNF-α-induced skin aging in Hs68 human dermal fibroblast cells via down-regulation of the MAPKs/Akt signaling pathways[J].Biomedicine & Pharmacotherapy, 2017, 95: 1 580-1 587.
[3] 殷花, 林忠宁, 朱伟.皮肤光老化发生机制及预防[J].环境与职业医学, 2014, 31(7): 565-569.
[4] 樊迎, 王常青, 王菲, 等.黑豆乳清多肽抗皮肤光老化作用的研究[J].天然产物研究与开发, 2013, 25(4): 539-543.
[5] 路婷婷, 陈亚泽, 卢涛, 等.紫外线的皮肤损伤机制及具有紫外线防护作用的天然产物的研究进展[J].中国药理学通报, 2012, 28(12): 1 655-1 659.
[6] HA S J, LEE J, KIM H, et al.Preventive effect ofRhusjavanicaextract on UVB-induced skin inflammation and photoaging [J].Journal of Functional Food, 2016, 27: 589-599.
[7] 李墨灵, 张晗, 夏庆梅.桑白皮的化学、药理与药代动力学研究进展[J].西部中医药, 2017, 30(2): 137-139.
[8] DAI Sheng-jun, WU Yan, WANG Ying-hong, et al.New diels-alder type adducts fromMorusmacrouraand their antioxidant activities[J].Chemical and Pharmaceutical Bulletin, 2004, 52(10): 1 190-1 193.
[9] DU Jiang, HE Zhen-dan, JIANG Ren-wang, et al.Antiviral flavonoids from the root bark ofMorusalbaL.[J].Phytochemis-try, 2003, 62(8): 1 235-1 238.
[10] 俸婷婷, 谢体波, 林冰, 等.桑白皮总黄酮的镇痛抗炎药理作用研究[J].时珍国医国药, 2013, 24(11): 2 580-2 582.
[11] ZHANG Mi, CHEN Man, ZHANG Han-qing, et al.Invivohypoglycemic effects of phenolics from the root bark ofMorusalba[J].Fitoterapia, 2009, 80(8): 475-477.
[12] 高颖, 高英, 李艳, 等.桑白皮黄酮提取物对2型糖尿病大鼠胰岛素抵抗的影响[J].广州中医药大学学报, 2016, 33(6): 831-835.
[13] WU Yong-xiang, KIM Y J, LI Sha, et al.Anti-obese effects of mulberry (MorusalbaL.) root bark through the inhibition of digestive enzymes and 3T3-L1 adipocyte differentiation[J].The Korean Society of Food Preservation, 2015, 22(1): 27-35.
[14] 吴永祥, 王祥, 江海涛, 等.不同极性柳叶蜡梅叶萃取物总酚含量及其抗氧化、抑菌能力研究[J].食品与机械, 2017, 33(8): 150-154.
[15] 宋丽军, 候旭杰, 李雅雯, 等.核桃青皮中多酚的超高压提取工艺优化[J].食品与机械, 2015, 31(4): 178-182.
[16] 严鑫, 王委, 刘量.绶草萃取物体外抗氧化活性及其总酚含量比较[J].食品与机械, 2016, 32(8): 143-146.
[17] 吴德智, 郑强, 李安, 等.缬草总黄酮超声辅助双水相提取工艺优化及抗氧化活性研究[J].食品与机械, 2017, 33(5): 162-167.
[18] 吴永祥, 杨庆, 李林, 等.豆腐柴叶挥发油化学成分及其抗氧化和抑菌作用研究[J].天然产物研究与开发, 2018, 30(1): 45-51.
[19] HUANG Chung-yu, LIN Yi-tzu, KUO Hsiang-chun, et al.Compounds isolated fromEriobotryadeflexaleaves protect against ultraviolet radiation B-induced photoaging in human fibroblasts[J].Journal of Photochemistry & Photobiology, B: Biology, 2017, 175: 244-253.
[20] EBADI P, FAZELI M.Anti-photoaging potential of propolis extract in UVB-irradiated human dermal fibroblasts through increasing the expression of FOXO3A and NGF genes[J].Biomedicine & Pharmacotherapy, 2017, 95: 47-54.
[21] LEE J J, KIM K B, HEO J, et al.Protective effect ofArthrospiraplatensisextracts against ultraviolet B induced cellular senescence through inhibition of DNA damage and matrix metalloproteinase-1 expression in human dermal fibroblasts[J].Journal of Photochemistry & Photobiology, B: Biology, 2017, 173: 196-203.
[22] 刘大旭, 高晓波, 祁永华, 等.杜仲有效成分β-萘黄酮对UVB诱导人皮肤成纤维细胞光老化保护作用研究[J].中医药学报, 2016, 44(3): 41-43.

