大孔树脂纯化乌饭树叶黄酮工艺研究
张德谨
陈义勇3
胡雅琳1
刘 祥1
(1.宿州学院化学化工学院,安徽 宿州 234000;2.宿州学院精细化工产品开发研究所,安徽 宿州 234000;3.常熟理工学院生物与食品工程学院,江苏 苏州 215500)
乌饭树古称染菽,属于杜鹃花科[1]。作为乌饭树叶中的功能性成分之一,黄酮类化合物具有多种生理活性,如抗氧化[2-4]、抑菌[5-7]、抗疲劳[8]等。目前,中国对乌饭树叶资源的利用率较低,基于乌饭树叶黄酮的生理活性,很有必要对乌饭树叶黄酮进行纯化,进而提高乌饭树叶黄酮的附加值。目前,常用的纯化方法包括柱色谱、萃取、高效液相色谱、高速逆流色谱等,相比较而言,柱色谱法具有成本低、操作程序简单等特点[9]。其中,大孔树脂被广泛地应用于黄酮的分离纯化[10-12]。大孔树脂具有多孔性和较大的比表面积,主要通过物理作用从溶液中有选择性地吸附有机物质,从而达到分离纯化的目的[13]。另外,大孔树脂具有化学稳定性好、价格便宜、易于工业化等特点,也促使了大孔树脂在天然产物有效成分纯化方面的应用越来越多。因此,本试验选择大孔树脂用于乌饭树叶黄酮的初步纯化。
目前,对于乌饭树叶黄酮的研究主要集中在如何高效提取黄酮类化合物[14-15],以及乌饭树叶黄酮粗提物的功能特性[16-17]等方面,对于如何利用大孔树脂对乌饭树叶黄酮粗提物进行纯化缺乏系统性的研究,而且一些对乌饭树叶黄酮纯化方法的研究中存在黄酮纯度低、工艺复杂以及溶剂有毒性等问题,影响了乌饭树资源的开发利用。本试验通过对大孔树脂纯化乌饭树叶黄酮工艺的研究,确定乌饭树叶黄酮纯化工艺,并利用多种方法对纯化效果进行评价,旨在为乌饭树资源的开发利用提供一定的参考。
1 材料与方法
1.1 材料与试剂
新鲜乌饭树叶:产地江苏宜兴;
牛血清白蛋白:上海艾研生物科技有限公司;
槲皮素标准品:纯度>98%,贵州迪大生物科技有限公司;
葡萄糖:分析纯,江苏强盛功能化学股份有限公司;
考马斯亮蓝G-250:上海谱振生物科技有限公司;
甲醇:色谱纯,天津君博化工有限公司;
大孔树脂SP-825、NKA-II、HZ-841、HZ-802:上海蓝季科技发展有限公司,4种大孔树脂理化性能见表1。

表1 树脂的理化性能Table 1 Physical and chemical properties of resins
1.2 主要仪器
高效液相色谱仪:LC-20AD型,日本岛津公司;
电热恒温鼓风干燥箱:DHG-9030A型,上海三发科学仪器有限公司;
数显恒温水浴锅:HH-2型,金坛市接瑞尔电器有限公司;
旋转蒸发仪:RE-52A型,上海亚荣生化仪器厂;
循环水式多用真空泵:SHB-B95型,郑州长城科工贸有限公司;
可见分光光度计:722型,上海菁华科技仪器有限公司;
恒温振荡器:THZ-A型,上海五相仪器仪表有限公司;
真空干燥箱:DZF-6050型,上海迈捷实验设备有限公司。
1.3 方法
1.3.1 乌饭树叶黄酮的制备 取粉碎后的乌饭树叶粉末20 g 置于1 000 mL烧杯中,加入800 mL蒸馏水,50 ℃下浸提2 h,经浓缩后得到乌饭树黄酮[17]。
1.3.2 黄酮浓度的测定 分别移取0.0,0.4,0.8,1.6,2.0,2.4,2.8,3.2 mL 50 mg/L标准液至10 mL容量瓶中,用1% AlCl3定容,在434 nm处测定各标准液的吸光度,得到拟合曲线方程为:A=0.064 7C+0.004 08,线性范围为2~14 mg/L,R2=0.999 75。
1.3.3 树脂的预处理 参照文献[18~19],将大孔树脂SP-825、NKA-II、HZ-841和HZ-802先后用乙醇、盐酸以及氢氧化钠进行处理,最后用蒸馏水洗至中性。
1.3.4 吸附树脂的选择
(1) 树脂的吸附与解吸性能比较:分别称取预处理的大孔树脂SP-825、NKA-II、HZ-841、HZ-802各1 g (干重),各加入30 mL乌饭树黄酮溶液(浓度为0.55 mg/mL)中,然后放到温度为25 ℃的恒温振荡器中,以120 r/min振荡12 h,按式(1)、(2)计算树脂的吸附容量与吸附率。
(1)
(2)
式中:
Qe——吸附容量,mg/g;
E——吸附率,%;
C0——液相中黄酮的初始浓度,mg/mL;
Ce——达到吸附平衡时的黄酮浓度,mg/mL;
Vi——样品溶液体积,mL;
W——树脂的质量,g。
将吸附饱和的树脂用蒸馏水洗净,加入30 mL 体积分数为50%的乙醇,在25 ℃下以120 r/min振荡12 h,按式(3)计算树脂的解吸率。
(3)
式中:
D——解吸率,%;
Cd——液相中黄酮浓度,mg/mL;
Vd——洗脱液体积,mL。
(2) 静态吸附动力学曲线:准确称取1 g预处理后的大孔树脂,加入浓度为0.5 mg/mL的乌饭树黄酮溶液30 mL,在25 ℃下以120 r/min转速恒温振荡,至吸附达到平衡前,每隔一定时间测定液相中黄酮的浓度,计算各个时间的吸附量。
1.3.5 乌饭树叶黄酮纯化工艺
(1) 上样浓度对吸附率的影响:准确称取1 g预处理后的大孔树脂,装入层析柱中(柱体积为14 mL),分别用黄酮浓度为0.25,0.50,0.75,1.00,1.25,1.50 mg/mL的乌饭树叶黄酮溶液上样,上样流速1 mL/min,上样体积30 mL,考察不同上样浓度对吸附率的影响。
(2) 动态穿透曲线:准确称取1 g预处理后的大孔树脂,装入层析柱中(内径3 cm),乌饭树叶黄酮溶液上样浓度0.75 mg/mL,上样流速1 mL/min,用自动收集器收集流出液,每管收集3.5 mL,测定收集管中黄酮的浓度,绘制动态穿透曲线。
(3) 乙醇体积分数对解吸率的影响:按照1.3.5(2)中的上样条件进行上样,用蒸馏水洗脱至洗脱液无色,再分别用10%,30%,50%,70%,90%(体积分数)的乙醇溶液以1 mL/min 洗脱流速洗脱,比较不同体积分数的乙醇对解吸率的影响。
(4) 洗脱流速对解吸率的影响:按照1.3.5(2)中的上样条件进行上样,上样结束后,先用蒸馏水洗脱至洗脱液无色,然后用50%(体积分数)的乙醇溶液洗脱,洗脱流速分别为0.5,1.0,1.5,2.0,2.5 mL/min,比较不同洗脱流速对解吸率的影响。
(5) 动态解吸曲线:在确定的最佳工艺条件下上样,上样结束后先用蒸馏水洗脱至洗脱液为无色,然后用50%(体积分数)的乙醇溶液以1 mL/min的流速进行洗脱,用自动收集器收集洗脱液,测定洗脱液中的黄酮浓度,绘制动态解吸曲线。
1.3.6 纯化效果评价
(1) 多糖含量及脱除率的计算:参见文献[20],以葡萄糖作为标准物制作标准曲线,得到的线性方程为:A=0.008 6C+0.033 2,R2=0.993 5。按式(4)、(5)计算纯化前后多糖含量及多糖脱除率。
(4)
(5)
式中:
w1——多糖含量,%;
R1——多糖脱除率,%;
c1——多糖浓度,mg/mL;
v——样品溶液体积,mL;
m——固形物质量,mg;
m1——纯化前多糖质量,mg;
m2——纯化后多糖质量,mg。
(2) 蛋白质含量及脱除率的计算:参见文献[21],采用考马斯亮蓝法测定乌饭树叶提取物中的蛋白质含量。线性回归方程为:A=0.002 0C-0.002 0,R2=0.999 1。按式(6)、(7)计算蛋白质脱除率。
(6)
(7)
式中:
w2——蛋白质含量,%;
R2——蛋白质脱除率,%;
c2——蛋白质浓度,mg/mL;
m3——纯化前蛋白质质量,mg;
m4——纯化后蛋白质质量,mg。
(3) 黄酮纯度的计算:根据1.3.2中黄酮的定量方法,计算纯化前后黄酮纯度,按式(8)计算黄酮纯度。
(8)
式中:
P——黄酮纯度,%;
c3——黄酮浓度,mg/mL。
(4) 纯化前后乌饭树叶黄酮HPLC谱图的比较:纯化前与纯化后的乌饭树黄酮溶液用0.22 μm的微孔膜过滤,进行HPLC分析。HPLC分析条件:紫外检测器;检测波长为370 nm;色谱柱VP-ODS C18(4.6 mm×250 mm,5 μm);流动相:甲醇∶水=0.44∶0.36(体积比);柱温30 ℃;流速0.8 mL/min;进样量5 μL;时间30 min。
2 结果与讨论
2.1 吸附树脂的选择
2.1.1 树脂的吸附与解吸比较 树脂的吸附和解吸性能与吸附剂的结构以及被吸附物的化学性质都有一定的关系[22]。由图1可知,4种树脂中,SP-825和NKA-II的吸附率与吸附量相对较高,这是由于SP-825和NKA-II2种树脂极性与乌饭树叶中黄酮类化合物极性较为接近,较易发生吸附行为。因此选择SP-825和NKA-II 2种树脂进行进一步的性能比较。
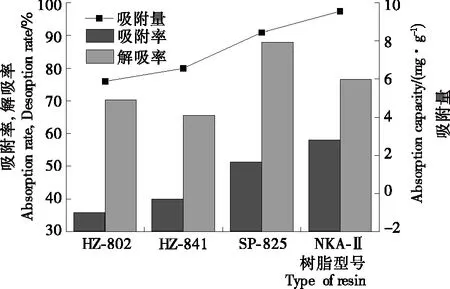
图1 静态吸附与解吸试验结果Figure 1 Results of static adsorption and desorption experiment
2.1.2 静态吸附动力学曲线 由图2可知,NKA-II树脂在3 h达到吸附平衡,SP-825树脂在4 h达到吸附平衡,并且NKA-II树脂对乌饭树叶黄酮的最大吸附量大于SP-825树脂的。因此选择大孔树脂NKA-II用于乌饭树叶黄酮的初步纯化。
2.2 乌饭树叶黄酮纯化工艺的确定
2.2.1 上样浓度对吸附率的影响 由图3可知,随着上样浓度的增大,黄酮的吸附量增加,但同时黄酮的吸附率却下降。这是由于大孔树脂本身吸附位点是一定的,随着上样浓度的提高,大孔树脂吸附位点接近饱和,致使黄酮损失严重,此外,随着上样浓度的增大,与黄酮发生竞争吸附的杂质浓度同样增大,影响了大孔树脂对乌饭树叶黄酮的吸附过程。考虑到高效地利用乌饭树叶黄酮,选择上样浓度为0.75 mg/mL。

图2 静态吸附动力学曲线Figure 2 Static adsorption kinetics curves
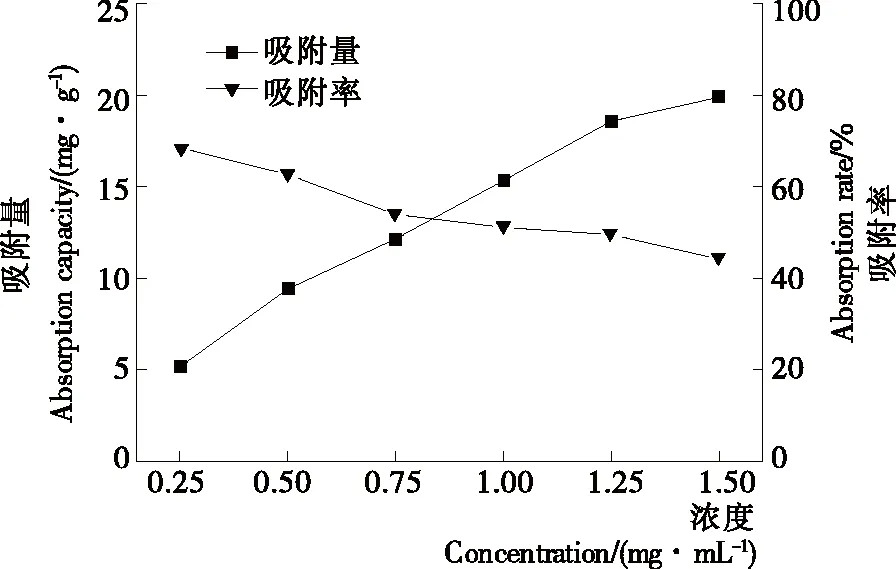
图3 上样浓度对吸附效果的影响Figure 3 Effect of initial concentration of flavones on adsorption
2.2.2 动态穿透曲线 穿透曲线是工业上吸附过程设计和操作的基础,由图4可知,当上样体积为2.0 BV时,流出液浓度基本稳定,说明吸附过程基本趋于平衡。因此确定合适的上样体积为2.0 BV。

图4 动态穿透曲线Figure 4 Dynamic breakthrough curve
2.2.3 乙醇体积分数对解吸率的影响 大孔树脂吸附乌饭树叶黄酮后,选择洗脱剂时主要考虑其极性对洗脱效果的影响,NKA-II树脂为中等极性的大孔树脂,因此选择中等极性溶剂洗脱。由图5可知,随着乙醇体积分数的增加,黄酮的解吸率也相应地增大,但是当乙醇体积分数>50%以后,解吸率变化缓慢,并且随着乙醇体积分数的增大,洗脱溶液中醇溶性杂质不断增加,最终导致乌饭树叶黄酮纯度下降。为了节约有机溶剂、提高纯化后黄酮纯度,选择50%的乙醇作为洗脱剂。
2.2.4 洗脱流速对解吸率的影响 由图6可知,随着洗脱流速的增加,解吸率逐渐降低,这是因为过高的洗脱流速,致使解吸过程中溶剂与黄酮类化合物接触时间较短,难以高效地将乌饭树叶黄酮洗脱。考虑到洗脱流速为0.5 mL/min时洗脱时间太长,因此选择洗脱流速为1.0 mL/min。

图5 乙醇浓度对洗脱效果的影响Figure 5 Effect of ethanol aqueous solution on desorption

图6 洗脱流速对洗脱效果的影响Figure 6 Effect of flow rate of elution on desorption
2.2.5 动态解吸曲线 由图7可知,NKA-II树脂吸附乌饭树叶黄酮较易洗脱,在洗脱剂用量为1 BV时,洗脱浓度达到最高,洗脱峰较为集中,当洗脱剂用量达到3 BV后,乌饭树叶黄酮基本被洗脱完。因此确定合适的洗脱体积为3 BV。

图7 动态解吸曲线Figure 7 Dynamic desorption curve
2.3 纯化效果评价
2.3.1 蛋白质、多糖脱除率以及黄酮纯度变化 纯化前后的乌饭树黄酮溶液在真空条件下进行干燥,对乌饭树黄酮溶液中的主要成分进行分析,结果见表2。由表2可知,NKA-II树脂能够有效脱除乌饭树黄酮溶液中蛋白质、多糖等杂质,大大提高了乌饭树叶黄酮纯度。
2.3.2 纯化前后乌饭树叶黄酮HPLC谱图比较 王立等[23]已经从乌饭树叶的提取物中分离出槲皮素,因此本研究利用槲皮素作为标准对照物,考察纯化前后乌饭树叶槲皮素纯度的变化。纯化前后HPLC谱图变化的结果见图8。由图8可知,纯化后槲皮素的相对峰面积明显提高,说明经过NKA-II树脂的纯化后,乌饭树叶槲皮素纯度明显提高。
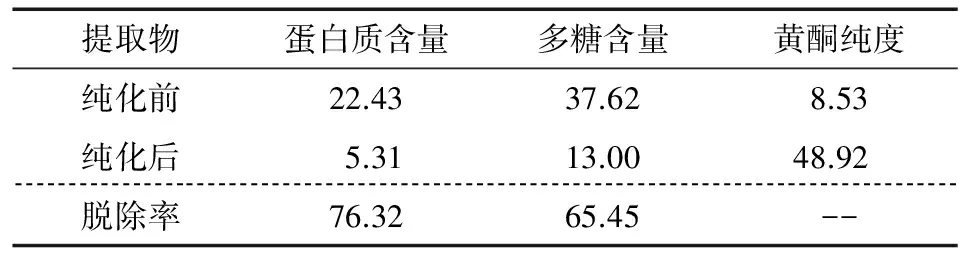
表2 乌饭树叶黄酮提取物中蛋白质、多糖含量及黄酮纯度Table 2 Content of protein and polysaccharide and purity of flavones from VBTL %
3 结论
大孔树脂已经广泛地应用于黄酮类化合物的分离纯化,树脂的结构和极性是影响其吸附性能的主要因素。本试验中所用的大孔树脂有极性、非极性和弱极性,通过静态吸附与解吸性能的比较,确定NKA-II树脂用于乌饭树叶黄酮的纯化,是由于乌饭树叶黄酮类化合物中的酚羟基具有一定的极性,有利于极性树脂的吸附。通过NKA-II树脂吸附于解吸乌饭树叶黄酮试验,确定乌饭树叶黄酮纯化工艺条件为:上样浓度0.75 mg/mL,上样流速1 mL/min,上样体积2.0 BV,洗脱流速1.0 mL/min,洗脱剂为50%(体积分数)的乙醇,洗脱体积3 BV。在该纯化工艺条件下,蛋白质脱除率为76.32%,多糖脱除率为65.45%,黄酮纯度达48.92%。通过纯化前后HPLC谱图的变化对纯化效果进行评价,结果表明经过NKA-II树脂纯化后,乌饭树叶提取物中槲皮素纯度明显提高。但是,纯化后总黄酮含量偏低,需要后期进行进一步研究,从而达到降低纯化过程中乌饭树叶黄酮损失的目的。除此之外,通过本试验并未得到黄酮类化合物单体,需要后期结合其他分离纯化手段对乌饭树叶黄酮进行进一步分离。

图8 纯化前后乌饭树叶黄酮HPLC谱图比较Figure 8 HPLC analysis of flavones from VBTL before and after purification
[1] 余清, 陈绍军, 庞杰.乌饭树叶有效成分的研究及其开发应用[J].食品与机械, 2007, 23(3): 171-174.
[2] 蔡凌云.乌饭树叶中总黄酮体外抗氧化活性[J].中成药, 2011, 33(6): 1 054-1 057.
[3] 程素娇, 邓璐璐, 章海燕, 等.乌饭树树叶多糖提取及纯化工艺优化研究[J].食品与机械, 2012, 28(6): 142-146.
[4] DANIELA B, LUISA T, FRANCESCA D G, et al.Antioxidant activities of sicilian prickly pear (opuntia ficus indica) fruit extracts and reducing properties of its betalains: betanin and indicaxanthin[J].Agricultural and Food Chemistry, 2002, 50(23): 6 895-6 901.
[5] 章海燕, 王立, 张晖.乌饭树树叶水溶性黄酮的抑菌作用的研究[J].中国食品添加剂, 2010(5): 62-67.
[6] EDZIRI H, MASTOURI M, AMMAR S, et al.Antimicrobial, antioxidant, and antiviral activities of retama raetam (forssk) webb flowers growing in Tunisia[J].World Journal of Microbiology and Biotechnology, 2008, 24(12): 2 933-2 940.
[7] GOMAH N.Antimicrobial activity of Calotropis procera Ait.(Asclepiadaceae) and isolation of four flavonoid glycosides as the active constituents[J].World Journal of Microbiology and Biotechnology, 2013, 29(7): 1 255-1 262.
[8] 黄丽娜, 马文领, 周健, 等.乌饭树叶醇提物抗大鼠精神疲劳作用[J].中国公共卫生, 2008, 24(8): 964-966.
[9] LIU Wei, ZHANG Su, ZU Yuan-gang, et al.Preliminary enrichment and separation of genistein and apigenin from extracts of pigeon pea roots by macroporous resins[J].Bioresource Technology, 2010, 101(12): 4 667-4 675.
[10] 邵金华, 何福林, 陈霞, 等.梓树根皮总黄酮分离纯化及其抑菌活性研究[J].食品与机械, 2017, 33(2): 140-144.
[11] LI Jie, CHEN Zhen-bin, DI Duo-long.Preparative separation and purification of Rebaudioside A from Stevia rebaudiana Bertoni crude extracts by mixed bed of macroporous adsorption resins[J].Food Chemistry, 2012, 132(1): 268-276.
[12] 刘雪辉, 张思, 张志旭, 等.大孔吸附树脂纯化薄荷总黄酮工艺优选[J].食品与机械, 2016, 32(8): 156-158.
[13] 刘火安, 贾云, 戴传云, 等.葛根总黄酮分离纯化的研究[J].生物技术通讯, 2005(5): 522-524.
[14] 陈义勇, 张德谨.乌饭树叶黄酮超声—微波辅助提取工艺的优化[J].食品与机械, 2016(1): 148-153.
[15] 王立, 姚惠源.乌饭树树叶中黄酮类色素的提取与分离纯化[J].食品与发酵工业, 2004, 30(9): 120-125.
[16] 王立, 唐小舟, 姚惠源, 等.乌饭树树叶中黄酮类色素清除活性氧自由基的研究[J].食品科学, 2005, 26(12): 98-102.
[17] 章海燕, 王立, 张晖.基于响应面分析法优化的乌饭树叶树叶水溶性黄酮提取条件[J].食品工业科技, 2010, 31(2): 260-263.
[18] 刘颖, 魏元峰, 蒋伟, 等.大孔树脂对黄芩黄酮吸附的初步研究[J].湖北中医学院学报, 2005, 7(2): 28-30.
[19] 张静.银杏黄铜纯化及生物活性研究[D].无锡: 江南大学, 2010: 24-25.
[20] 孟凡欣, 蒋朝军, 于笑坤, 等.刺五加多糖的提取及含量测定[J].食品工业科技, 2005, 26(7): 110-112.
[21] 王文平, 郭祀远, 李琳, 等.考马斯亮蓝法测定野木瓜多糖中蛋白质的含量[J].食品研究与开发, 2008, 29(1): 115-117.
[22] LIU Yong-feng, LIU Jun-xi, CHEN Xiao-fen, et al.Prepar-ative separation and purification of lycopene from tomato skins extracts by macroporous adsorption resins[J].Food Chemistry, 2010, 123(4): 1 027-1 034.
[23] 王立, 姚惠源, 陶冠军, 等.乌饭树树叶中槲皮素的提取分离与鉴定[J].食品与生物技术学报, 2005, 24(4): 89-91.

