曲妥珠单抗联合紫杉醇治疗对转移性乳腺癌患者血清CEA、CA-125及CA15-3的影响
陈亮 肖栋 梁明 翟超 张亦磊 郑明华 韩拓
(西安交通大学医学院附属3201医院肿瘤外科,陕西 汉中 723000)
乳腺癌在临床上较为常见,是女性恶性肿瘤之一[1],有文献报道,乳腺癌占各种女性恶性肿瘤的25%左右[2],其临床转移率和复发率较高。有资料统计,乳腺癌的临床发病率与各种女性恶性肿瘤相比,发病率最高[3]。近年来患者的发病年龄趋于年轻化,乳腺癌危害着女性患者的身体健康,临床上诊断乳腺癌主要通过病理学的方式,患者一旦确诊为乳腺癌,常常为癌症晚期,最佳的治疗时机已经错过[4]。有研究认为,早期诊断、发现并及时进行治疗能提高临床疗效和改善预后[5]。临床研究发现,肿瘤标志物的检测能有效反映机体因癌症而导致肿瘤标志物水平异常[6],能为乳腺癌的诊断、治疗、复发以及转移监测等提供依据。本研究旨在分析曲妥珠单抗联合紫杉醇对转移性乳腺癌患者血清CEA、CA-125及CA15-3的影响,现报告如下。
1 资料与方法
1.1 一般资料 收集2014年3月~2016年3月来我院接受诊治的患者中,选取80例转移性乳腺癌患者进行研究,回顾性分析所有患者的临床资料,将患者按随机数表法均分为两组,每组各40例。观察组患者实行曲妥珠单抗联合紫杉醇治疗,对照组患者使用单纯的曲妥珠单抗进行治疗,本次入选的患者纳入标准[7]:①经X线、B超证实为转移性乳腺癌,并且原发性肿瘤大于2cm;②患者生存期在3个月以上;③患者的超声检查显示具有可评价的病灶;④患者的血常规、心电图以及肝肾功能基本正常;⑤本次研究内容所有患者均知情并签署同意书,我院伦理委员会同意并批准本次研究。排除标准:①在治疗前接受过放疗或化疗的患者;②患者经检测显示肝肾功能异常;③患者还患有其他的恶性肿瘤;④对本次研究涉及的有关药物过敏。其中,观察组患者年龄18~66岁,平均年龄为(48.71±5.30)岁,转移部位数:1个6例,2个12例,3个19例,4个3例。对照组患者年龄在19~67岁,平均年龄为(49.10±5.44)岁,转移部位数:1个5例,2个13例,3个17例,4个5例。两组患者的一般资料比较差异无统计学意义(P>0.05),两组具有可比性。
1.2 方法 观察组和对照组患者采用的曲妥珠单抗(赫赛汀,Genentech Inc,批准文号:国药准字J20110020)使用方法和剂量等均相同,曲妥珠单抗使用剂量和方法具体如下:首次使用剂量为9mg/kg,之后的剂量保持在6mg/kg,将其溶于生理盐水中,在90min内滴完,药物不可快速滴注或静脉注射。在首次滴注曲妥珠单抗时,要对患者进行6小时的观察,如无不良事件的发生,则可以开始后续用药,第二次用药的观察期可以缩短到2小时。根据患者的实际体重,计算曲妥珠单抗使用的总量,并且无上限和下限,除此之外,治疗期间患者体重变化在10%以上,无论其体重是增加或减少,均应重新计算曲妥珠单抗的总量,3周重复一次。
观察组患者为联合用药,在患者首次给予曲妥珠单抗的前一天,静脉给予患者175mg/m2的紫杉醇(安素泰,Hospira Australia Pty Ltd,批准文号:进口药品注册证号H20090175),之后的紫杉醇用药与曲妥珠单抗均为同一天,间隔3周,并且曲妥珠单抗给予30min后在进行紫杉醇滴注。3周重复一次,为一个疗程,并且每位患者均治疗2个疗程以上。患者在每个疗程后进行一次常规检查。如果用药后有效的患者,应该连续进行治疗,直到病情发生变化或者达到相应的基线标准。每位患者均要进行3个疗程以上的治疗,治疗后记录患者的临床疗效及不良反应等。两组患者的血清CEA、CA-125及CA15-3水平检测,在清晨空腹采集其静脉血5ml,使用电化学发光法进行检测,检测均按照说明书进行。
1.3 观察指标 两组患者治疗后的血清CEA、CA-125及CA15-3水平变化情况比较;两组患者治疗后的近期临床疗效情况比较;两组患者治疗后发生的不良反应情况比较。
1.4 评定标准 近期临床疗效根据WHO实体瘤治疗后的疗效标准进行评定[8]:(完全缓解(CR),肿瘤病灶消失,并无新病灶出现;(部分缓解(PR),肿瘤病灶最大径减少大于30%;(稳定(SD),肿瘤病灶最大径减少大小于于30%,或增大小于20%;进展(PD),肿瘤病灶最大径增大大于20%,或者有新病灶出现。总有效率=(CR+PR)例数/总例数。血清CEA基线水平大于5ng/ml为异常,小于等于5ng/ml为正常;血清CA-125基线水平大于35U/ml为异常,小于等于35U/ml为正常;血清CA15-3基线水平大于32U/ml为异常,小于等于32U/ml为正常[9]。
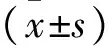
2 结果
2.1 两组治疗后血清CEA、CA-125及CA15-3水平变化情况比较 两组治疗前后的血清CEA、CA-125及CA15-3水平差异变化明显,并且观察组治疗后的血清CEA、CA-125及CA15-3水平低于对照组,差异有统计学意义(P<0.05),见表1。
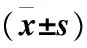
表1 两组治疗后的血清CEA、CA-125及CA15-3水平变化情况比较Table 1 Changes of serum CEA, CA-125 and CA15-3 levels in the two groups after treatment
注:t、P为观察组和对照组经过治疗后的血清CEA、CA-125及CA15-3水平对比,P<0.05
2.2 两组治疗后的近期临床疗效情况比较 观察组的有效率高于对照组,差异有统计学意义(P<0.05),见表2。
2.3 两组发生的不良反应比较 两组治疗后均有皮疹、恶心呕吐、中性粒细胞减少以及腹泻不良反应的情况发生;两组不良反应比较差异无统计学意义(P>0.05),见表3。

表2 两组治疗后的近期临床疗效情况比较[n×(10-2)]Table 2 Comparison of the short-term clinical efficacy of the two groups after treatment

表3 两组发生的不良反应比较[n×(10-2)]Table 3 Comparison of adverse reactions between the two groups
3 讨论
女性恶性肿瘤中乳腺癌的发病率为第一位,其威胁着女性患者的身体健康,临床上诊断乳腺癌主要通过病理学的方式,患者一旦确诊为乳腺癌,常常为癌症晚期,最佳的治疗时机已经错过[10]。临床常采用放疗、手术、化疗和生物治疗等方法治疗乳腺癌,其中综合治疗在乳腺癌有着重要地位[11-12]。有文献报道显示,生物治疗治疗乳腺癌应用较为广泛的药物主要有曲妥珠单抗、阿瓦斯汀以及拉帕替尼等[13-14]。曲妥珠单抗是第一个用于临床靶向治疗的人源化单抗药物,常用于转移性乳腺癌的治疗,其主要作用机制为与机体内的受体相结合,防止机体自身磷酸化和形成异源二聚体,从而抑制患者肿瘤细胞发生增殖[15]。
乳腺癌的临床转移率和复发率较高。因此,及早预防、诊断及治疗,对患者的临床疗效、生存期以及生活质量都有十分重要的意义[16]。目前常用的诊断乳腺癌的方法有病理学方法、影像诊断技术、肿瘤标志物检测法等[17-18]。有研究报道,肿瘤标志物的种类较多,主要有癌胎抗原性、酶类、糖类抗原志物等[19]。大量的研究显示,临床上常用的较为理想的肿瘤标志物均有以下几个特征[20]:①特异性较好,此类标志物可以很好的将肿瘤与非肿瘤区分出来;②衰期较短,此类标志物其水平的上升或下降,可以作为判断治疗效果、肿瘤的转移以及复发等情况;③灵敏度较高,此类标志物能使肿瘤尽早的被发现,进行早期诊断;④有器官特异性,此类标志物可以用于肿瘤定位;⑤检测其水平能判断肿瘤的分期、大小、预后等情况。CEA属于酸性糖蛋白,是非特异性肿瘤标志物之一,其对乳腺癌虽无特异性,但是其水平的异常与检测肿瘤标志物来预防、诊断、疗效评定以及预后分析患者的生存率相关,是检测肿瘤临床分期、治疗的疗效以及预后的重要指标,有较高临床价值[21]。CA-125是光谱标志物的一种,在癌症患者中其水平会显示不同程度的升高,其用于临床判断乳腺癌的价值较高[22]。CA15-3位于患者肿瘤细胞表面,当患者细胞癌变时,其含量升高,CA15-3水平能反映肿瘤的恶化或者缓解情况,可用于监测乳腺癌术后是否复发[23]。
研究显示,单独使用曲妥珠单抗的有效率在40%左右[24],但其与紫杉醇、多西他赛以及铂类药物联合使用具有协同增效的作用,联合使用的临床疗效更加显著[25]。本次研究显示联合使用药物的协同作用;另外,本次研究发现联合使用药物和单独使用药物均有皮疹、恶心呕吐、中性粒细胞减少以及腹泻不良反应情况发生。联合使用药物的患者与单独使用药物的患者不良反应比较间差异并不明显,所有患者的不良反应均在可控范围之内,以上的结果均与以往的报道相符。
4 结论
采用曲妥珠单抗联合紫杉醇的方案治疗转移性乳腺癌患者,可有效降低患者血清CEA、CA-125及CA15-3水平,两种药物联合使用能发挥协同作用,副作用较小,不良反应发生的几率较低,值得临床推广使用。
【参考文献】
[1]胡爱玲.曲妥珠单抗联合含紫杉类方案治疗HER -2阳性晚期乳腺癌疗效观察[J].现代中西医结合杂志,2015 ,1(35):3948-3950.
[2]刘立川,袁欣.曲妥珠单抗联合紫杉醇治疗CerbB-2基因过表达的转移性乳腺癌[J].中国药物与临床,2014,14(2) :248-249.
[3]王坤.帕妥珠单抗联合曲妥珠单抗和多西紫杉醇一线治疗转移性乳腺癌提高患者的总生存期[J].循证医学,2015,15(2):66.
[4]魏娜,倪青,戴民.术前应用曲妥珠单抗联合新辅助化疗对乳腺癌患者血清中血管新生因子及乳腺组织中凋亡相关分子的影响[J].中国现代医学杂志,2015,25(22):46-49.
[5]黄香,吴昊,李薇等.曲妥珠单抗联合紫杉醇脂质体和卡培他滨治疗HER-2阳性复发转移性乳腺癌[J].实用肿瘤杂志,2016,31(6):550-554.
[6]郝立群, 赵辉, 杨永净,等.Her-2阳性转移性乳腺癌的生物靶向治疗[J].现代肿瘤医学,2016,24(8):1227-1229.
[7]田奕,王平,马丽君.应用曲妥珠单抗联合多西紫杉醇治疗HER-2过表达乳腺癌患者的疗效观察及不良反应的护理[J].中国煤炭工业医学杂志,2014,17 (7):1178-1179.
[8]张钢龄,张培礼,朱敬军,等. 紫杉醇联合卡铂单周新辅助化疗加曲妥珠单抗在HER2阳性乳腺癌的探讨[J].中国中西医结合外科杂志,2015,21(5):463-466.
[9]朱华云,孙小峰,陈嘉,等.曲妥珠单抗联合白蛋白结合型紫杉醇治疗晚期乳腺癌的疗效和安全性[J].徐州医学院学报,2015,2 (11):752-755.
[10] Ikeda T,Jinno A,Matsu A. The role of neoadjuvant chemotherapy for breast cancer treatment[J].Breast Cancer,2014,9(1):1535-1537.
[11] 杨立平.曲妥珠单抗联合不同化疗药物治疗乳腺癌的临床疗效[J].医学临床研究,2015,3(8):1684-1686.
[12] Castaneda SA, Strasser J. Updates in the Treatment of Breast Cancer with Radiotherapy[J]. Surg Oncol Clin N Am, 2017, 26(3):371-382.
[13] 严颖,李惠平,邸立军,等.曲妥珠单抗治疗后进展的转移性乳腺癌继续曲妥珠单抗治疗的疗效及安全性分析[J].癌症进展.2016,14 (12):796-798.
[14] Ma S, Henson ES, Chen Y,etal. Ferroptosis is induced following siramesine and lapatinib treatment of breast cancer cells[J]. Cell Death Dis, 2016, 7(7):e2307.
[15] 李丽,秦建伟,韦达,等.曲妥珠单抗在乳腺癌新辅助化疗中的应用[J].肿瘤,2014 ,34 (11):396-398.
[16] 陈士华.联合检测CA15-3、CA125、CEA对乳腺癌的临床价值探讨[J].检验医学,2016,28(3):235-237.
[17] Taylor D, Lazberger J, Ives A,etal. Reducing delay in the diagnosis of pregnancy-associated breast cancer: How imaging can help us[J]. J Med Imaging Radiat Oncol, 2015, 55(1):33-42.
[18] Brouckaert O,Laenen A,Wildiers H,etal.The prognostic role of preoperative and (early) postoperatively change in CA15.3 serum levels in a single hospital cohort of primary operable breast cancers[J].The Breast,2013,3(3):320-325.
[19] 廖洪宇,龚建.血清CA15-3、CA125、CEA和PRL水平与乳腺癌及骨转移的关系[J].蚌埠医学院学报,2014,1(10):1418-1420.
[20] 吴晓燕,朱自力,张金业.肿瘤标志物检测在肺癌诊断中的临床应用价值探讨[J].检验医学,2014,2(5):578-580.
[21] 聂书伟,吕勇刚,易军.肺癌临床分期与肿瘤标志物CEA、CA15-3、NSE和CYFRA21-1相关性分析[J].临床军医杂志,2015,40(2):395-398.
[22] 刘苑欢,魏荣兴,邱群芳.联合检测 CA15-3、CA125、CEA对乳腺癌临床诊断价值探讨[J].实用癌症杂志,2014,1(4):406-408.
[23] Sandri T,Salvatici M,Botteri E,etal. Prognostic role of CA15.3 in 7942 patients with operable breast cancer [J].Breast cancer research and treatment,2013,1(1):618-622.
[24] 仲崇明,卞光荣,刘小林,等.血清相关肿瘤标志物在乳腺癌诊断的性能评价[J].中国实验诊断学,2013,15(2):254-256.
[25] 丁金旺,罗定存,叶柳青,等.血清TBX3、CA15-3及CEA联合检测对乳腺癌的诊断价值[J].医学研究杂志,2013,42(4):118-121.

