恶性腹膜间皮瘤25例临床分析
李宁宁,白春梅,王颖轶,葛郁平,赵 林
中国医学科学院 北京协和医学院 北京协和医院肿瘤内科,北京 100032
ActaAcadMedSin,2018,40(2):211-218
恶性间皮瘤是一种来源于浆膜的少见恶性肿瘤,可发生于胸膜、腹膜、心包、睾丸鞘膜。恶性腹膜间皮瘤(malignant peritoneal mesothelioma,MPM)占所有类型间皮瘤的1/5。该病起病隐匿、预后差[1]。目前主要治疗方法有减瘤手术(cytoreductive surgery,CRS)、腹腔热灌注化疗(heated intraperitoneal chemotherapy,HIPEC)、全身化疗等。本研究回顾性分析北京协和医院25例MPM患者的临床资料,进一步探讨其诊疗及预后因素。
对象和方法
对象收集1993至2017年北京协和医院收治的资料完整的恶性腹膜间皮瘤患者25例,所有患者均接受影像学及实验室检查,均经病理学确诊,病理学诊断符合2012年美国《间皮瘤病理学诊断指南》[2]。
方法对25例MPM患者的临床表现、病理特点、治疗、转归等进行回顾性总结,并分析疗效及预后因素。
统计学处理采用SPSS 16.0 统计软件进行统计分析。应用Kaplan-Meier生存分析、时序检验(log-rank test)进行单因素分析;应用Cox 比例风险回归模型进行多因素生存分析,评价预后因素。P<0.05为差异有统计学意义。
结 果
临床特点25例患者,男女比例1∶1.27。年龄22~67岁,中位年龄50岁。所有患者均无石棉接触史。临床表现为腹胀、腹痛、腹水、腹部包块等;发热7例,37.8~39.0度;血小板增多6例(24%)。23例患者病变局限于腹盆腔;2例(8%)患者出现腹腔外转移,其中1例为腹股沟淋巴结转移,1例为双侧内乳、心膈角及腹主动脉旁淋巴结转移。4例患者无症状意外诊断。24例(96%)患者肿瘤分型为弥漫型、1例(4%)为局限型。所有患者体力评分0~2分。5例(20%)患者接受减瘤手术;12例(48%)患者接受腹腔灌注化疗;24例(96%)患者接受全身化疗。
影像学及实验室检查所有患者均完善胸腹盆增强CT、血清肿瘤标记物及血沉、全血细胞分析、C反应蛋白等检查。部分患者行腹腔穿刺、腹腔镜探查术。胸腹盆增强CT:19例(76%)表现为腹盆腔积液,腹膜或网膜增厚25例(100%),胸腹腔淋巴结肿大4例(16%)。CA125增高(54~1642 U/ml)15例(60%),CA125值随病情变化波动。10例患者(40%)行腹腔穿刺,腹水均为渗出液,白细胞(300~28 439)×106/L;8例(88.8%)以单核细胞为主(60%~88%)。腹水细胞学检测7例,阳性率14.3%。血小板增多[(313~889)×109/L] 6例(24%)。血沉增高4例(16%)。C反应蛋白增高3例(12%)。19例(76%)患者行腹腔镜手术,术中见网膜或腹膜表面灰白色或粟粒样结节,大网膜或腹膜呈饼状、棉被样;11例可见肠管表面或肠系膜种植结节,受累部位有胃(1例)、小肠(3例)、阑尾(2例)、直乙交界(1例)。
病理及免疫组织化学特点24例患者经组织学确诊,1例经腹水细胞学确诊。25例均为上皮型;3例为乳头状间皮瘤,其中1例为分化良好的乳头状间皮瘤。25例患者均进行钙网膜蛋白、细胞角蛋白(cytokeratin,CK)5/6、肾母细胞瘤蛋白1(Wilms tumor 1,WT- 1)免疫组织化学检测,阳性率分别为36%、100%及92%。13例癌胚抗原染色,阳性率7.7%。10例增殖细胞相关的核抗原(Ki- 67)检测,Ki- 67≤5% 5例,Ki-67在20%~60% 5例。8例CK7及CK20染色,均为CK7(+)、CK20(-)。8例波形蛋白染色,阳性率87.5%。5例行P53染色,阳性率40%。人表皮膜抗原、转录因子配对盒基因8、雌激素受体、孕激素受体、基因系尾型同源盒基因、上皮细胞黏附分子、上皮细胞表面糖蛋白、LeuM1、Bg8、B72.3等检测,均为阴性。
治疗情况患者接受手术、腹腔灌注化疗、全身化疗等治疗。
肿瘤细胞减灭术:6例(24%)患者行CRS,其中4例切除受累的子宫、双附件、腹膜及大网膜;5例行肿大的腹腔淋巴结清扫,2例切除阑尾。1例患者进行2次肿瘤细胞减灭术。
腹腔(热)灌注化疗:腹腔灌注治疗12例(48%),11例应用化疗药物,1例应用白介素- 2(200万~400万U,周期21 d)。单药顺铂6例(50~100 mg,周期21 d);顺铂、5-氟尿嘧啶、阿糖胞苷联合灌注4例(PAFC方案;顺铂 100 mg,5-氟尿嘧啶750 mg,阿糖胞苷 300 mg,第1~2天;周期28 d),血管内皮抑素1例(45 mg,周期21 d)。
全身化疗及靶向治疗:24例患者行全身化疗。
16例培美曲塞化疗(500 mg/m2体表面积,周期21 d),中位周期数6。部分缓解(partial response,PR)4例(25%),稳定(stable disease,SD)10例(62.5%);客观缓解率(overall response rate,ORR)25%,疾病控制率(disease control rate,DCR)87.5%。中位无进展生存期(progression-free survival,PFS)8个月,中位总生存期(overall survival,OS)26个月。2例化疗与贝伐单抗(7.5 mg/m2体表面积,周期21 d)联合,疗效均为SD。2例患者在一线维持治疗时选用口服沙利度胺(50~125 mg/d),均因药物不良反应分别于2个月、6个月后停药。
3例应用紫杉醇(175 mg/m2,周期21 d)联合铂类(顺铂75 mg/m2体表面积或卡铂曲线下面积=5)化疗,ORR 33%;PFS分别为150、3个月;1例PFS未达到(>40个月)。OS为150、16个月,1例OS未达到。
5例应用含环磷酰胺方案(800 mg/m2体表面积,周期21 d)化疗,ORR 20%,DCR 60%;中位PFS 9个月;中位OS 26个月。
应用二线及以上治疗9例。二次应用培美曲塞治疗2例(500 mg/m2体表面积,周期21 d),其中1例同时联合口服索坦(12.5~50 mg/d),疗效PR,PFS未达到(>29个月);1例应用培美曲塞联合顺铂(75 mg/m2体表面积,周期21 d),疗效SD,PFS未达到(>24个月)。二线应用紫杉醇联合卡铂2例,PFS分别为4、8个月。吉西他滨(1 g/m2体表面积;第1、8天,周期21 d)化疗3例,中位PFS 2个月。应用拓扑替康[剂量1.2 mg/(m2体表面积·d),第1~5天;周期21 d]、FOLFOX6(奥沙利铂85 mg/m2体表面积,第1天;氟尿嘧啶400 mg/m2体表面积,第1天+1200 mg/m2体表面积,持续静脉输注,第1~2天;亚叶酸钙400 mg/m2体表面积,周期14 d)各1例,PFS 1.5个月。
疗效与预后因素统计分析25例患者的随访时间5~288个月,观察的起始时间为患者腹膜间皮瘤的确诊日期,观察终点为随访日期2017年5月25日。所有患者的中位OS 26个月;1、2、5年生存率分别为74.2%、52.4%和16.7%。生存曲线见图1。25例患者病情进展均出现在腹盆腔,主要表现为腹胀、腹腔积液增多、血清CA125增高等;其中1例患者原腹主动脉旁转移淋巴结在腹膜病变进展同时进行性增大。

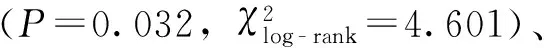

对年龄(<50岁/≥50岁)、性别(男/女)、体力评分(<2分/≥2分)、血小板水平(正常/升高)、减瘤术(手术/未手术)应用COX比例风险模型进行多因素生存分析,结果显示是否接受减瘤手术(P=0.018)是腹膜间皮瘤的独立预后因子。风险比=6.889(95%CI=1.386~34.247)(表2)。此外,体力评分较好有生存延长的趋势(P=0.057)。

图125例患者的Kaplan-Meier生存曲线
Fig1Kaplan-Meier survival curve of 25 patients

表 1 25例恶性腹膜间皮瘤患者预后的单因素分析Table 1 Univariate analysis of survival predictors for 25 patients with malignant peritoneal mesothelioma
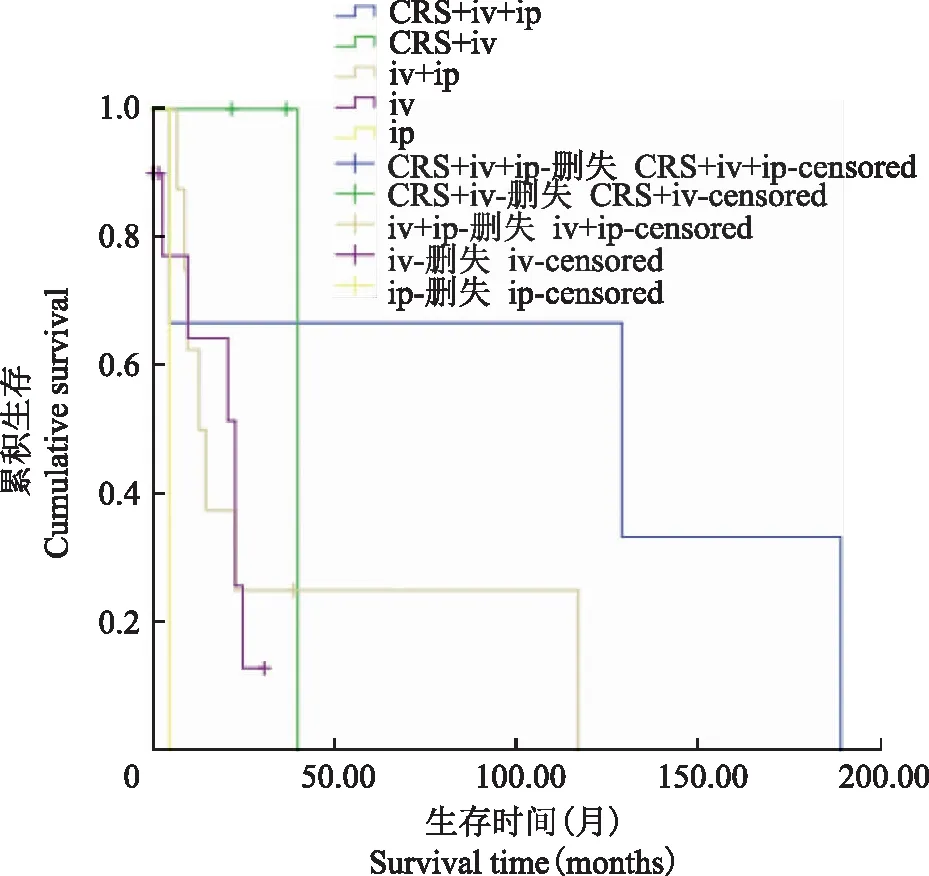
CRS:减瘤手术;iv:静脉化疗;ip:腹腔灌注
CRS:cytoreductive surgery;iv:intravenous chemotherapy;ip:peritoneal perfusion
图2不同治疗模式的Kaplan-Meier生存曲线
Fig2Kaplan-Meier survival curves of different modes of therapy

图3不同性别的 Kaplan-Meier生存曲线
Fig3Kaplan-Meier survival curves of gender

图4是否进行减瘤术的 Kaplan-Meier生存曲线
Fig4Kaplan-Meier survival curves of cytoreductive surgery
讨 论
MPM为罕见肿瘤,近年来,全球总发病率有所上升。MPM起病隐匿,临床表现为腹痛、腹胀等;少数病例无症状偶然发现;本研究患者临床表现大体与文献报道相符,其中7例患者起病时有发热,发热程度不等,部分伴有血小板增多,考虑为副肿瘤综合征。研究显示间皮瘤患者中,可伴有发热、血小板增多、低血糖、血栓、溶血性贫血等副肿瘤现象出现[3- 5]。本研究将出现发热及血小板增多患者的预后与其余患者对比分析,未得到差异有统计学意义的结论。由于MPM症状不特异,诊断较难,需借助CT、超声等影像学手段及血清学标记物协助诊断。CA125是一种糖蛋白类肿瘤相关抗原,约25% MPM患者可有CA125增高,但较难用于诊断,可用于监测疗效及疾病进展[6]。本研究基线CA125增高患者的预后与正常患者的预后无差异,但CA125水平的确反映了疾病的变化趋势。有关腹膜间皮瘤临床特征、外周血生物标记物

表 2 25例恶性腹膜间皮瘤患者预后多因素分析Table 2 Multivariate Cox regression analysis of survival predictors for 25 patients with malignant peritoneal mesothelioma
谱是否与预后相关,目前无统一结论;笔者认为,本研究在临床因素与预后关系方面的探索,仍有扩大样本量进一步研究的价值。
本研究25例患者的病理表现均为上皮型间皮瘤。世界卫生组织将MPM分为上皮型、肉瘤型、混合型。上皮型最常见,预后较好,分化良好的乳头状间皮瘤是MPM的变异型,恶性度更低;本研究1例分化良好的乳头状MPM患者生存期达120个月,预后远优于其他24例患者。由于为回顾性分析,本研究25例患者的免疫组织化学染色指标的选择不完全相同,这是因为目前尚无敏感性和特异性均较好的单一标志物可用于免疫组织化学诊断恶性间皮瘤,有学者认为,两种间皮细胞的阳性标记物与用以鉴别其他肿瘤的阴性标记物联用,可提高诊断准确性[2]。本研究采用的指标中,阳性表达的有人表皮膜抗原、钙网膜蛋白、CK 5/6、WT- 1、间皮素等;阴性的有癌胚抗原、Ber-EP4、LeuM1、Bg8、B72.3等。一项52例胸膜间皮瘤的回顾性分析显示,WT- 1表达阳性的上皮型患者OS明显延长[7]。一项多中心前瞻性队列研究显示,Ki- 67低表达(<15%)预后较好[8]。在腹膜间皮瘤中,对于免疫组织化学与生存的探索较少,因此,本研究针对免疫组织化学标记物WT- 1、P53、Ki- 67与生存进行分析,未得到差异有统计学意义的结论,考虑与每组样本量较小有关。
本研究6例患者进行减瘤手术,12例患者进行腹腔热灌注化疗,统计结果显示,接受减瘤术的患者OS明显延长,提示局部治疗在MPM的治疗选择中至关重要。多中心回顾性研究显示,应用CRS-HIPEC患者,OS在30~92个月,5年生存率41%~43%[9]。初始CRS-HIPEC后复发的患者,再次接受该治疗的患者OS达54个月[10];手术减瘤效果好的患者,灌注获益更多[11]。因此,目前CRS联合HIPEC也是国际上针对MPM的治疗推荐。本研究腹腔化疗选择的药物有顺铂、氟尿嘧啶、阿糖胞苷;文献报道的丝裂霉素、多柔比星、紫杉醇等[12]未纳入选择,分析可作为后线的药物选择。本研究1例患者应用血管内皮抑素灌注与静脉化疗结合,PFS 5个月。血管内皮抑素用于腹腔的研究数据不多,有个例报道,将血管内皮抑素应用于间皮瘤患者的腹腔灌注,联合静脉化疗,PFS大于27个月;且治疗后腹腔积液明显减少[12]。
本研究大部分患者选择培美曲塞为基础的全身化疗,分析结果显示,培美曲塞化疗组较其他药物组无生存优势,可能与样本量小有关;本研究应用紫杉醇及环磷酰胺化疗的患者,其不良反应可耐受,生存期达16~150个月。目前认为,全身化疗是除CRS-HIPEC外合理的治疗选择;大部分研究支持选用含培美曲塞的方案,若患者体力状态好可考虑联合铂类治疗。2002至2004年,一项纳入1056例间皮瘤患者的Ⅲ期临床研究中,98 例(9.3%)为腹膜间皮瘤患者,应用培美曲塞联合顺铂治疗6周期,DCR达71.2%,中位OS 13.1个月[13]。吉西他滨、伊立替康、长春瑞滨等药物在MPM中的有效性仍未得到证实[14- 16],可作为二线选择。本研究应用的紫杉醇及环磷酰胺化疗的相关研究数据较少,笔者认为有扩大样本量进一步研究的意义。本研究3例患者在CRS-HIPEC基础上联合全身化疗,耐受较好,这种治疗模式目前有一定争议。2016年Kepenekian等[17]研究显示,新辅助化疗降低5年生存率,而辅助化疗与CRS-HIPEC联合,有改善生存的趋势。对于分化良好的乳头状间皮瘤,目前认为其手术切除后治愈率较高,不建议进行广泛的CRS和HIPEC;但需长期随访[18]。
考虑到腹膜间皮瘤为血管较丰富的肿瘤,在治疗选择上,有抗血管生成作用的靶向药物可能使患者获益,因此,本研究1例患者在一线化疗及维持治疗中均选用舒尼替尼治疗,耐受可,至今存活,OS>42个月。舒尼替尼是针对血管内皮细胞生长因子受体、血小板衍生生长因子受体β及原癌基因c-kit的多靶点酪氨酸激酶抑制剂;一项纳入53例胸膜间皮瘤患者的Ⅱ期临床研究显示,6例达PR,34例SD[19]。在胸膜间皮瘤中的数据与本研究MPM患者的治疗探索中初步一致,提示可有更多的靶向药物可作为选择参考。一项前瞻性研究在吉西他滨和顺铂全身化疗基础上加用抗血管生成药物贝伐单抗,PFS和OS无延长[20]。索拉菲尼[21]、伊马替尼[22]等小分子多靶点酪氨酸激酶抑制剂的研究仍在进行中。本研究2例患者应用同样具有抗血管生成作用的沙利度胺维持治疗,耐受不佳。沙利度胺是对血管内皮细胞生长因子、成纤维生长因子、转化生长因子β均有抑制作用的药物;Ⅱ期临床研究显示,胸膜间皮瘤患者一/二线用药,ORR 11%~14%,OS 11个月[23]。一项胸膜间皮瘤的Ⅲ期研究中,一线含培美曲塞方案化疗后应用沙利度胺维持治疗,研究组与安慰剂组的疾病进展时间差异无统计学意义(3.6个月比3.5个月)[24]。沙利度胺在MPM中的有效性仍需进一步研究证实。
MPM患者的预后差,淋巴结受累、腹腔外转移、高龄、男性均为不良预后因素[25]。本研究的预后分析中,体力评分较好的患者有预后好的趋势,但差异无统计学意义;性别仅在单因素分析中有预后意义。美国癌症和白血病B组在337例恶性间皮瘤患者中,评估了临床特征对生存的影响,研究显示胸膜受累、血清乳酸脱氢酶大于500 U/L、体力状态差、胸痛、血小板计数大于400 000/μl、非上皮型以及大于75岁共同提示生存期较短[26]。
综上,本研究回顾性分析了25例腹膜间皮瘤患者的临床及病理特征、治疗及转归,由于MPM为罕见病,样本量小,为回顾性分析,部分统计学分析未得到差异有统计学意义的结论,仍需扩大样本量进一步研究。期待有更多关于治疗模式、靶向药物、生物标记物方面的前瞻性随机对照研究,以期延长腹膜间皮瘤患者的生存。
[1] Yan TD,Welch L,Black D,et al. A systematic review on the efficacy of cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for diffuse malignancy peritoneal mesothelioma[J]. Ann Oncol,2007,18(5):827- 834. DOI:10. 1093/annonc/mdl428.
[2] Husain AN,Colby T,Ordonez N,et a1. Guidelines for pathologic diagnosis of malignant mesothelioma:2012 update of the consensus statement from the International Mesothelioma Interest Group[J]. Arch Pathol Lab Med,2013,137(5):647- 667. DOI:10. 5858/arpa. 2012- 0214-OA.
[3] Selleslag DL,Geraghty RJ,Ganesan TS,et al. Autoimmune haemolytic anaemia associated with malignant peritoneal mesothelioma[J]. Acta Clin Belg,1989,44(3):199. DOI:10. 1080/17843286. 1989. 11718015.
[4] Manzini Vde P,Recchia L,Cafferata M,et al. Malignant peritoneal mesothelioma:a multicenter study on 81 cases[J]. Ann Oncol,2010,21(2):348. DOI:10. 1093/annonc/mdp307.
[5] Eltabbakh GH,Piver MS,Hempling RE,et al. Clinical picture,response to therapy,and survival of women with diffuse malignant peritoneal mesothelioma[J]. J Surg Oncol,1999,70(1):6-12.
[6] Baratti D,Kusamura S,Martinetti A,et al. Circulating CA125 in patients with peritoneal mesothelioma treated with cytoreductive surgery and intraperitoneal hyperthermic perfusion[J]. Ann Surg Oncol,2007,14(2):500- 508. DOI:10. 1245/s10434- 006- 9192- 8.
[7] Cedrés S,Montero MA,Zamora E,et al. Expression of Wilms’ tumor gene(WT1) is associated with survival in malignant pleural mesothelioma[J]. Clin Transl Oncol,2014,16:776- 782. DOI:10. 1007/s12094- 013- 1146- 6.
[8] Ghanim B,Klikovits T,Hoda MA,et al. Ki- 67 index is an independent prognostic factor in epithelioid but not in non-epithelioid malignant pleural mesothelioma:a multicenter study[J]. Br J Cancer,2015,112(5):783- 792. DOI:10. 1038/bjc. 2015. 9.
[9] Alexander HR Jr,Bartlett DL,Pingpank JF,et al. Treatment factors associated with long-term survival after cytoreductive surgery and regional chemotherapy for patients with malignant peritoneal mesothelioma[J]. Surgery,2013,153(6):779- 786. DOI:10. 1016/j. surg. 2013. 01. 001.
[10] Ihemelandu C,Bijelic L,Sugarbaker PH. Iterative cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for recurrent or progressive diffuse malignant peritoneal mesothelioma:clinicopathologic characteristics and survival outcome[J]. Ann Surg Oncol,2015,22(5):1680. DOI:10. 1245/s10434- 014- 3977-y.
[11] Blackham AU,Shen P,Stewart JH,et al. Cytoreductive surgery with intraperitoneal hyperthermic chemotherapy for malignant peritoneal mesothelioma:mitomycin versus cisplatin[J]. Ann Surg Oncol,2010,17(10):2720- 2727. DOI:10. 1245/s10434- 010- 1080- 6.
[12] Chen X,Liu Y,Yin Y,et al. Recombinant human endostatin(endostar) decreased recurrent ascites,pleural fluid and ascitic VEGF in a case of advanced mesothelioma[J]. J Chemother,2012,24(4):231- 236. DOI:10. 1179/1973947812Y. 0000000023.
[13] Jänne PA,Wozniak AJ,Belani CP,et al. Open-label study of pemetrexed alone or in combination with cisplatin for the treatment of patients with peritoneal mesothelioma:outcomes of an expanded access program[J]. Clin Lung Cancer,2005,7(1):40. DOI:10. 3816/CLC. 2005. n. 020.
[14] Campbell NP,Kindler HL. Update on malignant pleural mesothelioma[J]. Semin Respir Crit Care Med,2011,32(1):102- 110. DOI:10. 1055/s- 0031- 1272874.
[15] Le DT,Deavers M,Hunt K,et al. Cisplatin and irinotecan(CPT- 11) for peritoneal mesothelioma[J]. Cancer Invest,2003,21(5):682- 689. DOI:10. 1081/CNV- 120023766.
[16] Steele JP,Shamash J,Evans MT,et al. Phase Ⅱ study of vinorelbine in patients with malignant pleural mesothelioma[J]. J Clin Oncol,2000,18(23):3912- 3917. DOI:10. 1200/JCO. 2000. 18. 23. 3912.
[17] Kepenekian V,Elias D,Passot G,et al. Diffuse malignant peritoneal mesothelioma:evaluation of systemic chemotherapy with comprehensive treatment through the RENAPE Database:Multi-Institutional Retrospective Study[J]. Eur J Cancer,2016,65:69- 79. DOI:10. 1016/j. ejca. 2016. 06. 002.
[18] Bürrig KF,Pfitzer P,Hort W. Well-differentiated papillary mesothelioma of the peritoneum:a borderline mesothelioma. Report of two cases and review of literature[J]. Virchows Arch A Pathol Anat Histopathol,1990,417(5):443.
[19] Nowak AK,Millward MJ,Creaney J,et al. A phase Ⅱ study of intermittentsunitinib malate as second-line therapy in progressive malignant pleural mesothelioma[J]. J Thorac Oncol,2012,7(9):1449- 1456. DOI:10. 1097/JTO. 0b013e31825f22ee.
[20] Kindler HL,Karrison TG,Gandara DR,et al. Multicenter,double-blind,placebo-controlled,randomized phase Ⅱ trial of gemcitabine/cisplatin plus bevacizumab or placebo in patients with malignant mesothelioma[J]. J Clin Oncol,2012,30(20):2509- 2515. DOI:10. 1200/JCO. 2011. 41. 5869.
[21] Papa S,Popat S,Shah R,et al. Phase 2 study of sorafenib in malignant mesothelioma previously treated with platinum-containing chemotherapy[J]. J Thorac Oncol,2013,8(6):783- 787. DOI:10. 1097/JTO. 0b013e31828c2b26.
[22] Porta C,Mutti L,Tassi G. Negative results of an Italian Group for Mesothelioma(G. I. Me. ) pilot study of single-agent imatinib mesylate in malignant pleural mesothelioma[J]. Cancer Chemother Pharmacol,2007,59(1):149- 150. DOI:10. 1007/s00280- 006- 0243- 4.
[23] Pavlakis N,Abraham R,Harvie R. Thalidomide alone or in combination with cisplatin/gemcitabine in malignant pleural mesothelioma(MM);interim results from two parallel non randomized phase Ⅱ studies[J]. Lung Cancer,2003,41(2):11.
[24] Buikhuisen WA,Burgers JA,Vincent AD,et al. Thalidomide versus active supportive care for maintenance in patients with malignant mesothelioma after first-line chemotherapy(NVALT 5):an open-label,multicentre,randomised phase 3 study[J]. Lancet Oncol,2013,14(6):543- 551. DOI:10. 1016/S1470- 2045(13)70125- 6.
[25] Yan TD,Deraco M,Baratti D,et al. Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy for malignant peritoneal mesothelioma:multi-institutional experience[J]. J Clin Oncol,2009,27(36):6237- 6242. DOI:10. 1200/JCO. 2009. 23. 9640.
[26] Edwards JG,Abrams KR,Leverment JN,et al. Prognostic factors for malignant mesothelioma in 142 patients:validation of CALGB and EORTC prognostic scoring systems[J]. Thorax,2000,55(9):731. DOI:10. 1136/thorax. 55. 9. 731.

