米虾鞣化激素的表达特征分析及体外合成
任丽琦,翁洁羊,王 鑫,孙金生,李 冉
(天津师范大学生命科学学院,天津市动植物抗性重点实验室,天津 300387)
许多节肢动物会发生周期性的蜕皮。当蜕去坚硬的、旧的外骨骼后由真皮分泌产生的新表皮比较柔软,对动物生长有利,但是不能有力地抵抗病原微生物的侵染,甚至易受到其他机械损伤等,所以需要迅速进行鞣化(黑化和硬化)。
Cottrell[1]和Fraenkel等[2]最早发现了鞣化激素的功能,他们认为正常发育的红头丽蝇(Calliphoraerythrocephala)体内存在某种调节因子,这种调节因子可以使刚羽化的红头丽蝇在颈部进行结扎处理后,胸部和腹部的表皮仍能够继续鞣化。Fraenkel等[3]将该物质命名为鞣化激素(Bursicon)。研究发现鞣化激素在三氯乙酸、乙醇、丙酮等溶液中均会产生沉淀而且不能够成功透析,乙醇和枯草杆菌又可将其灭活,证明鞣化激素属于蛋白质。之后几乎同时的2项研究表明鞣化激素是一种异源二聚体,由2个胱氨酸结蛋白亚基构成,分别被命名为BURS (α)和PBURS (β)[4-5]。α和β亚基都是胱氨酸结蛋白,2个亚基的氨基酸序列中都包含11个半胱氨酸,C3和C4间的氨基酸序列均为X-G-X (X可以为任意的氨基酸),C6和C7相邻,C9和C10间只有1个氨基酸,α和β这2个亚基通过C6结合在一起[4]。
在黑腹果蝇(Drosophilamelanogaster)中鞣化激素的受体,是一种G蛋白偶联受体,即DLGR2,其由rickets基因编码[6]。受体DLGR2被激活后,经由cAMP/PKA通路调控表皮的鞣化和翅的伸展[6-8]。利用基因芯片分析方法在颈部结扎黑腹果蝇中,找到了87个受鞣化激素调控的下游基因。其中已知功能的基因大多与表皮的鞣化以及翅的伸展有关,还有7个基因与免疫调控有关[9]。鞣化激素的2个亚基还可以分别形成各自的同源二聚体并参与免疫反应[10]。
在蛛形纲[11]、昆虫纲[12-15]和甲壳纲[16-20]中都含有鞣化激素,而且鞣化激素主要分布在神经细胞中[15-20]。但是其在米虾中的分布及其蛋白结构鲜有报道。米虾属于甲壳纲(Crustacea)、匙指虾科(Atyidae),具有繁殖周期短、生长快、个体小等特点,适合作为试验材料。笔者选取米虾为研究对象,观察其胚胎的发育过程,实时荧光定量PCR检测鞣化激素在米虾不同组织中的分布,并利用原核表达的方式表达鞣化激素2个亚基基因的蛋白,为进一步研究鞣化激素在米虾中的功能提供基础资料。
1 材料与方法
1.1材料米虾购于浙江水产市场,每只体重50~100 mg,将米虾养在实验室26~28 ℃的曝气水中,每日投喂2次虾粮,每隔2 d更换新鲜的曝气水。
1.2主要试剂TRIzol®Reagent购于Thermo Fisher Scientific;氯仿、异丙醇、无水乙醇等有机试剂购于普博欣生物科技有限责任公司;TransScript®one-step gDNA Removal and cDNA Synthesis SuperMix购于北京全式金生物技术有限公司;限制性内切酶、ExTaq酶购于TaKaRa;AceQ qPCR SYBR Green Master Mix购于南京诺唯赞生物科技有限公司;胶回收试剂盒、质粒提取试剂盒、LB液体培养基、LB固体培养基、琼脂糖、抗生素、无酶水、SDS、APS、TEMED等购于生工生物工程股份有限公司。
1.3主要仪器冷冻离心机(Eppendorf)、超微量分光光度计(Thermo Fisher Scientific)、PCR仪(Bio-Rad Laboratories)、电泳仪(北京六一生物科技有限公司)、凝胶成像仪(Bio-Rad Laboratories)、电热恒温水浴锅(国华电器有限公司)、pH仪(METTLER TOLEDO)、高温高压灭菌锅(天津亿诺科学仪器有限公司)、超净工作台(Airtech)、恒温培养振荡器(上海智城分析仪器制造有限公司)、生化培养箱(广东省医疗器械厂)、超声波细胞粉碎机(宁波新芝生物科技股份有限公司)、蛋白胶电泳仪(ATTO Corpration)、水平摇床(太仓市科教器材厂)、7500FAST荧光定量PCR仪(ABI)。
1.4方法
1.4.1观察米虾胚胎发育过程。挑选个体较大、体质健壮、性成熟的米虾作为亲体,将雌雄按比例1∶2混养在同一虾缸内,温度维持在25 ℃。待雌虾抱卵后单独喂养。抱卵6 h时,虾卵在水中进行离体培养。用显微镜观察并拍照,记录米虾的胚胎发育进程。
1.4.2米虾RNA的提取和cDNA第一条链的合成。参考TRIzol®Reagent 试剂说明书提取米虾的总RNA,超微量分光光度计测其浓度后,用1%琼脂糖凝胶检测RNA的提取质量。取2 μg RNA反转录形成cDNA的第一条链。选用β-actin内参基因(引物为β-actinF、β-actinR,表1)进行PCR检测cDNA模板。

表1 试验所用的引物序列
1.4.3bursicon-α和bursicon-β基因表达载体的构建。根据转录组提示,设计扩增bursicon-α、bursicon-β去掉信号肽后的ORF区的特异性引物bursicon-αF、bursicon-αR、bursicon-βF、bursicon-βR(表1)。由于后续试验需要构建2个亚基基因的表达载体,所以在上游引物的5’端和下游引物的3’端分别引入了BamH I和Hind Ⅲ酶切位点。以反转录获得的米虾cDNA为模板,参照ExTaq酶说明书进行PCR扩增。bursicon-α反应条件是94 ℃预变性4 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。bursicon-β的退火温度是64 ℃,其余与bursicon-α相同。PCR产物经胶回收试剂盒切胶回收纯化后和pMD18-T载体连接,构建pMD18-T-α、pMD18-T-β克隆载体并转入DH5α中。参照质粒小提试剂盒说明书提取pMD18-T-α、pMD18-T-β以及pET-28a-c(+)质粒。用限制性内切酶BamH I和Hind Ⅲ双酶切后进行琼脂糖凝胶电泳,切胶回收目的基因片段和酶切后的表达载体。回收的片段用T4连接酶连接,构建重组表达质粒pET-28a-α、pET-28a-β并转入DH5α中。在加有卡那霉素的LB平板上筛选,挑取阳性克隆,并用双酶切检测。最后将阳性克隆菌液送到金唯智生物科技有限公司进行测序。
1.4.4重组质粒pET-28a-α、pET-28a-β表达条件的优化。将测序正确的pET-28a-α或pET-28a-β重组质粒转入Rosetta表达菌中。分别接这2种表达菌80 μL到6 mL的LB培养基中(培养基中加有卡那霉素和壮观霉素)过夜培养,培养条件为37 ℃、220 r/min。次日复摇菌液到50 mL的培养基中,当OD值是0.6时,取1 mL菌液作为对照,之后加入IPTG诱导菌液表达。诱导条件选用16 ℃、150 r/min,IPTG终浓度为0.5 mmol/L时,分别取诱导3、8和24 h菌液各1 mL。诱导条件选用37 ℃、220 r/min,IPTG终浓度为1 mmol/L时,分别取诱导1、2、3、4、5和6 h的菌液各1 mL。将取到的菌液分别离心收集菌体,SDS-PAGE凝胶电泳进行检测。
1.4.5重组蛋白Bursα和Bursβ的大量诱导与纯化。将含有pET-28a-α或pET-28a-β重组质粒的Rosetta表达菌分别接入到600 mL的LB培养基中进行培养,培养条件为37 ℃、220 r/min。当OD值为0.6时,加入终浓度为1 mmol/L的IPTG并在37 ℃下诱导,6 h后4 ℃、10 000 r/min离心10 min,收集菌体。菌体在破碎缓冲液BufferA中用超声波破碎,4 ℃、10 000 r/min离心10 min,收集上清。沉淀用洗涤缓冲液BufferB去除杂蛋白后溶解在含8 mol/L尿素的Wash I里。BufferA、BufferB和Wash I中的蛋白用SDS-PAGE凝胶电泳进行检测。由于镍柱可以与目的蛋白上的6个组氨酸标签特异性结合,所以选用Ni-NTA纯化目的蛋白,用洗脱缓冲液(咪唑的浓度为500 mmol/L)洗脱亲和柱,收集洗脱峰液。对纯化后的Bursα和Bursβ进行SDS-PAGE凝胶电泳检测。
1.4.6定量PCR分析米虾鞣化激素在不同组织中的表达。依据转录组提示设计了bursicon-α和bursicon-β的定量PCR引物bursicon-αQPCR F、bursicon-αQPCR R、bursicon-βQPCR F、bursicon-βQPCR R(表1)。分别提取米虾眼柄、心、胸神经节和腹神经节组织的RNA,并反转录获得cDNA(方法同“1.4.2”)。分别以4个组织的cDNA为模板,利用实时荧光定量PCR仪检测bursicon-α和bursicon-β在不同组织中的相对表达量。内参基因选用β-actin。每组数据重复3次,2-△△Ct法计算基因的相对表达量,用软件SPSS17.0分析表达差异,最后用Origin 8.0作图。
2 结果与分析
2.1米虾的胚胎发育过程将雌虾刚刚开始抱卵时计为0 h,整个胚胎发育阶段包括卵裂期、囊胚期、原肠期、前无节幼体期、后无节幼体期、复眼色素形成期以及蚤状幼体期共7个时期(图1)。在水温约26 ℃时胚胎发育经历大约19 d。
2.2米虾Bursα和Bursβ重组蛋白的表达
2.2.1表达质粒pET-28a-α、pET-28a-β的构建及鉴定。将bursicon-α和bursicon-β编码信号肽的核酸序列去掉后,序列片段大小分别为363、348 bp。构建的表达质粒pET-28a-α、pET-28a-β用BamH I和Hind Ⅲ进行双酶切鉴定,结果α和β目的片段的大小符合预期试验结果(图2)。表达质粒经测序后与转录组中2个亚基的核苷酸序列在BioEdit软件中进行比对,发现核苷酸序列没有产生突变,说明表达质粒构建成功。

注:1.卵裂期;2.囊胚期;3.原肠期;4.前无节幼体期;5.后无节幼体期;6.复眼色素形成期;7.蚤状幼体期;8.米虾幼体Note:1.cleavagestage; 2.blastula; 3.gastrula; 4.egg-nauplius stage; 5.egg-metanauplius stage; 6.embryo with eye pigments formed stage; 7.prehatching stage; 8.the larvae of Caridina图1 米虾胚胎发育过程Fig.1 The process of embryo development in Caridina

注:M.DL2000标记;1.pET-28a-α重组质粒双酶切产物;2.pET-28a-β重组质粒双酶切产物Note:M.DL2000 Marker;1.double enzyme products of pET-28a-α recombinant plasmid; 2.double enzyme products of pET-28a-β recombinant plasmid图2 重组质粒的酶切鉴定Fig.2 Identification of recombined plasmid by restriction enzyme
2.2.2重组蛋白Bursα、Bursβ表达条件的筛选。为了促使bursicon-α和bursicon-β在Rosetta菌中的表达,对IPTG的浓度、温度等各种原核表达的条件进行了探讨。α亚基去掉信号肽后蛋白的相对分子量大小约13.15 kD,加上表达载体pET-28a-c(+)上的His标签蛋白后,重组Bursα蛋白的相对分子量大小约16.70 kD;β亚基去掉信号肽后蛋白的相对分子量大小约12.70 kD,加上表达载体pET-28a-c(+)上的His标签蛋白后,重组Bursβ蛋白的相对分子量大小约16.24 kD。SDS-PAGE凝胶电泳检测发现:当诱导条件为16 ℃、150 r/min,IPTG终浓度为0.5 mmol/L时,pET-28a-α在诱导24 h后依然只有少量表达,pET-28a-β基本没有表达(图3);当诱导条件为37 ℃、220 r/min,IPTG终浓度为1 mmol/L时,pET-28a-α和pET-28a-β表达量随着诱导时间的增加而逐渐增多(图4)。
2.2.3重组蛋白Bursα、Bursβ大量表达及纯化。比较不同诱导条件下目的蛋白的表达结果,选用在220 r/min、37 ℃,IPTG终浓度为1 mmol/L的条件下,大量诱导表达Bursα和Bursβ。SDS-PAGE凝胶电泳对BufferA、BufferB和Wash I中的蛋白进行检测。结果显示bursicon-α以包涵体的形式大量表达,而bursicon-β则可以在上清中表达,形成可溶性蛋白(图5)。目的蛋白经Ni SephroseTM 6 Fast Flow纯化后,SDS-PAGE电泳显示,在10~25 kD间有一条单一的蛋白条带,和预期大小基本相同。结果说明获得了较纯的Bursα和Bursβ重组蛋白(图6)。
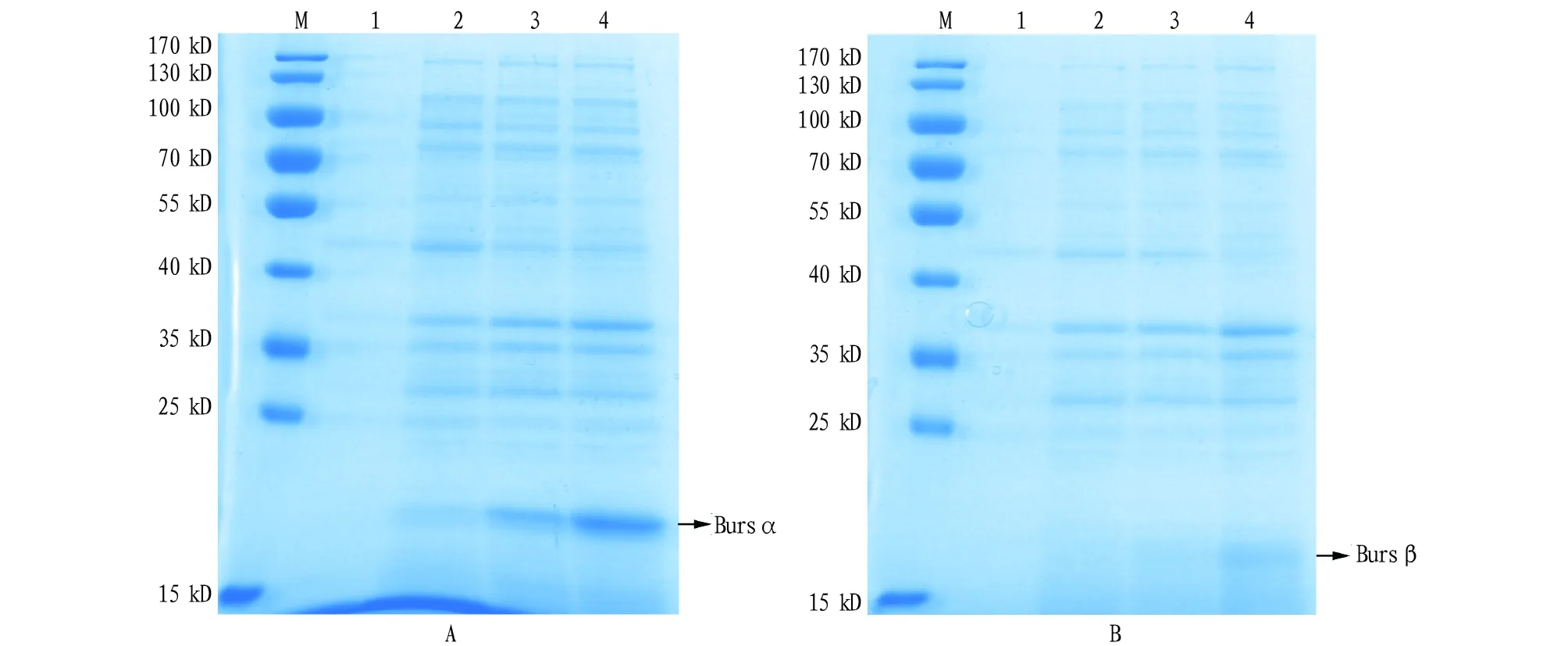
注:A为α亚基蛋白,M.蛋白分子量标准,1~4.诱导时间分别为0、3、8、24 h的α亚基菌体蛋白;B为β亚基蛋白,M.蛋白分子量标准,1~4.诱导时间分别为0、3、8、24 h的β亚基菌体蛋白Note:A was Bursα,M.protein molecular weight marker (kD),1-4.the bacteria that inserted into the pET-28a-α vector induced at 0,3,8 and 24 h respectively;B was Bursβ,M.protein molecular weight marker (kD),1-4.the bacteria that inserted into the pET-28a-β vector induced at 0,3,8 and 24 h respectively图3 在16 ℃条件下Bursα和Bursβ重组蛋白SDS-PAGE电泳分析Fig.3 SDS-PAGE analyses of the recombinant Bursα and Bursβ expressions at 16 ℃

注:A.α亚基蛋白,M.蛋白分子量标准,1~7.诱导时间分别为0、1、2、3、4、5、6 h的α亚基菌体蛋白;B.β亚基蛋白,M.蛋白分子量标准,1~7.诱导时间分别为0、1、2、3、4、5、6 h的β亚基菌体蛋白Note:A.Bursα,M.protein molecular weight marker (kD),1-7.the bacteria that inserted into the pET-28a-α vector induced at 0,1,2,3,4,5 and 6 h respectively;B.Bursβ,M.protein molecular weight marker (kD),1-7.the bacteria that inserted into the pET-28a-β vector induced at 0,1,2,3,4,5 and 6 h respectively图4 在37 ℃条件下Bursα和Bursβ重组蛋白SDS-PAGE电泳分析Fig.4 SDS-PAGE analyses of the recombinant Bursα and Bursβ expressions at 37 ℃
2.2.4鞣化激素在不同组织中表达的差异。以米虾眼柄、心、胸神经节和腹神经节4种组织的cDNA为模板,用实时荧光定量PCR检测鞣化激素2个亚基基因bursicon-α和bursicon-β的表达情况。结果表明,bursicon-α和bursicon-β均在腹神经节中的相对表达量较高,胸神经节次之,眼柄和心中的相对表达量均较低(图7)。
3 结论与讨论
米虾生活在淡水中,对水温和pH的适应范围较广。但是观察发现在水温较低时,米虾的生殖腺发育缓慢,所以温度的高低可能对生殖腺的发育有一定的影响。此外,对米虾的胚胎发育研究表明,胚胎发育所需要的时间也与水温密切相关。当水温维持在26 ℃左右时,米虾整个胚胎发育过程的时间较短,仅需约19 d。该温度可能是米虾生长的最适温度。因为米虾个体小、繁殖快、易饲养,所以适合作为试验材料。
笔者以米虾为研究对象,利用BamH I和Hind Ⅲ限制性内切酶,成功构建了鞣化激素2个亚基基因的表达载体pET-28a-α和pET-28a-β。将表达载体导入Rosetta表达菌中后,通过对表达条件的筛选发现在37 ℃、220 r/min,IPTG终浓度为1 mmol/L时,能够大量表达Bursα和Bursβ蛋白。An等[9]研究发现黑腹果蝇体中鞣化激素2个亚基基因蛋白大约为15 kD。将重组BURS和PBURS蛋白分别注射到颈部结扎的黑腹果蝇体内会对一些免疫相关基因的表达产生影响。在甲壳纲的蓝蟹(Callinectessapidus)中鞣化激素2个亚基基因蛋白也大约为15 kD。取其处于蜕皮后期D2期和蜕皮期E期时新形成的角质层,然后用表达获得的鞣化激素蛋白去进行孵育。发现与对照组相比角质层明显增厚,表明鞣化激素参与角质层的硬化。在该试验中将原核表达获得的Bursα和Bursβ重组蛋白进行SDS-PAGE凝胶电泳检测,结果显示Bursα和Bursβ重组蛋白的相对分子质量分别为16.70 kD和16.24 kD,与果蝇和蓝蟹中鞣化激素亚基的分子量大小相近,而且表达纯化后的Bursα和Bursβ蛋白为下一步研究鞣化激素对角质层及免疫系统的作用打下了基础。
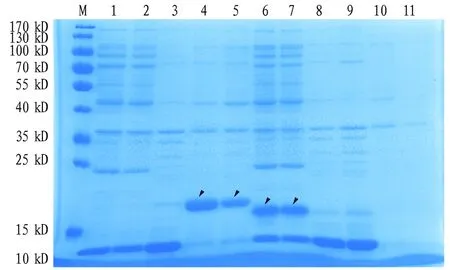
注:M.蛋白分子量标准,1~5.导入pET-28a-α质粒的菌体蛋白(1~2.BufferA,3.BufferB,4~5.Wash I);6~11.导入pET-28a-β质粒的菌体蛋白(6~7.BufferA,8~9.BufferB,10~11.Wash I)Note:M.protein molecular weight marker (kD),1-5.the bacteria that inserted into the pET-28a-α vector(1-2.BufferA,3.BufferB,4-5.Wash I); 6-11.the bacteria that inserted into the pET-28a-β vector (6-7.BufferA,8-9.BufferB,10-11.Wash I)图5 Bursα和Bursβ重组蛋白纯化前SDS-PAGE电泳分析Fig.5 SDS-PAGE analyses of the recombinant Bursα and Bursβ expressions before purification

注:M.蛋白分子量标准;1.α亚基蛋白;2.β亚基蛋白Note:M.protein molecular weight marker (kD); 1.Bursα; 2.Bursβ图6 Bursα和Bursβ重组蛋白纯化后SDS-PAGE电泳分析Fig.6 SDS-PAGE analyses of the recombinant Bursα and Bursβ expressions after purification

注:ES.眼柄;HT.心;TG.胸神经节;AG.腹神经。不同小写字母表示组内存在显著性差异(P<0.05)Note:ES.Eyestalk;HT.Heart;TG.Thoracic ganglia;AG.Abdominal ganglia.Different lowercase letters indicate statistically significant differences within the group图7 米虾bursicon-α和bursicon-β在不同组织中的相对表达量Fig.7 The relative expression levels of bursicon-α and bursicon-β in different tissues from Caridina
美洲大蠊(Periplanetaamericana)胸部和腹部神经系统可以合成甲壳动物心脏激活肽(CCAP)和鞣化激素。在烟草天蛾(Manducasexta)中也发现胸部和腹部的神经节以及食管下神经节的唇部和上颌部神经节均能表达CCAP和鞣化激素。其中在烟草天蛾的幼虫阶段只有腹部神经节第一节表达鞣化激素,然而到了蛹期,腹部各个神经节都能表达鞣化激素。同样在黑腹果蝇中也有类似的情况,处于幼虫阶段时腹部神经节只有前4节表达鞣化激素,在蛹期时腹部神经节中表达鞣化激素的有14个细胞。此外在欧洲龙虾(Homarusgammarus)、蓝蟹以及斑节对虾(Penaeusmonodon)等甲壳动物中也发现鞣化激素主要是在胸腹神经节中合成。而在该试验物种米虾中,利用实时荧光定量PCR检测米虾不同组织中鞣化激素的表达量,结果表明鞣化激素主要在腹神经节中表达,在胸神经节中也有一定的表达量。这与在果蝇及其他虾蟹类中的研究是一致的。由于鞣化激素是分泌蛋白,猜测鞣化激素可能由胸腹神经节分泌到血淋巴中发挥作用。
[1] COTTRELL C B.The imaginal ecdysis of blowflies.Detection of the blood-borne darkening factor and determination of some of its properties[J].Bioorganic & medicinal chemistry,1962,39(1):67-73.
[2] FRAENKEL G,HSIAO C.Hormonal and nervous control of tanning in the fly[J].Science,1962,138(3536):27-29.
[3] FRAENKEL G,HSIAO C.Bursicon,a hormone which mediates tanning of the cuticle in the adult fly and other insects[J].Journal of insect physiology,1965,11(5):513-556.
[4] LUO C W,DEWEY E M,SUDO S,et al.Bursicon,the insect cuticle-hardening hormone,is a heterodimeric cystine knot protein that activates G protein-coupled receptor LGR2[J].Proceedings of the national academy of sciences of the United States of America,2005,102(8):2820-2825.
[5] MENDIVE F M,VAN LOY T,CLAEYSEN S,et al.Drosophilamolting neurohormone bursicon is a heterodimer and the natural agonist of the orphan receptor DLGR2 [J].FEBS Letters,2005,579(10):2171-2176.
[6] BAKER J D,TRUMAN J W.Mutations in theDrosophilaglycoprotein hormone receptor,rickets,eliminate neuropeptide-induced tanning and selectively block a stereotyped behavioral program[J].Journal of experimental biology,2002,205(17):2555-2565.
[7] DEWEY E M,MCNABB S L,EWER J,et al.Identification of the gene encoding bursicon,an insect neuropeptide responsible for cuticle sclerotization and wing spreading[J].Current biology,2004,14(13):1208-1213.
[8] DAVIS M M,O'KEEFE S L,PRIMROSE D A,et al.A neuropeptide hormone cascade controls the precise onset of post-eclosion cuticular tanning inDrosophilamelanogaster[J].Development,2007,134(24):4395-4404.
[9] AN S H,WANG S J,GILBERT L I,et al.Global identification of bursicon-regulated genes inDrosophilamelanogaster[J].BMC Genomics,2008,9(1):424.
[10] AN S H,DONG S Z,WANG Q,et al.Insect neuropeptide bursicon homodimers induce innate immune and stress genes during molting by activating the NF-κB transcription factor Relish[J].PLoS One,2012,7(3):1-9.
[11] ROBERTSON H M,NAVIK J A,WALDEN K K,et al.The bursicon gene in mosquitoes:An unusual example of mRNA trans-splicing[J].Genetics,2007,176(2):1351-1353.
[12] Tribolium Genome Sequencing Consortium.The genome of the model beetle and pestTriboliumcastaneum[J].Nature,2008,452(7190):949-955.
[13] LOVEALL B J,DEITCHER D L.The essential role of bursicon duringDrosophiladevelopment[J].BMC Developmental Biology,2010,10(1):92-108.
[14] HONEGGER H W,ESTÉVEZ-LAO T Y,HILLYER J F.Bursicon-expressing neurons undergo apoptosis after adult ecdysis in the mosquitoAnophelesgambiae[J].Journal of insect physiology,2011,57(7):1017-1022.
[15] DAI L,DEWEY E M,ZITNAN D,et al.Identification,developmental expression,and functions of bursicon in the tobacco hawkmoth,Manducasexta[J].Journal of comparative neurology,2008,506(5):759-774.
[16] SHARP J H,WILCOCKSON D C,WEBSTER S G.Identification and expression of mRNAs encoding bursicon in the plesiomorphic central nervous system ofHomarusgammarus[J].General & comparative endocrinology,2010,169(1):65-74.
[17] WILCOCKSON D C,WEBSTER S G.Identification and developmental expression of mRNAs encoding putative insect cuticle hardening hormone,bursicon in the green shore crabCarcinusmaenas[J].General & comparative endocrinology,2008,156(1):113-125.
[18] WEBSTER S G,WILCOCKSON D C,MRINALINI,et al.Bursicon and neuropeptide cascades during the ecdysis program of the shore crab,Carcinusmaenas[J].General & comparative endocrinology,2013,182(1):54-64.
[19] CHUNG J S,KATAYAMA H,DIRCKSEN H.New functions of arthropod bursicon:Inducing deposition and thickening of new cuticle and hemocyte granulation in the blue crab,Callinectessapidus[J].PLoS One,2012,7(9):1602-1603.
[20] SATHAPONDECHA P,PANYIM S,UDOMKIT A.A novel function of bursicon in stimulation of vitellogenin expression in black tiger shrimp,Penaeusmonodon[J].Aquaculture,2015,446:80-87.

