图像辅助流式细胞仪在鲫鱼血细胞分析中的应用
张树花,刘逸尘,胡锦丽,任星潮,晋 伟,张亦陈
(天津市动植物抗性重点实验室/天津师范大学生命科学学院,天津 300387)
血液是动物体中不可或缺的液体组织,不仅可以运输生命活动所需的营养物质及其代谢产物,还对维持动物体内环境的稳态有重要作用,机体的免疫反应也有血液的参与。血细胞是动物体免疫系统的重要成分,其种类和丰度可以反映机体自身的生理状态变化以及外界环境因子的刺激等[1]。鱼类虽然是较低等的水生动物,但与人类一样,其血液和其中各类血细胞承担着运输、防御、免疫、体液调节等功能[1-7],尤其是其中的白细胞,不仅直接参与大量的免疫应答过程,还能敏感地反映自身生理状态的变化和对外界刺激的响应[8-9]。机体的生理及病理变化往往都能在血细胞的组成和数量等方面有明确的反应,因此,可以通过血液学指标的检查了解养殖鱼类的健康水平,还能通过 “哨兵鱼”的健康状况评价其生活水域的环境质量[8,10]。很多研究关注鱼类等水生动物的血细胞分类和功能分析,积累了大量相关研究结果。李超等[9]采用Ficoll-Urografin法将罗非鱼外周血细胞分为红细胞、淋巴细胞、嗜中性粒细胞、单核细胞;唐银[2]根据光镜和电镜观察将花斑裸鲤的外周血细胞分为红细胞、粒细胞、淋巴细胞、单核细胞和血栓细胞;周玉等[11]利用光镜和透射电镜技术,将鳗鲡外周血细胞分为红细胞、单核细胞、淋巴细胞、粒细胞和血栓细胞;任培丽等[12]根据血涂片观察结果,将鲫鱼血细胞分为红细胞、单核细胞、嗜中性粒细胞、血栓细胞、淋巴细胞。鱼类血细胞的分类模式总体而言基本相近,但对血栓细胞尚未形成较为一致的看法,Shigdar等[13]把鱼类的血栓细胞列为白细胞系以外的另一类细胞;但Gao等[14]以及杨淞等[15]则把血栓细胞归为白细胞。
研究者一直都在尝试各种准确、快速的血细胞检测方法。光镜、电镜观察分类计数等常规方法耗时长、工作量大,对低丰度细胞类群统计较困难;另一方面,由于鱼类血细胞中占比最大的红细胞有细胞核,用常规方法难以去除,所以会干扰白细胞的分析,无形中增加了很多不必要的工作量。自动化的血液分析技术能极大地提高检测效率,相较于人工,仪器检测的批次稳定性更高,重复性更好,通量更大。目前,医学血液学检测多采用基于流式细胞技术的自动化分类分析,数分钟即可获得丰富的数据,为疾病的诊疗提供了重要的技术保障。常规流式细胞仪在边界细胞划分方面缺乏针对鱼类有核红细胞干扰的高效辅助手段,因此一直以来,利用流式细胞仪对鱼类进行血液学检测的应用尚不普遍。Inoue等[16]尝试用水处理鲤鱼血细胞20 s以去除红细胞,然后将样品用于流式细胞仪进行分群分析,并把血细胞分为5个类群:红细胞群、凝血细胞与淋巴细胞混合群、单核细胞群、嗜中性粒细胞群和嗜碱粒细胞群,但未见该方法广泛应用的后续报道。FlowSight等带有同步图像采集功能的流式细胞仪是近年来出现的一类新型多功能快速检测设备,除了具备常规流式类仪器高通量的检测能力外,还有一个最大特点是能将每一个样点的明场及其他荧光视场的图像实时呈现并记录下来,所以也被称为图像辅助流式细胞仪或显微流式细胞仪、多维全景分析仪。该类仪器在类群边界划分方面较常规流式细胞仪具有显著的优势,另外由于其改进了检测模块以及管路设计,所以能够获得更多方面的测量数据,便于精确分群,而且对样品的适应性大大提高,不易堵塞。已经有越来越多的研究者利用此类仪器开展各项研究。Pan等[17]利用其分析了细菌的生存能力。也有学者借助多维全景的图像辅助开展自噬的研究以及相关药物的研发[18]。
鲫鱼是我国广泛养殖的鲤科经济鱼种,其血液学研究的技术探索和相关结果可为多种养殖鱼类提供参考。笔者借助图像辅助流式细胞仪将白细胞与有核红细胞区分开,建立了一种自动化的分析技术。
1 材料与方法
1.1材料
1.1.1试验动物。试验所用鲫鱼购自本地水产市场,体长为(26.7±2.5)cm,体重为(420±30) g。活体运回实验室后暂养5 d,选取体表完好、摄食及运动行为正常的个体用于试验。
1.1.2试剂。肝素钠抗凝剂购自北京鼎国昌盛生物技术有限责任公司,多聚甲醛购自生工生物工程(上海)股份有限公司,其他试剂均为国产分析纯。
1.1.3仪器。台式冷冻离心机(Eppendorf公司); FlowSight图像辅助流式细胞仪为Merck Millipore公司产品。
1.2方法
1.2.1血细胞样品的制备。参照杨兴棋[19]的采血方法,用经肝素钠处理的注射器从鲫鱼尾静脉微创采集全血,从中吸取20 μL血细胞样品经4%多聚甲醛固定后洗涤3次,用70 μm细胞筛过滤,去除黏连的多细胞团,按照仪器操作说明上机检测。
1.2.2血细胞分群方法分析。随机采集10尾鲫鱼全血样本,各收集10万个样点,利用本机软件进行分析,借助同步采集的图像验证分群结果。该研究对比了2种分析方案:一种是常规流式细胞仪分析所用的根据前向散射与侧向散射2个方面差异进行分类;另一种是利用本机独有的明场图像的面积与长宽比差异对细胞加以区分。2种方法都根据各类细胞样点的聚集情况将其归入不同类群,并参考仪器同步采集的每个样点的图像信息对所划分类群的准确性进行验证,确保优化的设门范围,然后进一步计算细胞比例。
1.2.3急性Cu2+刺激对鲫鱼白细胞的影响分析。在初步建立鲫鱼血细胞快速分类分析方法的基础上,参考杨丽华等[20]的研究结果,设置鲫鱼急性Cu2+刺激试验,对照组Cu2+添加量为0 mg/L,试验组为120 mg/L,每组5尾鲫鱼。处理24 h后分别抽取对照组和试验组鲫鱼血样,利用该方法进行血细胞分类计数和体积变化分析,以了解Cu2+对鲫鱼白细胞的影响。
2 结果与分析
2.1血细胞分群分析首先参考常规流式细胞分析的模板,利用反映细胞大小和颗粒度的前向散射和侧向散射参数对细胞样点加以区分,但未能获得较为理想的分群结果,绝大部分细胞样点都集中在一起。辅助图像验证显示其中以有核红细胞为主,并含有少量白细胞,大部分白细胞样点分布于前述细胞群的边缘,偏向面积较大的一侧,但其与红细胞类群之间界限不够清晰,所以不利于准确统计各类细胞数量。
利用图像辅助流式细胞仪独有的明场图像的测量结果进行分群分析则显示了较清晰的类群边界。以面积和长宽比为坐标系做样点分布散点图,处于面积较小区间的一群样点为红细胞,其显著的特点是细胞小,呈椭圆形或长圆形,略有收缩。位于散点图右侧的是白细胞类群,该类群细胞特征为体积大,形态近圆形或不规则;从明场图像可以看出胞内不均一,普遍具有高对比度像素点,提示该类群细胞具有较为复杂的胞内结构。两群细胞间具有明显的低密度间隙,可以据此将其选定为设门依据(图1)。

注: A.鲫鱼血细胞流式散点图,其中R1类群为红细胞,R2类群为白细胞;B.R1类群的单细胞明场图像; C.R2类群的单细胞明场图像;B、C图中的数字代表该细胞样点通过检测器的序号Note:A.Scatterplot of Carassius auratus blood cells, among them group R1 stands for erythrocytes, and group R2 stands for leukocytes;B.Single-cell images of group R1;C.Single-cell images of group R2;The numbers in B and C represent the sequence number of cells passing through the flow cytometry图1 鲫鱼血细胞的图像辅助流式分析Fig.1 Blood cells analysis of Carassius auratus by image-based flow cytometry
2.2急性Cu2+刺激对鲫鱼白细胞的影响高浓度Cu2+刺激24 h之后,鲫鱼体内白细胞与对照组相比在数量和细胞形态2个方面都发生了明显的变化。首先,白细胞计数急剧下降,从2.3×107个/cm3下降为1.5×107个/cm3,降幅达34.8%;其次,白细胞体积也显著增大,通过测量白细胞大小的直方图可以发现,试验组仅有79.0%的细胞落在了对照组95.0%的细胞覆盖的大小区间,而试验组更有约16.6%的白细胞大小完全超出了对照组的分布区间,向体积增大的方向偏移(图2)。
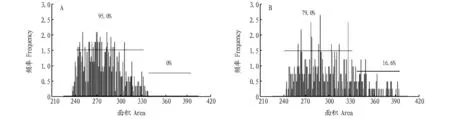
注:A.对照组白细胞大小分布情况;B.试验组白细胞大小分布情况Note:A.The size distribution of leukocyte in the control group;B.The size distribution of leukocyte in the experimental group图2 Cu2+ 刺激对鲫鱼白细胞的影响Fig.2 The effect of Cu2+ stimulation on the leucocytes of Carassius auratus
3 结论与讨论
鱼类虽然是较为低等的脊椎动物,但具有与人类相似的血液和血细胞构成,因此将医学血液学检测的技术原理应用于鱼类血液检测一直都是研究者所期望的。对血细胞进行人工染色,借助显微镜观察分类计数可以了解鱼类血细胞在生理和病理条件下的变化,但不适合大规模、高通量操作。流式细胞技术具有高通量、自动化等优势[21-23],但多年来的研究表明常规流式细胞仪在处理鱼类等有核红细胞与白细胞混合样品方面区分度尚不理想,所以还没有普遍适用的自动化分析方法被广泛使用。图像辅助流式细胞仪是近年来衍生出的一种新型检测设备,其采用流式进样方式,保证了检测的高通量,升级了常规测量模块,还为每个检测通道添加了图像采集功能,极大地提高了样品分析的便利性、准确性和效率[24]。
该研究利用图像辅助流式细胞仪对鲫鱼血细胞进行了初步的自动化分类分析和应用的探索。在区分有核红细胞与白细胞类群边界方面,该仪器表现出了极大的优势。与常规流式细胞仪需要将样品回收分析后才能确定样点特征不同,该仪器可以直接通过同步采集的图像对样点进行甄别;更为重要的是,可以针对任意一个样点单独分析,这对于常规流式细胞仪而言,相当于连续单独回收类群边界的每一个细胞再加以甄别,实际上在操作中是无法实现的。前向散射和侧向散射特征对于不经荧光标记的细胞是较为常用的区分指标,但在无法去除的大量有核红细胞的干扰下,很难发挥其区分效力。该研究也遇到了这种情况,不但有白细胞混杂在红细胞类群当中,而且白细胞与红细胞的类群边界也不清晰,虽然在红细胞和白细胞各自样点聚集范围之间存在低密度区,但通过单独样点的明场图像辨识发现此区域仍然是混合细胞群。该研究又进一步尝试利用该仪器独有的明场图像信息对血细胞进行分群分析,获得了较为理想的结果。以面积和长宽比为坐标系的散点图可以呈现出较为清晰的2个细胞聚集区。位于面积较小的区间内的细胞数量占绝大多数,且具有红细胞的典型特征,体积较小,长宽比较大,加之胞内缺乏类似白细胞内的复杂膜系统,所以甲醛固定后更容易收缩,其体积与大部分白细胞甚至其中的小淋巴细胞的差距都更为明显,所以整个类群几乎不含有明显可辨的白细胞。另一方面,从白细胞类群的占比也可作出同样的推断,该方法设定的白细胞门内所包含的白细胞占比与已报道的同类研究结果吻合(表1)。更为重要的是,同步采集的每个样点的明场图像提供了其形态学的佐证。

表1 该研究结果与已发表结果的对比
注:*该数据是根据引用文献中的分类计数结果计算所得
Note:*Results were calculated based on published papers
在初步建立基于图像辅助流式细胞仪的鲫鱼血细胞分类分析方法的基础上,该研究进一步尝试将其用于实践检验的可行性。重金属离子污染是一种常见的环境胁迫,Cu2+是其中的代表之一,会导致鱼类等水生动物出现游泳行为异常、生理功能紊乱、组织细胞病变甚至死亡等一系列的异常症状[28]。血细胞变化可以作为其毒性效应的重要参考指标[1]。该研究发现,较高浓度的Cu2+急性胁迫对鲫鱼产生的影响可反映在其血细胞计数、比例变化及形态改变方面,其中较为直观的就是细胞计数下降和细胞体积肿胀。该特征与史增奎[29]、王丽[30]的研究结果一致,表明Cu2+通过诱发细胞水肿等表征导致细胞损伤、破裂,但其深层次的机理尚需通过离子通道分析等综合研究进一步解析。上述结果提示,基于图像辅助流式细胞仪的自动化血细胞分类分析方法适用于鱼类血细胞分类和计数等方面的测量需求。
血液中的细胞承担了气体输送和机体防御等重要功能,其中各类细胞的种类和数量均必须在一定范围内保持相对稳定,从而确保机体处于健康状态。当机体遭遇病原刺激或者环境胁迫时,遍布周身的血细胞往往能在第一时间做出反应,无论是主动应答还是被动适应,因此对血细胞的分析是一种敏感、快速的健康监测手段[1-2]。血象分析是医学血液学研究和检测的重要方法,其中对各种细胞分类计数的信息能在极短时间内为健康诊断提供指向性的参考,所以各类自动化的技术和装备都已在医学检测领域广泛应用[31-32]。流式细胞技术作为一种快速高通量的样品分析平台,辅以各种先进检测模块可以衍生出各种新型检测设备,服务于不同领域的需求,其自动化、高通量、多维度等优势越来越受到研究者的重视。在当前水产动物疫病频繁大规模暴发的情况下,提前发现,提前预警,尽早采取有针对性的预防措施显得尤为重要,而这都依赖于快速准确的分析和诊断。该研究针对鱼类血细胞高通量自动化分析这个关键点,将图像辅助流式细胞仪引入鱼类血细胞分析,利用其独有的同步图像信息进行辅助分群,建立了一种较为优化并且具有一定实用性的自动分析方法。该方法采用微创采血,仅需不到10 μL全血的细胞量即可获得具有重要参考价值的诊断信息;另一方面,该方法操作非常简便,采血后直接固定30 min即可上样分析,每个样品仅需1 min即可采集数万细胞样点,因此对于批量制备的样品,可实现每小时数十个样品的检测速度。由于每个样品的检测通量可以达数万细胞,而且高质量的测量模块可以确保每个样品的测量和判定标准保持高度一致,为能早期发现血细胞种类和数量在统计学上的细微差异提供了重要的技术保证,也有望为疾病早期预警提供参考。
[1] ELLIS A E.The leucocytes of fish:A review[J].Journal of fish biology,1977,11(5):453-491.
[2] 唐银.养殖花斑裸鲤外周血液生理指标及血细胞形态参数的研究[D].雅安:四川农业大学,2015.
[3] 周贤君,代应贵,王开功,等.低等脊椎动物血细胞研究概况[J].水利渔业,2008,28(2):9-12.
[4] 周玉,郭文场,杨振国.鱼类血细胞的研究进展[J].动物学杂志,2001,36(6):55-57.
[5] 田囡囡.几类水产动物血细胞免疫研究现状[J].科技经济市场,2006(11):66.
[6] CLAVER J A,QUAGLIA A I E.Comparative morphology,development,and function of blood cells in nonmammalian vertebrates[J].Journal of Exotic Pet Medicine,2009,18(2):87-97.
[7] 赵凤岐,曹谨玲.硬骨鱼血细胞发生的研究进展及经济前景分析[J].中国渔业经济,2007(3):30-33.
[8] 周永灿,邢玉娜,冯全英.鱼类血细胞研究进展[J].海南大学学报(自然科学版),2003,21(2):171-176.
[9] 李超,陈明,王瑞,等.罗非鱼外周血白细胞分离与血细胞指数研究[J].大连海洋大学学报,2009,24(S1):10-14.
[10] 袁仕取,张永安,姚卫建,等.鳜鱼外周血细胞显微和亚显微结构的观察[J].水生生物学报,1998,22(1):39-47.
[11] 周玉,郭文场,杨振国,等.欧洲鳗鲡外周血细胞的显微和超微结构[J].动物学报,2002,48(3):393-401.
[12] 任培丽,张迎梅,耿广琴,等.污染水域鲫鱼外周血细胞形态和数量的变化[J].动物学杂志,2008,43(2):37-42.
[13] SHIGDAR S,HARFORD A,WARD A C.Cytochemical characterisation of the leucocytes and thrombocytes from Murray cod (Maccullochellapeeliipeelii,Mitchell)[J].Fish & shellfish immunology,2009,26(5):731-736.
[14] GAO Z X,WANG W M,YI Y,et al.Morphological studies of peripheral blood cells of the Chinese sturgeon,Acipensersinensis[J].Fish physiology & biochemistry,2007,33(3):213-222.
[15] 杨淞,杨世勇,肖拉,等.养殖齐口裂腹鱼外周血细胞显微观察[J].四川动物,2011,30(2):202-206.
[16] INOUE T,MORITOMO T,TAMURA Y,et al.A new method for fish leucocyte counting and partial differentiation by flow cytometry[J].Fish & shellfish immunology,2002,13(5):379-390.
[17] PAN Y W,KAATZ L.Use of image-based flow cytometry in bacterial viability analysis using fluorescent probes[J].Current protocols in microbiology,2012,27(1):1-11.
[18] CHAN L L,SHEN D,WILKINSON A R,et al.A novel image-based cytometry method for autophagy detection in living cells[J].Autophagy,2012,8(9):1371-1382.
[19] 杨兴棋.鱼类的采血技术[J].淡水渔业,1979(Z1):43-44,11.
[20] 杨丽华,方展强,郑文彪.重金属对鲫鱼的急性毒性及安全浓度评价[J].华南师范大学学报(自然科学版),2003(2):101-106.
[21] 赵泓,刘凡.流式细胞仪[J].安徽农学通报,2006(12):39-41,80.
[22] 冼健安,王安利,孙敬锋.流式细胞术在水产动物研究中的应用[J].水产科学,2009,28(5):290-294.
[23] 刘涛,张巍,王凤阳,等.流式细胞仪在免疫学研究中的应用[J].动物医学进展,2008,29(3):102-105.
[24] 赵书涛,武晓东,王策,等.流式细胞仪的原理、应用及最新进展[J].现代生物医学进展,2011,11(22):4378-4381.
[25] 林光华,张丰旺.革胡子鲶血液常数值的周年变化[J].动物学报,1991(3):341-342.
[26] 傅莉娟,高平,严绍颐.金鱼成熟红血细胞的超微结构研究[J].科学通报,1988,33(15):1178-1181.
[27] 杨严鸥,余文斌,姚峰,等.5种鲤科鱼类血细胞数量、大小及血清生化成分的比较[J].长江大学学报(自然科学版),2006,3(2):159-160,164.
[28] 徐永江.几种重金属离子对半滑舌鳎生理生态学影响的研究[D].青岛:中国海洋大学,2005.
[29] 史增奎.重金属离子对鱼类血液指标影响的研究[J ].渔业经济研究,2006(6):45-48.
[30] 王丽.分子和细胞水平上研究Ni2+的毒性作用[D].济南:山东大学,2011.
[31] MCFARLIN B K,GARY M A.Flow cytometry what you see matters:Enhanced clinical detection using image-based flow cytometry[J].Methods,2017,112:1-8.
[32] 陈军浩.流式细胞术在临床及科研中的应用[J].临床检验杂志,2012,30(10):861-864.

