人工辅助心脏国际发展趋势概述
许 剑,王 妍,周 娜,范庆麟,朱尘琪
(1.航天泰心科技有限公司,天津 300457;2.北京精密机电控制设备研究所,北京 100076)
心力衰竭已成为全世界主要的公共卫生问题,我国心衰发病率近1%,每年新增发病数可达数百万,并且随着老龄化的加剧将日益严重[1]。终末期心力衰竭患者药物治疗效果不佳,最有效的心脏移植则受限于供体数量、异体排斥反应等问题难以成为常规治疗方法。
自20世纪50年代开始,人工心脏在欧美国家得到蓬勃发展,早期主要是模拟自然心脏工作机制的搏动式产品,体积和功耗较大,一般放置在体外,应用不广[2]。后DeBakey和Noon医生寻求到美国NASA的技术支持,将火箭上所采用的叶片泵技术进行转化,合作研发植入式连续流人工辅助心脏(也称心室辅助装置VAD)并取得全面和成功的实验[3],自此小型、可靠的旋转式连续流VAD得到广泛认可并取代搏动式VAD成为主流研究方向。2008年美国FDA批准Thoratec公司的HeartMate II作为BTT治疗[4],次年HeartWare公司的HVAD获得BTT治疗欧洲CE许可[5]。目前心室辅助装置已成为欧美国家治疗终末期心衰的重要手段并被医保覆盖,根据Intermacs统计,自2006年6月至2016年9月,仅美国已有包括美国副总统切尼在内的18385名患者植入VAD,2年存活率基本提高到约80%。见图1。
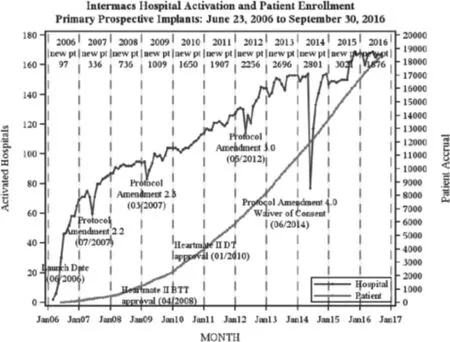
图1 Intermacs发布的统计数据
目前国际上主要的VAD研发集中在美国、德国、澳大利亚和日本。重要的厂商有Thoratec、HeartWare、ReliantHeart、Berlin Heart、JarvikHeart等公司。见表1。

表1 国外从事相关研究的主要机构
随着VAD产品的大规模应用,产品的耐久性、安全性和临床益处均取得了很大改善,各类测试及临床数据的收集也为产品的改进提供了更好的依据。总体说来国际上对于心室辅助装置的研究热点已经逐步从提高存活率转移到提高患者生活质量,从VAD产品本身的研究过渡到VAD与人体血液循环的交互生理影响研究,发展趋势如下。
1 微型化
由于早期装置应用的局限性,VAD通常用于晚期心衰患者,此病程阶段的患者心脏功能已严重受损,所需辅助流量较大,故该时期研发的VAD产品流量最高可达10 L/min甚至20 L/min以满足临床应用的需求,但其体积及功耗较大,患者植入后存活率和生活质量不高。随着研究的深入及应用案例的增多,越来越多的证据显示心衰病人越早植入VAD,其生活质量和存活率越高。而对于产品本身,医学界及工业界也已经开始反思早期VAD参数特别是流量参数的设计是否合理,首先用于早中期心衰患者的心室辅助时,其临床应用远没有达到如此之高的流量需求;此外,左心辅助时过高的排量会引起入口抽吸,易导致右心衰竭,从而进一步使病情恶化。
针对上述问题,世界领先的VAD厂商正在持续不断研制更加微型化的产品,体积、重量都大幅度减小,泵体本身的安装位置从腹部→心尖外→心室内演化,手术创口更小,植入更方便,术后恢复更快,生活质量更好。
微型化的产品由于功耗小还将有利于无线充电方式的实现和推广,可大幅降低由经皮导线带来的感染问题,最终实现全植入式人工辅助心脏。

图2 HeartWare公司的HVAD→MVAD产品演化

图3 Thoratec公司HeartMate II→HeartMate III→HeartMate X产品演化
2 智能化
现阶段旋转式VAD控制基本采用的是定转速方式,叶片泵在恒定转速下输出流量对前后负荷较为敏感,而人体的自然心脏不停收缩,心室内及主动脉的压力时刻变化,患者生理活动状态改变时这种变化会更明显,是否需要以及如何根据自然心脏的收缩主动调节VAD的转速,采用何种算法来避免持续灌注时主动脉根部的血栓问题,这都是目前的研究热点[6][7]。
3 信息化
远程医疗并非是一项新技术,但在VAD上采用的不多,已有以ReliantHeart公司HeartAssist5为代表的产品在采用通过无线网络传输和记录VAD的流量、功耗等相关数据[8],让医护人员更好的管理患者,追踪病人生理参数,减少再次入院率,提高患者生活质量,积累的大量病患数据可用作后续统计分析和产品改进的基础。
3 个性化
广大心力衰竭人群的个体生理参数差异是客观存在的,用于急性心源性休克、移植前过渡或者终末期治疗的治疗目标和辅助要求也是各不相同,而对于VAD厂商来说产品基本是固定的一两款,针对不同的病人应如何处理才能获得最佳的治疗效果是需要持续研究的问题。

图4 HeartAssist5的远程监护模式

图5 不同的病人应采用不同的VAD辅助模式以取得最佳效果
4 结 论
综上所述,随着人工辅助心脏技术的逐步优化,产品应用的日益广泛,相信在不久的将来,VAD将成为治疗心力衰竭的常规首选方法之一,为广大心衰患者提供更好的疗效和更优的生活质量。
[1]周睿主译.机械循环支持原则和应用[M].第1版.上海:上海科学技术出版社,2016.
[2]Rodriguez L E,Suarez E E, Loebe M, et al. Ventricular assist devices (VAD) therapy: new technology,new hope?[J]. Methodist Debakey Cardiovasc J.2013,9(1):32-37.
[3]Noon G P,Loebe M. Current status of the MicroMed DeBakey Noon Ventricular Assist Device[J].Tex Heart Inst J.2010,37(6):652-653.
[4]Swetz K M,Freeman M R,Mueller P S,et al.Clinical management of continuous-flow left ventricular assist devices in advanced heart failure[J].J Heart Lung Transplant.2010,29(9): 1081.
[5]Slaughter M S.Implantation of the HeartWare left ventricular assist device[J]. Semin Thorac Cardiovasc Surg.2011,23(3):245-247.
[6]Ochsner G,Amacher R,Wilhelm M J, et al. A Physiological Controller for Turbodynamic Ventricular Assist Devices Based on a Measurement of the Left Ventricular Volume[J].Artificial Organs.2014,38(7):527-538.
[7]Bhagra S, Bhagra C,özalp F,et al.Development of de novo aortic valve incompetence in patients with the continuous-flow HeartWare ventricular assist device[J]. The Journal of Heart and Lung Transplantation. 2015.
[8]Pektok E,Demirozu Z T,Arat N, et al. Remote monitoring of left ventricular assist device parameters after HeartAssist-5 implantation[J].Artif Organs,2013,37(9):820-825.

