离子图像题的教学思考
邢泰宇


摘要: 从特殊点分析、平衡常数计算、溶液酸碱性比较及离子浓度比较等角度分析2017年全国新课标Ⅰ卷第13题,由该题的微粒浓度比值的对数随pH变化图迁移,分析微粒物质的量分数随pH变化图、微粒物质的量浓度的负对数随pH变化图、微粒物质的量随碱体积变化图等变式题目,提出平时应重视图像图表类试题的研究与教学的建议。
关键词: 高考化学试题;离子平衡;离子浓度比较
文章编号: 10056629(2018)3008205 中圖分类号: G633.8 文献标识码: B
水溶液中的离子平衡是化学平衡在溶液中的扩展和应用,涉及电离平衡、水解平衡及沉淀溶解平衡等众多知识点,是每年高考化学卷中考查学生“变化观念与平衡思想”必不可少的一道题。
溶液中的离子图像题要求考生从微观层面理解微粒的溶解、水解、电离、沉淀等行为,从宏观层面利用图表、图像、数据等信息进行推理判断,并会利用化学符号表征微粒的行为及微粒间相互关系等,体现高考化学试题的素养立意 [1],贯彻落实“宏观辨识与微观探析”、“证据推理与模型认知”的化学核心素养 [2][3]。另外,近几年的离子图像题,尤其以2017年全国Ⅰ、 Ⅱ及Ⅲ卷的三道题为代表,分别创建lg
c(X 2-)c(HX -)
、 lgc(HX -)c(H 2X)
与pH,微粒物质的量分数δ(X)与pH, -lgc(Cl -)与lgc(Cu 2+)、 lgc(Cu +)关系图的新情景,将化学理论和计算关系与图像完美结合,扩大信息的内涵,增加思维容量,体现数形结合的思想,凸显高考化学试题由定性分析到定量分析的趋势。溶液中的离子图像题,既考查考生对离子平衡知识的理解,同时又考查考生获取图像信息和数据进而分析问题和解决问题的能力,越来越受到高考命题专家的青睐。
1 2017年全国新课标Ⅰ卷第13题的一题多解
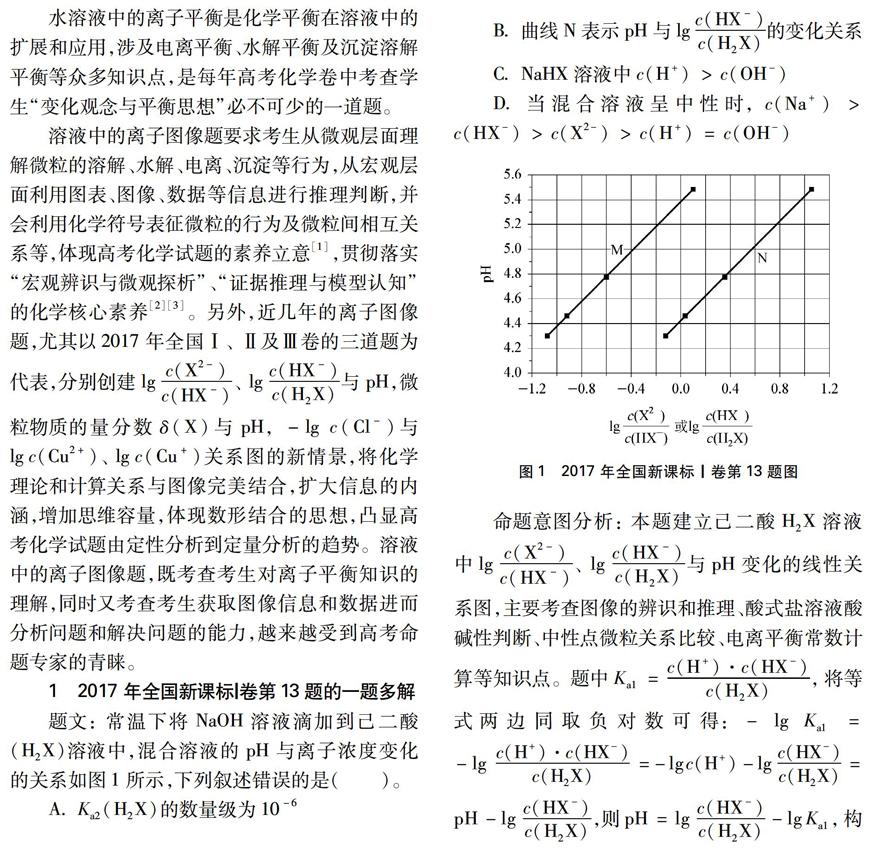
题文: 常温下将NaOH溶液滴加到己二酸(H 2X)溶液中,混合溶液的pH与离子浓度变化的关系如图1所示,下列叙述错误的是( )。
A K a2(H 2X)的数量级为10 -6
B 曲线N表示pH与lgc(HX -)c(H 2X)的变化关系
C NaHX溶液中c(H +)>c(OH -)
D 当混合溶液呈中性时,c(Na +)>c(HX -)>c(X 2-)>c(H +)=c(OH -)
图1 2017年全国新课标Ⅰ卷第13题图
命题意图分析: 本题建立己二酸H 2X溶液中lgc(X 2-)c(HX -)、 lgc(HX -)c(H 2X)与pH变化的线性关系图,主要考查图像的辨识和推理、酸式盐溶液酸碱性判断、中性点微粒关系比较、电离平衡常数计算等知识点。题中K a1=c(H +)·c(HX -)c(H 2X),将等式两边同取负对数可得: -lgK a1=-lg
c(H +)·c(HX -)c(H 2X)
=-lgc(H +)-lg
c(HX -)c(H 2X)
=pH-lg
c(HX -)c(H 2X)
,则pH=lg
c(HX -)c(H 2X)
-lgK a1,
构成以lgc(HX -)c(H 2X)
为横坐标,pH为纵坐标的直线方程,即图中N线,同法可得M线的直线方程为: pH=lgc(X 2-)c(HX -)
-lgK a2,题目数形结合,化学与数学跨学科整合,对学生综合能力要求较高。
试题分析: 应先分析清楚M线、N线与lgc(X 2-)c(HX -)、 lgc(HX -)c(H 2X)的对应关系,再计算和比较离子浓度等。
1.1 M线、N线可以采用特殊点分析法
方法1: 起点分析。起点时NaOH溶液滴加较少,此时H 2X浓度最高,H 2X电离产生少量HX -,少量的HX -电离产生更少的X 2-,因X 2-极少,lgc(X 2-)c(HX -)
的值较小,则lgc(X 2-)c(HX -)
方法2: 终点分析。终点时NaOH溶液滴加较多,H 2X反应消耗完,生成了Na 2X,此时X 2-浓度最高,X 2-水解产生少量HX -,少量的HX -水解产生更少的H 2X,因H 2X极少,lgc(HX -)c(H 2X)
的值较大,则lgc(X 2-)c(HX -)
,对照图1终点可得,M线表示lgc(X 2-)c(HX -)、 N线表示lgc(HX -)c(H 2X)。
方法3: lgc(X 2-)c(HX -)
=lgc(HX -)c(H 2X)
=0点分析。lgc(X 2-)c(HX -)
=0,表示溶液中c(X 2-)=c(HX -),此时溶液中溶质应为浓度相当的Na 2X和NaHX; lgc(HX -)c(H 2X)=0,表示溶液中c(HX -)=c(H 2X),此时溶液中溶质应为浓度相当的NaHX和H 2X;因为H 2X是弱酸,Na 2X溶液显碱性,NaHX溶液可能显碱性或酸性,所以溶质为浓度相当的Na 2X和NaHX溶液的pH大于溶质为浓度相当的NaHX和H 2X溶液,对照图1lgc(X 2-)c(HX -)=lgc(HX -)c(H 2X)=0点可得,M线表示lgc(X 2-)c(HX -)、 N线表示lgc(HX -)c(H 2X)。
方法4: 等pH点分析。K a1=
c(H +)·c(HX -)c(H 2X)
, K a2=
c(H +)·c(X 2-)c(HX -)
,由于K a1>K a2,所以lgK a1>lgK a2,即是lg
c(H +)·c(HX -)c(H 2X)
>lg
c(H +)·c(X 2-)c(HX -)
,
当pH相同时,lgc(HX -)c(H 2X)>lgc(X 2-)c(HX -),对照图1任意等pH点可得,M线表示lgc(X 2-)c(HX -)、 N线表示lgc(HX -)c(H 2X)。综上分析,B项正确。
1.2 K a1、 K a2的大小代入M线、N线上的点(有确定的坐标数据)计算
K a2: 可选取M线上(0, 5.4)、 (-0.4, 5.0)、 (-0.8, 4.6)等点计算,如(0, 5.4)点,lgK a2(H 2X)=lg
c(H +)·c(X 2-)c(HX -)
=lg
c(X 2-)c(HX -)
+lgc(H +)=0-5.4=-5.4, K a2(H 2X)=
10 -5.4=10 0.6×10 -6, A项正确。
K a1: 可选取N线上(0, 4.4)、 (0.4, 4.8)、 (0.8, 5.2)等点计算,同法可得K a1(H 2X)=10 -4.4。
1.3 NaHX溶液酸碱性判断
方法1: 特殊点法。M线上lgc(X 2-)c(HX -)=0点时,溶液中c(X 2-)=c(HX -),此时溶液中溶质应为浓度相当的Na 2X和NaHX,图1中该点的pH为5.4,溶液显酸性。但是Na 2X溶液显碱性,因此NaHX溶液显酸性,才能满足二者的混合溶液显酸性。
方法2: 平衡常数比较法。在NaHX溶液中,HX -电离使溶液呈酸性,HX -H ++X 2-,该反应进行的程度可用电离平衡常数K a2来衡量,由上可知,K a2(H 2X)=10 -5.4。 HX -水解使溶液呈碱性,HX -+H 2OOH -+H 2X,该反应进行的程度可用水解平衡常数K h2来衡量,由上可知
K a1(H 2X)=10 -4.4,
则K h2(X 2-)=K wK a1=10 -1410 -4.4=10 -9.6,所以K a2(H 2X)>K h2(X 2-),即NaHX溶液的电离大于水解,溶液呈酸性。综上分析,C项正确。
1.4 离子浓度比较
由电荷守恒知: c(Na +)+c(H +)=c(HX -)+2c(X 2-)+c(OH -),呈中性时c(H +)=c(OH -),则c(Na +)>c(HX -)+c(X 2-),关键是讨论c(X 2-)与c(HX -)的大小。由图1中M线知,当pH=5.4时,c(X 2-)c(HX -)=1,当pH向7增大时,M线会向右上延伸,则c(X 2-)c(HX -)>1;或根据平衡移动原理,pH增大时,c(X 2-)增大,c(HX -)减小,故c(X 2-)>c(HX -), D项错误。
2 2017年全国新课标Ⅰ卷第13题的一题多变
2.1 物质的量分数δ(X)随pH变化图
变式1: (2017年全国新课标Ⅱ卷第12题)改变0.1mol·L -1二元弱酸H 2A溶液的pH,溶液中的H 2A、 HA -、 A 2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=c(X)c(H 2A)+c(HX -)+c(A 2-)]。
图2 变式1题图
下列叙述错误的是( )。
A pH=1.2时,c(H 2A)=c(HA -)
B lg[K 2(H 2A)]=-4.2
C pH=2.7时,c(HA -)>c(H 2A)=c(A 2-)
D pH=4.2时,c(HA -)=c(A 2-)=c(H +)
命题意图分析: 本题建立了溶液中H 2A、 HA -、 A 2-的物质的量分數δ(X)随pH变化的关系图,主要考查了图像的辨识、特殊pH点微粒关系比较、利用特殊点计算电离平衡常数等。相较于2017年全国Ⅰ卷第13题,图中各微粒与pH的曲线关系明确(题中直接给出),学生更易上手,只需对照图像分析对应pH点的溶质情况即可解题。
试题分析: 根据图像,pH=1.2时,H 2A和HA -相交,有c(H 2A)=c(HA -), A项正确;要定量计算lg[K 2(H 2A)]的值,可找图中pH=4.2的交叉点进行计算,此时c(HA -)=c(A 2-),则K 2(H 2A)=
c(H +)·c(A 2-)c(HA -)
=c(H +)=10 -4.2,所以,lg[K 2(H 2A)]=-4.2, B项正确;根据图像,pH=2.7时,HA -的物质的量分数最大,H 2A和A 2-相交,有c(HA -)>c(H 2A)=c(A 2-), C项正确;根据pH=4.2时,c(HA -)=c(A 2-)≈0.5×0.1mol·L -1=0.05mol·L -1,而c(H +)=10 -4.2mol·L -1,可知c(HA -)=c(A 2-)>c(H +), D项错误。
答案: D
2.2 物质的量浓度的负对数pc随pH变化图
变式2: pH是溶液中c(H +)的负对数,若定义pc是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H 2A)水溶液中pc(H 2A)、 pc(HA -)、 pc(A 2-)随着溶液pH的变化曲线如图3所示。
图3 变式2题图
下列说法不正确的是( )。
A pH=4时,pc(HA -)>pc(A 2-)
B 该酸的电离常数K a1=10 -1.3
C c(H 2A)+c(HA -)+c(A 2-)一定不变
D c(A 2-)·c(H 2A)c 2(HA -)=10 -3
命题意图分析: 本题建立了溶液中微粒浓度的负对数pc(H 2A)、 pc(HA -)、 pc(A 2-)随pH变化的关系图,主要考查了图像的辨识和推理、特殊点微粒关系比较、物料守恒规律、利用特殊点计算电离平衡常数等。本题相较于2017年全国Ⅱ卷第12题(变式1),知识点考查方向基本相同,处理方法类似。题中以微粒浓度的负对数为纵坐标时,微粒浓度越高,其负对数越小,体现在图像上是曲线的变化趋势与变式1完全相反。比如,同样是HA -离子随pH的变化,图2中的变化趋势是先增后减,而图3中则完全相反,是先减后增。因此读图时要千万留意横、纵坐标的意义。
试题分析: pc是物质的量浓度的负对数,故浓度越大,pc越小。溶液pH增大的过程是加入OH -的过程,即H 2AOH -HA -OH -A 2-,可知Ⅰ表示HA -, Ⅱ表示H 2A, Ⅲ表示A 2-,因此可知A项正确;在pH=1.3的交叉点时,
c(H +)=10 -1.3mol·L -1,而c(H 2A)=c(HA -), K a1=
c(H +)·c(HA -)c(H 2A)
=c(H +)=10 -1.3, B项正确;可能改变了溶液的体积,
c(H 2A)+c(HA -)+c(A 2-)随溶液体积的增大而减小
(三者物质的量之和满足物料守恒,保持不变),故C项错误;根据K a1的交叉点求法可知K a2=10 -4.3,将
c(A 2-)·c(H 2A)c 2(HA -)
的分子和分母均乘以c(H +),则
c(H +)·c(A 2-)c(HA -)
×c(H 2A)c(H +)·c(HA -)
=K a2K a1
=10 -3, D项正确。
答案: C
2.3 物质的量随碱体积变化图
变式3: 常温下,向20mL 0.2mol·L -1 H 2A溶液中滴加0.2mol·L -1 NaOH溶液。有关微粒的物质的量变化如图4所示。根据图示判断正确的是( )。
图4 变式3题图
A 当V(NaOH)=0时,由水电离出的c(H +)=1.0×10 -7mol·L -1
B 当V(NaOH)=20mL时: c(Na +)>c(HA -)>c(H +)>c(A 2-)>c(OH -)
C 当V(NaOH)=40mL时: 2c(Na +)=c(A 2-)
D 当V(NaOH)=40mL后,继续滴加NaOH溶液,溶液的温度会继续升高
命题意图分析: 本题建立了溶液中微粒的物质的量随加碱体积变化的关系图,主要考查了图像的辨识和推理、水的电离平衡的影响因素、特殊点微粒关系比较、能量守恒规律等。本题相较于变式1、 2,没有了平衡常数等的定量计算,主要集中分析电解质的电离、水解等行为即可解题,试题难度降低,属于中学常规试题。
试题分析: H 2A溶液中滴加NaOH溶液的过程,即H 2AOH -HA -OH -A 2-,因此Ⅰ表示H 2A, Ⅱ表示HA -, Ⅲ表示A 2-。 H 2A溶液是酸性溶液,水的电离会受到抑制,A项错误;当V(NaOH)=20mL时,溶液中的溶质是NaHA,根据图像中虚线对应点分析知,溶液中c(A 2-)>c(H 2A),故HA -的电离大于其水解,溶液呈酸性,B项正确;当V(NaOH)=40mL时,溶质为Na 2A, A 2-存在水解现象,故c(Na +)>2c(A 2-),C项错误;当V(NaOH)=40mL后,继续滴加NaOH溶液,溶液中不再发生中和反应,溶液的温度不会继续升高,D项错误。
答案: B
3 思考与启示
3.1 重视图像图表类试题的研究与教学
近几年来图像图表类试题越来越受到命题者青睐,这类试题难度不降反升,尤其以2017年全国Ⅰ卷第13题最为突出。该题图像新颖,信息隐秘、容量大,设问角度多,综合程度高,很好地考查了考生接受、整合信息及解决问题的能力 [4],并且以创新的数据形式,考查了考生数据推理能力 [5]。2017、2018年考试大纲对化学学习能力的要求明确指出: 通过对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储 [6]。图像图表类试题信息呈现方式多样,信息内涵丰富,对考生自主学习和独立思考能力要求较高 [7]。因此,在平时的教学中教师应该以此类题为抓手,做好该类试题的研究与教学,努力培养学生的新信息处理加工能力、自主学习和独立思考等能力,尽力减少学生处理该类试题的心理层面障碍和知识层面障碍。
3.2 离子图像题一般分析方法
图像分析: ①看面: 弄清横、纵坐标的意义;②看线: 看线的走向和变化的趋势,如曲线或直线升高、降低、渐变、突变等;③看点: 看清起点,判断是否为强电解质;看清交点,计算电离或水解的平衡常数等;④想规律: 联想与图像有关的知识、规律,结合图像中信息综合分析求解。
离子浓度比较: ①弄清溶液中存在哪些电离或水解反应(溶质是什么,溶质在溶液中的行为如何);②理解各种离子之间的关系(溶质相对量有多少,溶质的行为主次如何),微粒的不等关系一般为: 原有微粒浓度>主要反应产生的微粒浓度>次要反应产生的微粒浓度;③掌握好两个守恒(电荷守恒和物料守恒)。
与平衡常数相关的计算: ①熟记各平衡常数表达式及相互关系,如K w、 K a、 K b、 K h(K h=K w/K a、 K h1=K w/K a2、 K h2=K w/K a1或K h=K w/K b)、 K sp(帶n个单位正电荷的阳离子水解常数K h=K n w/K sp,)等;②巧用图像中的起点、交叉点及特殊点计算相关K值;③巧用溶液中的两个守恒计算相关K值。
参考文献:
[1][4][6]教育部考试中心.2017年普通高等学校招生全国统一考试大纲的说明(理科)[M].北京: 高等教育出版社,2017: 349~391.
[2][5]教育部考试中心.丰富试题素材发挥引导作用——2017年高考化学试题评析[J].中国考试,2017,(7): 22~26.
[3]单旭峰.在继承的基础上探索创新——2017年高考全国卷化学试题解读[J].中学化学教学参考,2017,(7): 59~61.

