肺炎支原体感染对川崎病患儿的影响*
王晓华,赵建美
(南通大学附属医院,江苏 南通 226001)
川崎病(kawasaki disease,KD)是由免疫反应 介导的急性血管炎综合征。主要累及中小动脉,可造成多脏器功能损伤,以冠状动脉损害(coronary artery lesions,CAL)最为严重。近年来KD发病率增高,已成为小儿后天获得性心脏病的首要病因,也是成人缺血性心脏病的重要危险因素之一。研究显示,某些细菌、病毒及支原体等的感染可能与KD发病相关[1-3]。临床上常有KD患儿合并有支原体肺炎,肺炎支原体(mycoplasma pneumonia,MP)感染对KD患儿炎症状态、脏器损害尤其是CAL有无影响,本研究通过对近两年该院收治的128例KD患儿临床资料进行回顾性分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年6月-2017年6月南通大学附属医院儿科收治的128例KD患儿。其中,男性76例,女性52例;平均年龄(27.9±27.2)个月。所有病例均符合第七次世界小儿KD研讨会修订的诊断标准[4],均给予静脉丙种球蛋白(intravenous immunoglobulin,IVIG)1~2 g/kg联合阿司匹林治疗。首剂IVIG无反应共18例,其中14例追加IVIG 2 g/kg,2例加用甲强龙,另有2例追加IVIG后体温仍反复,加用甲强龙后逐渐好转。根据血清MP-IgM抗体检测结果,阳性为MP感染组,阴性为非MP感染组。MP感染组42例。男性26例,女性16例;平均年龄(31.3±29.3)个月。非MP感染组86例。男性50例,女性36例;平均年龄(26.3±26.1)个月。两组性别、年龄比较,差异无统计学意义(P>0.05)。MP感染组视年龄和病情等因素加用红霉素/阿奇霉素静滴或口服。
1.2 实验室检测
入院当日(KD急性期)采外周静脉血8 ml,同期检测MP-IgM抗体、血常规、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、肝功能。治疗后7~10 d(KD缓解期)再次采血2 ml,复查血常规、CPR。MP-IgM抗体检测应用酶联免疫法,由该院检验科技术人员按说明书操作,试剂购自深圳市亚辉龙生物科技股份有限公司。检测结果S/CO值≥1.1为MP-IgM阳性,提示MP急性感染或现症感染。
1.3 心脏超声心动图检查
分别于KD急性期及病程1个月左右行心脏超声心图检查,重点探查左、右冠状动脉(冠脉)的起始部及其行走,测量冠脉起始部内径及主动脉瓣环内径(internal diameter of aortic valve ring,AOA)。CAL诊断标准:<3岁:冠脉内径≥2.5mm;3~9岁:冠脉内径≥3.0 mm;>9岁:冠脉内径≥3.5 mm。由于冠脉与AOA内径比值不受年龄、性别、身高、体重及体表面积等因素影响[5],且冠脉扩张以左冠脉(left coronary artery,LCA)主干最为常见,通过LCA/AOA比值(2次结果高值)来间接反映冠脉损害的严重程度。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,两组比较行t检验;计数资料采用率(%)表示,组间比较采用χ2验检,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床特征分析
两组性别、年龄、热程、体征最早出现时间及不完全KD比例方面比较,差异无统计学意义(P>0.05)。MP感染组发生IVIG无反应比例高于非MP感染组,差异有统计学意义(P<0.05)。见表1。
2.2 两组炎症指标比较
急性期两组患儿白细胞计数(white blood cell,WBC)、血小板计数(platelets,PLT)比较,差异无统计学意义(P>0.05)。MP感染组中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、hs-CRP与ESR均高于非MP感染组(P<0.05)。缓解期两组WBC、NLR、PLR比较,差异无统计学意义(P>0.05),MP感染组PLT、hs-CRP高于非MP感染组,差异有统计学意义(P<0.05)。见表2。

表1 两组临床特征比较
2.3 两组脏器损伤情况比较
MP感染组CAL发生率和LCA/AOA比值均高于非MP感染组,差异有统计学意义(P<0.05)。两组谷丙转氨酶(alanine aminotransferase,ALT)比较,差异无统计学意义(P>0.05)。见表3。
表2 两组炎症指标比较 (±s)

表2 两组炎症指标比较 (±s)
急性期WBC/(×109/L) NLR PLT/(×109/L) PLR hs-CRP/(mg/L) ESR/(mm/h)MP 感染组(n =42) 16.30±5.47 5.51±3.30 342.43±127.17 140.61±68.31 106.35±58.49 62.38±25.62非 MP 感染组(n =86) 14.99±6.50 2.76±2.24 369.45±117.42 102.60±55.80 55.06±35.49 51.22±23.00 t值 1.118 4.888 -1.19 3.356 5.231 2.482 P值 0.266 0.000 0.236 0.001 0.000 0.014组别缓解期WBC/(×109/L) NLR PLT/(×109/L) PLR hs-CRP/(mg/L)MP 感染组(n =42) 8.58±3.42 0.86±0.86 540.29±173.69 141.31±72.34 7.22±6.45非 MP 感染组(n =86) 7.67±2.65 0.86±1.07 484.65±130.83 133.66±57.57 4.57±4.84 t值 1.514 -0.029 2.022 0.647 2.364 P值 0.135 0.977 0.045 0.519 0.021组别
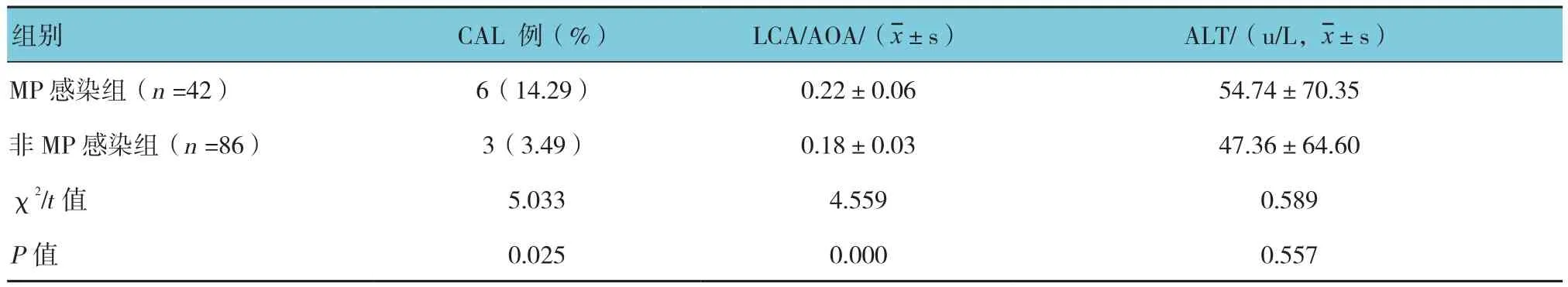
表3 两组脏器损伤情况比较
3 讨论
KD病因尚未明确,流行病学资料显示其感染可能与KD发病相关。目前文献报道与KD有关的病原体有数十种(包括假结核耶尔森菌、冠状病毒、支原体及衣原体等[1-3])。临床上KD合并支原体肺炎者并不少见,国内外均有KD合并MP感染的病例报道,且发现KD发病与MP感染有关联[3,6]。本研究通过回顾性分析KD患儿的病例资料,发现KD患儿的MP感染率比国外PARK[6]报道高,比国内范秋红[7]报道低,考虑可能与MP流行的地域性等因素有关。
近年来MP感染呈阶段性流行特征,发病年龄也趋于低龄化。MP感染最常见是引起肺炎,致病机制主要通过直接黏附、释放毒素及代谢产物等损伤呼吸道黏膜,以及激活机体细胞和体液免疫,产生自身抗体、免疫活性细胞,释放白细胞介素6、肿瘤坏死因子α等多种细胞因子来加重炎症反应[8]。MP感染诱发的肺外损伤可累及心血管、消化道、皮肤、血液及神经等多个系统。肺外损伤的机制目前认为存在3个途径[9]:①局部产生细胞因子引起的直接损伤;②免疫调节如自身免疫等介导的间接损伤;③血管炎和(或)血栓形成导致血管闭塞。本研究选择临床常用的hs-CRP、ESR、血常规指标来分析MP感染对KD机体炎症的影响,选择ALT和LCA/AOA来比较两组肺外脏器损伤情况。
hs-CRP属于急性时相蛋白,同ESR一样,都是传统的非特异性炎症指标。当机体处于感染、组织损伤和坏死、免疫炎症反应状态时,两者都会升高。NLR、PLR是新型的综合性炎症标志物,已成为多个领域研究热点[10-11],被认为是评估全身炎症反应程度的可靠指标,已证实NLR、PLR与溃疡性结肠炎、类风湿关节炎等自身免疫性疾病的病情活动相关[12-13]。研究发现,在休克、脓毒血症等危重患者中,中性粒细胞增高而淋巴细胞降低,且病情严重程度与两者的比值密切相关[14]。在全身感染和炎症反应的情况下,促炎因子增多刺激巨核细胞增生,因此PLT也会增高[15]。本研究发现,MP感染组KD患儿机体炎症反应更重,考虑与MP免疫损伤机制有关。同时也提示NLR、PLR整合中性粒细胞、淋巴细胞及血小板3者的比值信息,比WBC、PLT更能反映机体的炎症状态。
在器官功能损伤方面,MP感染KD患儿更易发生冠脉病变,与国内一项大样本调查研究结果相吻合[16]。KD急性期免疫失调,T、B淋巴细胞和单核/巨噬细胞过度激活,释放大量细胞因子,导致血管内皮细胞损伤、内皮功能障碍,引发血管炎。当合并MP感染,免疫炎症反应进一步放大,体内免疫细胞、自身抗体及炎症因子等持续增高,基质金属蛋白酶表达上调,血管壁支撑结构破坏,血管重塑,可导致冠脉扩张,甚至形成动脉瘤[17]。
IVIG是治疗KD的一线药物,大剂量IVIG能抑制自身抗体和细胞因子产生,阻断血管内皮细胞表面的免疫反应,减轻血管内皮损伤,有效预防CAL的发生。但有10%~20% KD患儿对首剂IVIG无反应,表现为持续发热(体温≥38.5℃)或者热退2~7 d甚至2周内再次发热,并伴有至少1项KD主要诊断标准,该患儿往往伴随更高的CAL发生率[18]。KD患儿IVIG治疗反应性与基因型及合并感染等多种因素有关。研究表明,血小板活化因子-乙酰水解酶可能是IVIG无反应型KD的易感基因[19]。IVIG治疗反应性与FcγR基因多态性相关,FcγR2C和FcγR3B基因拷贝量影响IVIG治疗的反应性[20]。本研究中MP感染组发生IVIG无反应的比例高于非MP感染组,经追加IVIG治疗多能好转,分析原因可能为MP感染诱发肺外损伤,产生细胞因子和自身免疫活性分子,加重KD急性期机体炎症反应,而使得首剂IVIG用量相对不足。同时这也提示MP感染有可能成为预测IVIG无反应的因素之一。
综上所述,合并MP感染KD患儿机体免疫炎症反应更为强烈,发生IVIG无反应和CAL风险均增高,治疗成本增加,对患儿远期预后有不良影响。因此临床工作中需重视MP感染的诊断与治疗。MP感染能否用于预测IVIG无反应以及CAL发生,还有待进一步扩大样本量评价其效能。
参 考 文 献:
[1] HORINOUCHI T, NOZU K, HAMAHIRA K, et al. Yersinia pseudotuberculosis infection in Kawasaki disease and its clinical characteristics[J]. BMC Pediatr, 2015, 15(12): 177-186.
[2] GIRAY T, BIÇER S, KÜÇÜK Ö, et al. Four cases with Kawasaki disease and viral infection: aetiology or association[J]. Infez Med,2016, 24(4): 340-344.
[3] TANG Y, YAN W, SUN L, et al. Kawasaki disease associated with mycoplasma pneumoniae[J]. Ital J Pediatr, 2016, 42(1): 83.
[4] Japaness Circulation Society Joint Research Group. Guidelines for diagnosis and management of cardiovascular sequelae in Kawasaki disease[J]. Pediatr Int, 2005, 47(6): 711-732.
[5] TAN T H, WONG K Y, CHENG T K, et al. Coronary normograms and the coronary-aorta index: objective determinants of coronary artery dilatation[J]. Pediatr Cardiol, 2003, 24(4): 328-335.
[6] PARK H R, HAN M Y, YOON K L, et al. Mycoplasma infection as a cause of persistent fever after intravenous immunoglobulin treatment of patients with Kawasaki disease: frequency and clinical impact[J]. Infect Chemother, 2017, 49(1): 38-43.
[7] 范秋红, 严文华, 王波, 等. 肺炎支原体感染对川崎病及冠状动脉病变的影响[J]. 中国血液流变学杂志, 2010, 20(2): 284-285.
[8] LEEKY. Pediatric respiratory infections by mycoplasma pneumonia[J]. Expea Rev Anti Infect Ther, 2008, 6(4): 509-521.
[9] NARITA M. Pathogenesis of extrapulmonary manifestations of mycoplasma pneumoniae infection with special reference to pneumonia[J]. J Infect Chemother, 2010, 16(3): 162-169.
[10] ÇIÇEK G, AÇIKGOZ S K, BOZBAY M, et al. Neutrophillymphocyte ratio and platelet-lymphocyte ratio combination can predict prognosis in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J]. Angiology, 2015, 66(5): 441-447.
[11] LIAN L, XIA Y Y, ZHOU C, et al. Application of platelet/lymphocyte and neutrophil/lymphocyte ratios in early diagnosis and prognostic prediction in patients with resectable gastric cancer[J]. Cancer Biomark, 2015, 15(6): 899-907.
[12] 朱波, 朱丽华, 巴荣, 等. 类风湿关节炎患者外周血中性粒细胞淋巴细胞比率血小板淋巴细胞比率和红细胞体积分布宽度与病情活动的相关性分析[J]. 中华风湿病学杂志, 2016, 20(12):832-835.
[13] TORUN S, TUNC B D, SUVAK B, et al. Assessment of neutrophil-lymphocyte ratio in ulcerative colitis: a promising marker in predicting disease severity[J]. Clin Res Hepatol Gastroenterol, 2012, 36(5): 491-497.
[14] ZAHOREC R. Ratio of neutrophil to lymphocyte counts-rapid and simple parameter of systemic inflammation and stress in critically ill[J]. Bratisl Lek Listy, 2001, 102(1): 5-14.
[15] KLINGER M H, JELKMANN W. Role of blood platelets in infection and inflammation[J]. J Interferon Cytokine Res, 2002,22(9): 913-922.
[16] 赵春娜, 杜忠东. 感染因素对川崎病及其冠状动脉病变的影响[J]. 中国循证儿科杂志, 2015, 10(6): 454-457.
[17] 段超, 杜忠东. 血管内皮祖细胞与川崎病冠状动脉并发症的血管新生[J]. 中华儿科杂志, 2011, 49(5): 397-400.
[18] XIE T, WANG Y, FU S, et al. Predictors for intravenous immunoglobulin resistance and coronary artery lesions in Kawasaki disease[J]. Pediatr Rheumatol Online J, 2017, 15(1):17-26.
[19] MINAMI T, SUZUKI H, TAKEUCHI T, er al. A polymorphism in plasma platelet-activating factor acetylhydrolase is involved in resistance to immunoglobulin treatment in Kawasaki disease[J]. J Pediatr, 2005, 147(1): 78-83.
[20] MAKOWSKY R, WIENER H W, PTACEK T S, et al. Fcγ R gene copy number in Kawasaki disease and intravenous immunoglobulin treatment response[J]. Pharmacogenet Genomics,2013, 23(9): 455-462.

